上消化道癌新辅助治疗后淋巴结病理评估的现状和展望
2024-03-07徐嘉琪薛丽燕
徐嘉琪,薛丽燕
我国是上消化道癌高发国家,胃癌发病率位居所有恶性肿瘤的第3位,食管癌位居第6位[1]。随着近年对围手术期治疗模式的不断探索和应用,术前新辅助治疗在上消化道癌近、远期疗效中的优势引起了广泛关注。RESOLVE(2012,中国)研究证实了SOX(S-1和奥沙利铂)新辅助化疗对中国进展期胃癌患者的优效性[2],该结果被中国临床肿瘤学会(CSCO)胃癌诊疗指南作为ⅠA类证据纳入Ⅰ级推荐,推进了我国进展期胃癌新辅助治疗模式的进程[3]。CROSS(2004,荷兰)研究显示,新辅助同步放、化疗可改善食管癌或食管胃交界部癌患者的总生存率[4],这奠定了新辅助同步放、化疗作为局部晚期可切除食管癌标准治疗的地位,该结果同样被CSCO食管癌诊疗指南作为ⅠA类证据纳入Ⅰ级推荐[5]。近年来,新辅助化疗联合免疫治疗在食管癌和胃癌的临床试验中也取得初步较好的结果。与单纯手术相比,新辅助治疗模式可提高R0切除率,降低术后复发率,改善患者预后[6]。新辅助治疗后可评估临床试验治疗方案的有效性,对患者个体而言,可以预测预后,并可评估肿瘤对某些药物的响应,为手术后辅助治疗方案提供依据。新辅助治疗后准确的病理评估可以较快且准确地显示治疗方案的有效性。国内上消化道癌新辅助治疗后病理评估虽已逐步规范,但目前的评估方法仅强调评价原发灶,不涉及淋巴结的评估,而术前新辅助治疗可使上消化道癌的大小、浸润深度和淋巴结转移状况均发生改变。原发灶和淋巴结转移灶的治疗反应可能会不一致,评估淋巴结治疗反应情况亦十分重要。目前国内对上消化道癌新辅助治疗后淋巴结治疗反应的病理评估尚未引起重视,日常工作中未普及应用,也尚无评估方法的指南和共识[7],因此亟需提高对淋巴结治疗反应病理评估的认识。本文围绕上述问题进行系统地阐释,以提高病理医师在工作实践中的理解和认识。
1 上消化道癌新辅助治疗后原发灶的治疗反应/肿瘤退缩病理评估分级方法
目前常用的肿瘤退缩分级(TRG分级)方法可对食管癌、胃癌、结直肠癌等肿瘤新辅助治疗后原发灶病理形态的改变进行疗效评估[8]。TRG分级评估又可分为两大类:根据治疗相关纤维化与残余肿瘤的相对关系评估(如Mandard、AJCC/CAP或Dworak系统);根据残存肿瘤占瘤床的比例评估(如Becker、Rödel或JES系统)[9-13]。
2 上消化道癌新辅助治疗后淋巴结的治疗反应/肿瘤退缩病理评估
2.1 新辅助治疗后淋巴结病理评估的意义上消化道癌最常见的转移方式是经淋巴系统转移。淋巴结转移与否和淋巴结转移数量是患者全身复发和长期生存强有力的预测因素[14]。淋巴结转移癌退缩情况对上消化道癌的预后预测也具有重要意义,且对新辅助治疗方案的评价及后继治疗方案的选择具有重要指导作用,优于仅对原发灶的评价[15]。Smyth等[16]对胃癌新辅助化疗的研究表明,原发灶TRG分级并非是总生存期(overall survival, OS)的独立预测因素,淋巴结转移灶的残存(ypN+)是OS的唯一独立预测因素。Yin等[17]探讨了原发灶TRG分级联合ypN状态对食管胃交界部癌和胃癌新辅助治疗的预测价值,研究结果表明两者联合是无瘤生存期(disease-free survival, DFS)和OS的独立预测因素。
Nieman等[18]将接受新辅助化疗或放、化疗后的食管腺癌切除术标本中所有淋巴结分成三类:(1)无淋巴结转移证据;(2)有先前转移的证据,但目前未见存活转移灶残存(称为治疗反应淋巴结);(3)有淋巴结转移灶残存。该研究建立了将治疗反应淋巴结计入转移淋巴结数量的新分期方法,与传统AJCC/UICC食管癌TNM分期(将治疗反应淋巴结视为非转移淋巴结)进行对比分析,发现对无淋巴结转移或淋巴结转移个数少(ypN0或ypN1)的患者,按新分期方法进行评估,增加1个或2个治疗反应淋巴结导致的分期升高,与患者预后不良有关;而对于淋巴结广泛转移(ypN2或ypN3)的患者,增加1个治疗反应淋巴结几乎无增量效应,这可能因为该类患者复发的风险已较高。Nieman等的研究结果提示准确评估淋巴结病理状态非常重要。将有治疗反应证据、但无存活肿瘤的淋巴结视为阴性淋巴结可能会导致病理分期偏低,未来修订分期系统的工作也应考虑将“治疗反应淋巴结”纳入分期。
2.2 新辅助治疗后淋巴结治疗反应的特点新辅助治疗后淋巴结的组织学改变与肿瘤原发灶类似,镜下常表现为无细胞的角化物或黏液湖、纤维化、钙化、肉芽肿、泡沫细胞和多核巨细胞反应。淋巴结内仅出现无肿瘤细胞的角化物或黏液湖不能认为是肿瘤转移残存[5]。此外,肿瘤原发灶和淋巴结转移灶反应不一致的比例较高,即原发灶无明显治疗反应而转移灶治疗反应明显,或原发灶治疗反应明显而转移灶无明显治疗反应。Moore等[15]对新辅助化疗后食管腺癌进行研究,发现21.9%患者出现治疗反应不一致现象。
NCCN指南建议食管癌和食管胃交界部癌的淋巴结取材不少于15枚,胃癌淋巴结取材不少于16枚,有助于判断患者预后。而经新辅助治疗后淋巴结大小发生改变,导致取材困难,可能难以取得标准数量以上的淋巴结。一些较小的转移淋巴结治疗后治疗反应可不明显,可能缺乏纤维化、钙化、泡沫细胞和多核巨细胞等形态学表现,但明确这些较小的淋巴结的治疗反应对于患者的预后也具有预测价值。已有研究表明直肠癌新辅助治疗后,术后区域淋巴结转移状态、淋巴结检取数量对术后的治疗方案选择存在影响,可能影响患者预后和生活质量[19]。这提示在进行上消化道癌取材时也应尽可能地检出所有淋巴结。
需要注意的是,新辅助治疗后淋巴结的多个形态学特征也可以在未接受新辅助治疗的淋巴结中观察到,因此需要将治疗反应和其他原因所致的形态学改变区分开来,如在非肿瘤性疾病中,感染性或自身免疫性疾病淋巴结也可见肉芽肿和浆细胞;呼吸系统引流范围的淋巴结(如隆突下淋巴结)常可见炭末沉积导致的纤维化[20]。这些情况在上消化道癌尤其是食管癌的淋巴结中也可发生,需要引起注意,准确鉴别。
2.3 国内病理实践及指南的现状目前国内上消化道癌新辅助治疗后病理报告对原发灶基本做到规范的TRG评级报告,但对淋巴结的评估缺乏共识和规范,仅部分医院会粗略报告是否有治疗反应,一般不会报告淋巴结治疗反应的程度。此外,新辅助治疗后淋巴结的检出数量也常常不足,虽然有多种检取方法可增加淋巴结的检出量(如全系膜包埋法、薄切减少组织厚度等),但这些方法耗时更长,且增加了病理检查的成本[19]。
2023年CSCO食管癌诊疗指南推荐的肿瘤退缩分级只适用于对原发肿瘤的评估,不适用于评估转移病灶。CSCO食管癌诊疗指南中未提出针对淋巴结治疗反应的病理评估和分级标准[5]。中国食管癌围手术期免疫治疗专家共识(2021年)也提出:食管癌新辅助免疫治疗后包括原发灶和转移淋巴结在内的病理学评估标准尚需进一步探究(证据质量:低;共识水平:占91.9%)。该共识指出国内缺乏针对处理和评估新辅助治疗后食管癌手术标本的规范性指南以指导临床研究和临床实践,缺乏新辅助治疗后病理退缩分级标准[21]。胃癌相关国内指南和共识也同样未提及新辅助治疗后淋巴结治疗反应的病理评估和分级标准[3]。
2.4 研究进展针对常见肿瘤尤其是肺癌和上消化道癌新辅助治疗后淋巴结的治疗反应评价和分级方法,越来越受到广泛关注。
Cottrell等[22]针对非小细胞肺癌对新辅助免疫治疗的病理特征,提出定量免疫相关病理反应标准(irPRC)的方案。该方法定义:新辅助免疫治疗后,免疫相关残存肿瘤百分比(irRVT%)=残存肿瘤面积/总肿瘤床面积,总肿瘤床=退缩床+残存肿瘤(RVT)+坏死。退缩床为影像和病理可识别的“肿瘤块”区域,该区域通常被增殖性纤维化取代,伴新生血管形成。如果存在多个原发性肿瘤灶,则将每个病灶的面积相加,使%irRVT表示总原发性肿瘤负荷。对于转移性淋巴结也可以参考原发灶评估方法对淋巴结的%irRVT进行评估。Pataer等[23]的研究纳入接受新辅助化疗的肺癌患者,评估原发灶和任何有转移的淋巴结。该研究将残存肿瘤的估计横截面积除以每张载玻片上坏死、纤维化和炎症的总估计横截面积,评估每个淋巴结中残存肿瘤占总瘤床面积的百分比。肺癌原发灶常用残存肿瘤小于总瘤床面积的10%,即原发肿瘤的主要病理反应(PT-MPR)作为长期生存的预测指标。而在该研究中,Pataer等应用TIBCO Spotfire S-plus软件确定淋巴结残存肿瘤百分比的最佳临界值为70%,定义为淋巴结的主要病理反应(LN-MPR)。参照上述指标,淋巴结残存肿瘤细胞占总瘤床面积超过70%的患者为LN-MPR-,反之则为LN-MPR+;原发灶残存肿瘤细胞占总瘤床面积超过10%的患者为PT-MPR-,反之则为PT-MPR+。然后将PT-MPR和LN-MPR状态相结合,把患者分为4组:PT-MPR+/LN-MPR+、PT-MPR+/LN-MPR-、PT-MPR-/LN-MPR+和PT-MPR-/LN-MPR-。研究发现PT-MPR+/LN-MPR+组(100%)和PT-MPR+/LN-MPR-(100%)组患者的4年总生存率显著高于PT-MPR-/LN-MPR+组(55%)和PT-MPR-/LN-MPR-组(25%)患者,且PT-MPR/LN-MPR联合状态与新辅助化疗后非小细胞肺癌的预后显著相关。上述两项肺癌有关研究详尽描述了淋巴结治疗反应的评估方法,对于上消化道癌新辅助治疗后淋巴结病理评估具有重要的参考价值。
上消化道癌方面,一项基于德尔菲(Delphi)法的针对食管和胃食管交界部腺癌新辅助治疗后的肿瘤退缩分级的国际共识推荐转移淋巴结的治疗反应用三级系统评估,即A级:完全退缩(仅有退缩特征,如纤维化或无活细胞的黏液湖);B级:部分退缩(活的肿瘤细胞伴有退缩改变);C级:无退缩(无肿瘤反应迹象)[24]。
Hagi等[25]根据淋巴结残存肿瘤面积占淋巴结转移总肿瘤床面积(包括残存肿瘤面积和治疗反应面积)的比例,参照原发灶Becker TRG分级,提出将食管鳞状细胞癌新辅助治疗病例的淋巴结肿瘤退缩分级(LN-TRG)分为4级:Ⅰ级,残存肿瘤>50%;Ⅱ级,残存肿瘤占10%~50%;Ⅲ级,残存肿瘤<10%;Ⅳ级,残存肿瘤为0。Ⅲ+Ⅳ级LN-TRG的患者被视为淋巴结应答者,Ⅰ+Ⅱ级的患者被视为淋巴结无应答者。对于具有多个转移淋巴结的患者,则根据所有转移淋巴结的残存肿瘤总面积相对于肿瘤床总面积的比例,按相同方法进行分级。该研究将提出的LN-TRG分级与原发灶Becker分级进行对比,无复发生存期的多因素分析显示,LN-TRG、ypN和ypT是独立预后因素,原发灶Becker分级不是独立预后因素。淋巴结应答者的5年无复发生存率显著高于淋巴结无应答者(66.4%vs26.5%,P<0.001)。这提示按淋巴结转移癌的残存比例来分级有很好的预后预测价值。
另有一项来自英国的食管腺癌多中心研究建立了类似的淋巴结退缩分级[15],该研究先根据每个转移淋巴结中残存肿瘤面积与淋巴结肿瘤床总面积的比值(LNRS)将淋巴结分为:LNRS1,完全退缩;LNRS2,残存肿瘤<10%;LNRS3,残存肿瘤10%~50%;LNRS4,残存肿瘤>50%;LNRS5,肿瘤无退缩。再将患者淋巴结按以下标准分级:完全淋巴结反应(至少有1个淋巴结被评为LNRS1,且任何淋巴结均无残存肿瘤);部分淋巴结反应(至少有1个淋巴结被评为LNRS 1~3,且至少1个淋巴结有残存肿瘤);淋巴结反应不良/无淋巴结反应(至少有1个淋巴结被评为LNRS 4~5)。原发灶治疗反应分为有反应者(Mandard TRG 1~3级)和无反应者(Mandard TRG 4~5级)。结果发现,无论原发灶治疗反应如何,完全淋巴结反应或部分淋巴结反应的患者均比淋巴结反应不良/无淋巴结反应患者有更高的生存率。有淋巴结转移的食管癌中,淋巴结对新辅助化疗的反应比原发肿瘤更能准确地预测患者的长期生存。
2.5 未来展望参考上述研究,未来可以通过计算淋巴结内残存肿瘤面积占淋巴结转移癌整个肿瘤床的比例来确定治疗后淋巴结的退缩程度(图1)[25-26]。
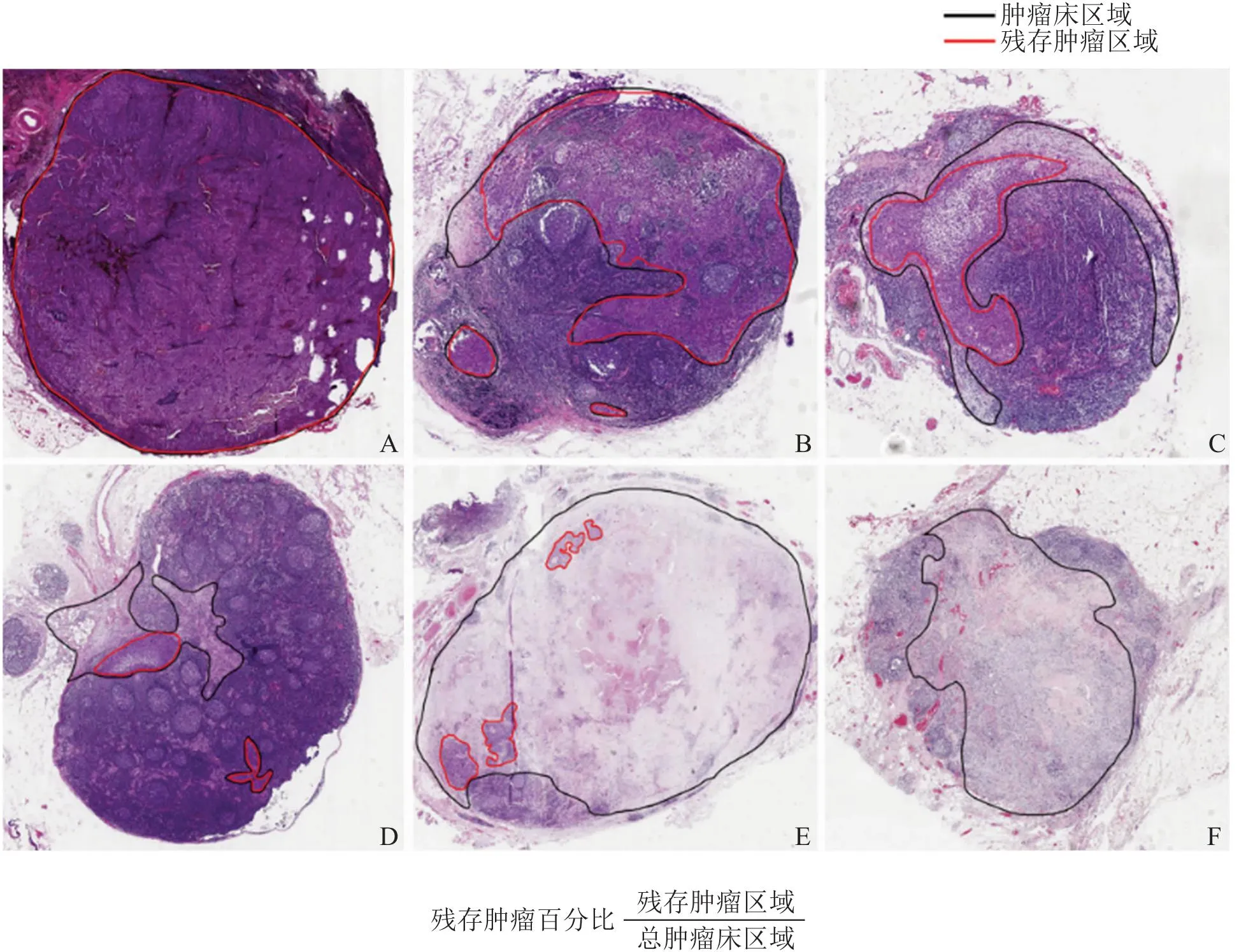
图1 HE染色示淋巴结残存癌计算示意图:A.肿瘤床区域均为活的肿瘤细胞(100%);B、C.在>50%的肿瘤床区域观察到活的肿瘤细胞;D.在10%~50%的肿瘤床区域观察到活的肿瘤细胞;E.在<10%的肿瘤床区域观察到活的肿瘤细胞;F.未在肿瘤床区域观察到活的肿瘤细胞(0)
随着图像识别人工智能技术的发展,未来有望借助相关人工智能技术,辅助识别淋巴结残存癌,并自动计算其占比及评级,提高客观性和准确性,并减少病理医师的工作量。
此外,为提高淋巴结的检出率,病理医师在取材时应尽可能找到足够数量的淋巴结。推荐采用触摸的方法在组织中寻找淋巴结;按照淋巴结的不同分区寻找;淋巴结较大者应切开全部包埋,淋巴结较小者应用滤纸单独包好,保证有效制片。
上消化道癌新辅助治疗后的评估应标准化。推荐采用下述模版(表1),准确和完整地报告接受新辅助治疗患者的手术切除标本,便于临床科室与病理科实现信息对称[20]。

表1 上消化道癌新辅助治疗效果评估表
A.残存活肿瘤+坏死灶+间质改变,三项之和应为100%;B.间质改变包括间质纤维化、黏液样变性、出血、含铁血黄素沉积、肉芽肿及泡沫细胞浸润等;C.淋巴结个数之和应与检出淋巴结总数一致
3 结语
新辅助治疗后淋巴结治疗反应的准确评估对预测预后相当重要,有必要把淋巴结的退缩分级纳入上消化道癌TRG分级中。应强调淋巴结取材的规范,尽可能寻找所有淋巴结,对于较大的淋巴结建议切开全部包埋,以准确评估淋巴结转移和治疗反应。为逐步建立统一的淋巴结反应评估分级方法,尚需基于更多的循证医学证据,制定和推广相关指南和共识。