干预自噬调控p62-Keap1/Nrf2-GPX4通路对结直肠癌细胞铁死亡及奥沙利铂耐药的影响
2024-03-07王苗苗张睿哲温菲菲许晓阳吴淑华
徐 磊,武 寒,王苗苗,张睿哲,温菲菲,许晓阳,吴淑华
结直肠癌是全球第三大常见癌症,也是癌症相关死亡的第二大原因[1]。术后复发和转移是结直肠癌患者死亡的重要原因,化疗依然是术后重要的辅助治疗。奥沙利铂(OXA)是治疗结直肠癌的一线化疗药物[2]。因肿瘤具有耐药性和长期使用产生不良反应,导致不足40%的晚期结直肠癌患者受益于OXA[3]。因此,探究结直肠癌OXA耐药的分子机制对改善OXA对晚期结直肠癌患者的预后具有重要意义。
近年研究发现,铁死亡与肿瘤耐药密切相关,铁死亡是一种依赖于细胞内铁积累和脂质过氧化的细胞程序性死亡形式[4]。谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)是铁死亡的重要调节因子,干预以GPX4为代表的脂质过氧化物酶途径促使肿瘤细胞发生铁死亡可能成为逆转肿瘤耐药的新思路[5]。研究表明,GPX4表达与自噬适配器p62、Kelch样Ech相关蛋白1(Kelchike Ech-associated protein 1, Keap1)、核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)构成的p62-Keap1/Nrf2细胞氧化应激信号通路密切相关[6]。p62作为重要的选择性自噬接头蛋白,是重要的自噬激活标志物。自噬被认为是维持细胞稳态的关键过程,LC3是公认的自噬标志物[7]。目前,越来越多的研究表明自噬参与了铁死亡调节[8]。本课题组前期实验结果显示,结直肠癌中存在铁死亡现象,其与Keap1/Nrf2-GPX4表达有关,且与患者预后密切相关[9]。本实验通过细胞培养、药物干预,观察干预结直肠癌细胞自噬对p62-Keap1/Nrf2-GPX4-铁死亡及耐药的影响,探讨自噬调控铁死亡抑制肿瘤细胞增殖、侵袭和逆转OXA耐药性的可行性及其分子机制,为抑制结直肠癌的发生、发展并逆转耐药提供新思路。
1 材料与方法
1.1 材料
1.1.1细胞系 人结肠癌细胞系HCT-8、COLO205、SW480、SW620、HCT-116及OXA耐药细胞株HCT-116/OXA均购自中国科学院典型培养物保藏委员会细胞库,胎牛血清和RPMI-1640培养基购自美国Gibco公司。
1.1.2试剂 β-actin、LC3、p62、Keap1、Nrf2抗体均购自美国Abcam公司;GPX4抗体购自Affinity公司;辣根过氧化物酶标记的羊抗兔多克隆IgG二抗购自福州迈新公司;细胞增殖及细胞计数试剂盒-8(cell counting kit-8, CCK-8)购自日本同仁化学研究所;OXA、雷帕霉素(Rapa)、氯喹(CQ)、Erastin、Fer-1和FerroOrange荧光探针均购自GlpBio公司;细胞内自噬染色测定试剂盒[单丹磺酰尸胺(dansylcadaverine, MDC)法]、Western blot凝胶试剂盒、RIPA细胞裂解液等试剂盒和丙二醛(Malonic dialdehyde, MDA)、还原型谷胱甘肽(glutathione, GSH)检测试剂盒均购自上海碧云天公司,铁离子检测试剂盒购自Solarbio公司;吉姆萨染液购自北京索莱宝公司;Transwell双层细胞培养板购自美国Corning公司。
1.2 方法
1.2.1细胞培养 HCT-8、COLO205、SW480、SW620、HCT-116和耐药细胞株HCT-116/OXA接种于含5%胎牛血清的RPMI-1640培养基中,置于37 ℃ 5%CO2培养箱中培养。OXA耐药的HCT-116/OXA细胞在含5 μmol/L OXA的培养基中持续培养1周维持抗性。每隔2天换液1次,每3天用0.25%胰蛋白酶消化传代,取对数生长期的细胞进行后续实验。
1.2.2Western blot法 收集细胞提取蛋白,采用BCA法测定蛋白浓度。各组取30 μg蛋白进行凝胶电泳分离,并将其转印至PVDF膜上,经10%脱脂奶粉封闭2 h。一抗4 ℃孵育过夜,二抗室温孵育1 h,滴加ECL发光液,成像系统曝光。利用Image J软件分析目标图像。
1.2.3自噬和铁死亡干预实验 选取HCT-116/OXA耐药细胞株,分为自噬激活剂Rapa和自噬抑制剂CQ干预组,又根据对铁死亡的干预分为不同亚组:Rapa组、Fer-1组、Rapa+Fer-1组、CQ组、Erastin组、CQ+Erastin组及相应的对照组。根据预实验,设诱导自噬及铁死亡改变的最低药物浓度为干预剂浓度,在各组细胞系中分别加入Rapa(0.10 μmol/L)、CQ(10.00 μmol/L)、Erastin(10.00 μmol/L)、Fer-1(1.00 μmol/L)和完全培养基各200 μL,培养24 h。确定干预成功后,用于后续实验。
1.2.4MDC染色 应用MDC染色检测细胞系中自噬体的形成。制备细胞悬液,以每孔2×105个细胞接种于6孔板内,药物干预后吸弃培养液,向每孔中加入1 mL MDC染液,温箱孵育30 min后置于荧光显微镜下观察,高倍镜下随机选取5个视野,计数自噬激活细胞数所占百分比,取其平均值。
1.2.5Fe2+、MDA和GSH含量测定 按照试剂盒说明书,使用相应试剂盒测定结直肠癌细胞中Fe2+、MDA和GSH的含量。酶标仪检测各指标吸光度值,并计算其在细胞内的含量。
1.2.6FerroOrange荧光探针检测活细胞内Fe2+含量 将HCT-116/OXA细胞计数后以每孔2×105个细胞接种于6孔板,药物干预后吸弃培养液,向每孔加入500 μL经无血清培养稀释的FerroOrange工作液(1 μmol/L),置于培养箱中孵育30 min。荧光显微镜下观察各组细胞的荧光强度。
1.2.7CCK-8实验 应用CCK-8实验对细胞系进行OXA药物毒性测试。制备细胞悬液,设置实验组和对照组,以每孔1×103个细胞接种于96孔板,每组设计4个复孔。在实验组和对照组中分别注入200 μL含不同浓度OXA的培养基和不含药物的培养基,培养24 h。弃置液体后注入10 μL CCK-8染液,37 ℃下温育1 h后于酶标仪450 nm处测量吸光度(OD)值,计算细胞存活率/抑制率。
1.2.8联合OXA干预HCT-116/OXA细胞株生物学活性实验 选取联合OXA干预实验细胞株(分组同1.2.3),分别在6孔板中加入2 mL自噬干预剂或铁死亡干预剂(药物浓度同1.2.3)及等量生理盐水预处理6 h,之后吸出培养液,取2 mL自噬干预剂或铁死亡干预剂及OXA[OXA浓度为半数抑制浓度(IC50)=141.94 μmol/L]混合液加入实验组中,OXA对照组中加入等量生理盐水,培养24 h后,进行生物学活性实验。
1.2.9细胞侵袭试验 Transwell小室模型置于24孔板中,制备浓度为每毫升5×105个细胞悬液。并于小室上层加入100 μL细胞悬液,下室加入600 μL含20%的胎牛血清培养基,每组细胞重复2个小室,连续培养24 h。用棉签轻轻擦除上室侧细胞和基质胶,甲醇溶液固定30 min后用吉姆萨染液染色,镜下观察穿透细胞数。每个腔室随机选取3个视野,计算平均值。
1.2.10平板克隆实验 制备细胞悬液,每组细胞分别以每孔500~1 000个细胞接种于6孔板内,并加入2 mL完全培养基,培养约1周,至产生肉眼可见的克隆球时结束。甲醇固定30 min后用吉姆萨染液染色,冲洗染色并风干,拍照并计算各组的克隆形成数。

2 结果
2.1 不同细胞系中LC3、p62、GPX4的表达Western blot法检测结果显示(图1A),LC3的表达量在HCT-8细胞中最低,在SW620细胞中最高(图1B);p62的表达量在HCT-8细胞中最高,在SW620细胞中最低(图1C);GPX4的表达量在HCT-8细胞中最高,在COLO205细胞中最低(图1D)。选择LC3中等表达量的HCT-116细胞株进行后续实验。
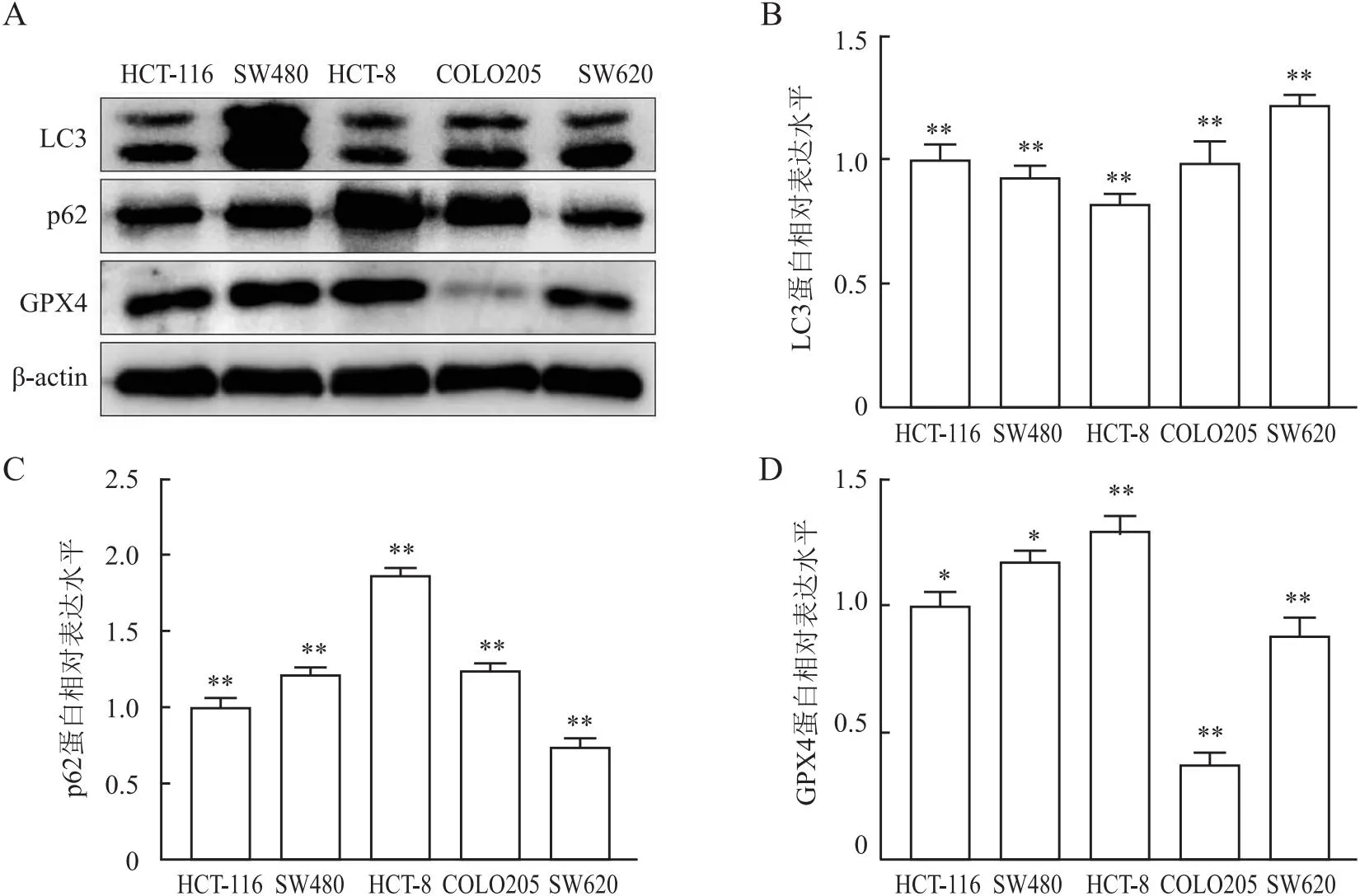
图1 结直肠癌细胞自噬关键蛋白和铁死亡关键蛋白的表达水平:A.Western blot法检测不同结直肠癌细胞系中LC3、p62、GPX4的表达;B.LC3的表达量柱状统计图;C.p62的表达量柱状统计图;D.GPX4的表达量柱状统计图;*P<0.05,**P<0.01
2.2 结直肠癌敏感、耐药细胞株中自噬和铁死亡相关因子的表达选择HCT-116细胞株,并委托原公司将其诱导成OXA耐药细胞株HCT-116/OXA进行后续实验。CCK-8实验检测两组细胞对OXA的敏感性,结果显示:HCT-116细胞的IC50为9.87 μmol/L,耐药细胞株HCT-116/OXA的IC50为141.94 μmol/L,明显高于亲本细胞株,差异有统计学意义(P<0.05,图2A),提示耐药诱导成功。采用Western blot法检测两组细胞中LC3、p62、Keap1、Nrf2、GPX4的表达。结果显示,HCT-116/OXA细胞中p62、Nrf2、GPX4蛋白表达明显高于HCT-116细胞株,而LC3、Keap1蛋白表达则显著降低(P<0.05,图2B、C)。试剂盒检测两株细胞中Fe2+、GSH、MDA的含量,结果显示,HCT-116/OXA细胞中Fe2+、GSH、MDA的含量均高于HCT-116细胞(P<0.05,图2D~F)。
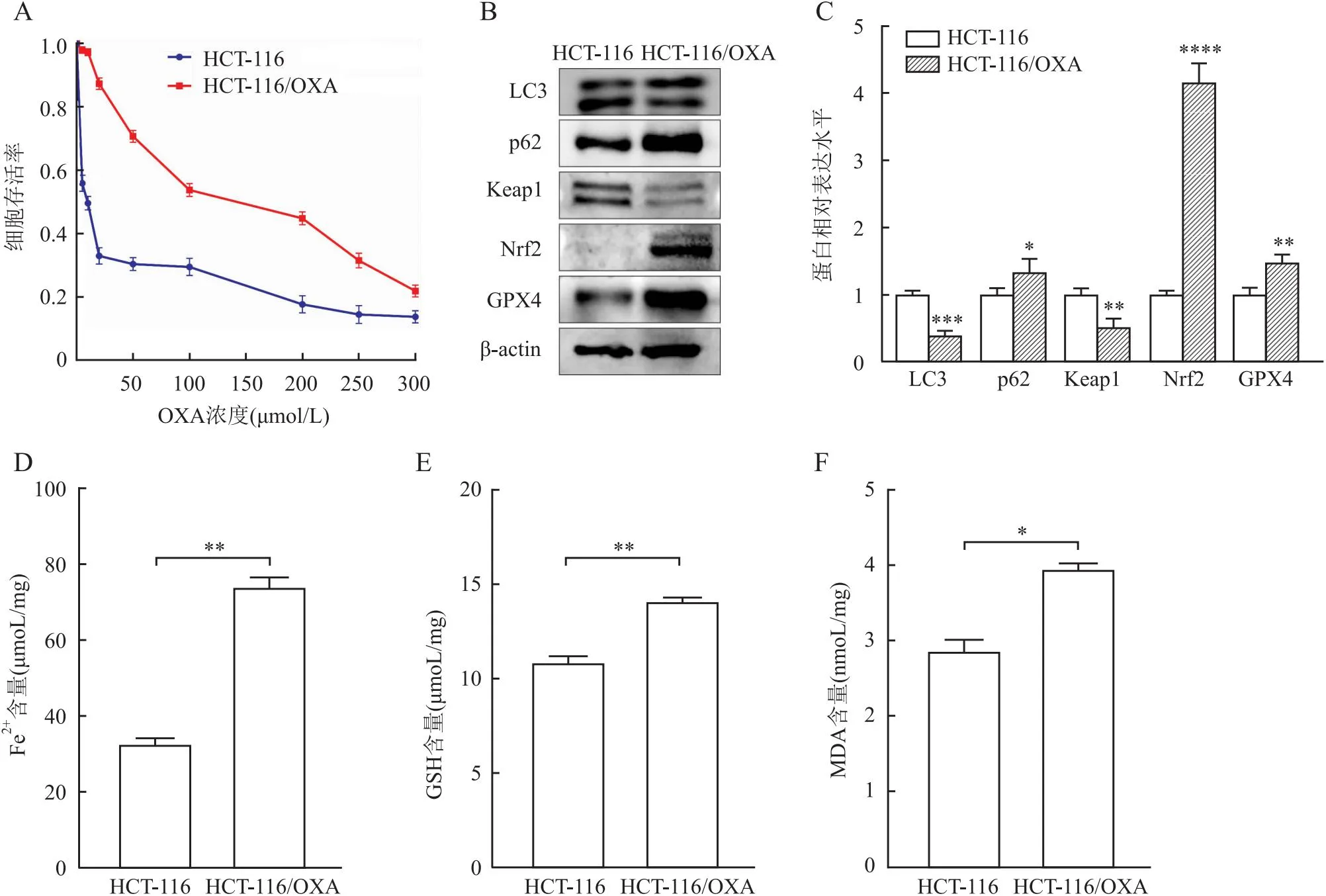
图2 结直肠癌敏感、耐药细胞株中自噬和铁死亡相关因子的表达:A.CCK-8实验检测敏感和耐药细胞对OXA的敏感性;B.Western blot法检测两组细胞中LC3、p62、Keap1、Nrf2、GPX4蛋白表达;C.两组细胞中LC3、p62、Keap1、Nrf2、GPX4蛋白表达量柱状统计图;D.两组细胞中Fe2+含量;E.两组细胞中GSH含量;F.两组细胞MDA中含量;*P<0.05,**P<0.01,***P<0.001,****P<0.000 1
2.3 干预自噬和铁死亡对HCT-116/OXA细胞铁死亡相关因子表达的影响选择HCT-116/OXA细胞株进行自噬和铁死亡干预实验,应用MDC染色法观察自噬活性,采用Western blot法检测LC3、p62、Keap1、Nrf2和GPX4表达水平。结果显示:自噬激活剂组中,Rapa组和Rapa+Fer-1组与其余两组相比,细胞内荧光颗粒显著增多,LC3表达升高,p62表达降低,提示自噬被激活;Keap1均呈高表达,Nrf2、GPX4均呈低表达,但Rapa+Fer-1组中GPX4的表达高于Rapa组(P<0.05)。而Fer-1组与对照组相比各项指标差异均无统计学意义(P>0.05,图3)。
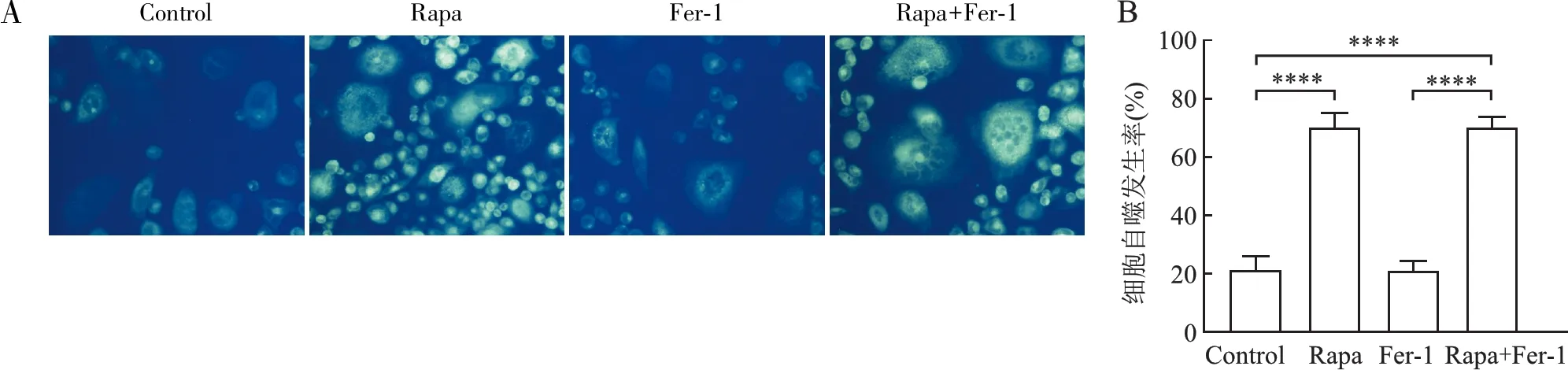
图3 Rapa和Fer-1干预结直肠癌细胞后LC3、p62、Keap1、Nrf2及GPX4蛋白表达水平:A.MDC染色检测不同干预组中的自噬水平;B.不同干预组中细胞自噬发生率;C.Western blot法检测不同干预组的蛋白表达水平;D.LC3蛋白表达柱状统计图;E.p62蛋白表达柱状统计图;F.Keap1蛋白表达柱状统计图;G.Nrf2蛋白表达柱状统计图;H.GPX4蛋白表达柱状统计图;*P<0.05,**P<0.01,***P<0.001,****P<0.000 1
在自噬抑制剂组中,与对照组和Erastin组相比,CQ组和CQ+Erastin组细胞内荧光颗粒显著增多,LC3、p62表达同步升高,提示自噬活性降低;Nrf2均呈高表达,Keap1均呈低表达(P<0.05)。对照组与Erastin组相比,CQ组与CQ+Erastin组相比,蛋白表达水平差异均无统计学意义(P>0.05)。GPX4在Erastin组中的表达显著低于其余三组,而在CQ组中的表达则高于其余三组(P<0.05,图4)。以上结果提示干预自噬可能通过p62-Keap1/Nrf2-GPX4通路调控结直肠癌细胞的铁死亡。

图4 CQ和Erastin干预结直肠癌细胞后LC3、p62、Keap1、Nrf2及GPX4蛋白表达水平:A.MDC染色检测不同干预组中的自噬水平;B.不同干预组中细胞自噬发生率;C.Western blot法检测不同干预组的蛋白表达水平;D.LC3蛋白表达柱状统计图;E.p62蛋白表达柱状统计图;F.Keap1蛋白表达柱状统计图;G.Nrf2蛋白表达柱状统计图;H.GPX4蛋白表达柱状统计图;*P<0.05,**P<0.01,***P<0.001,****P<0.000 1
2.4 干预自噬和铁死亡对HCT-116/OXA细胞Fe2+、GSH、MDA含量的影响应用试剂盒检测不同干预组中Fe2+、MDA、GSH的表达量,并采用FerroOrange荧光探针检测各组细胞内Fe2+的含量。组间比较结果显示,在自噬激活剂组中,Rapa组Fe2+、MDA的含量均高于其余三组,GSH的含量则低于其余三组(P<0.05)。Rapa+Fer-1组Fe2+、MDA含量低于Rapa组,而GSH含量高于Rapa干预组(P<0.05)。Fer-1组与对照组相比,各指标的表达差异均无统计学意义(P>0.05,图5A~C),提示激活自噬可能引起结直肠癌细胞发生铁死亡。
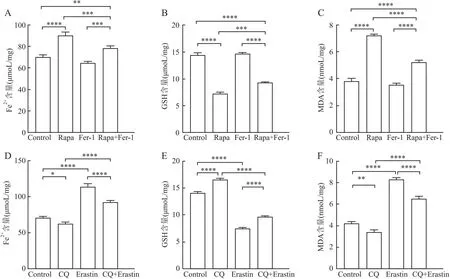
GControlRapaFer-1Rapa+Fer-1ControlCQErastinCQ+Erastin
在自噬抑制剂组中,CQ组Fe2+、MDA的含量低于其余三组,GSH含量高于其他组;Erastin组Fe2+、MDA含量高于其余三组,GSH含量则低于其他组(P<0.05);与Erastin组相比,Erastin+CQ干预组的Fe2+、MDA含量低,GSH含量高(P<0.05,图5D~G),提示下调自噬活性可能抑制结直肠癌细胞铁死亡的发生。
2.5 自噬和铁死亡干预剂联合OXA对HCT-116/OXA细胞株增殖活性的影响CCK-8实验检测自噬和铁死亡干预剂预处理后联合OXA对HCT-116/OXA细胞株增殖活性的影响。结果显示,自噬激活剂组联合应用OXA后,Rapa干预组对OXA的化学敏感性高于其余三组,细胞增殖活性明显降低;Rapa+Fer-1组对OXA的敏感性低于Rapa组,但高于Fer-1组和对照组,组间相比差异有统计学意义(P<0.05)。Fer-1组细胞活性与对照组相比,差异无统计学意义(P>0.05,表1)。

表1 CCK-8实验检测Rapa和Fer-1联合OXA干预后HCT-116/OXA细胞株的存活情况
联合应用OXA后,在自噬抑制剂组中,Erastin干预组细胞活性显著降低于其余三组,而CQ+Erastin组虽较Erastin组细胞活性升高,但细胞活性低于CQ和对照组,组间相比差异有统计学意义(P<0.05)。CQ组细胞活性与对照组相比,差异无统计学意义(P>0.05,表2)。

表2 CCK-8实验检测CQ和Erastin联合OXA干预后HCT-116/OXA细胞株的存活情况
2.6 自噬和铁死亡干预剂联合OXA对HCT-116/OXA细胞株侵袭能力的影响Transwell侵袭实验显示,联合应用OXA后,自噬激活剂组中Rapa组迁移细胞数量明显少于其余三组;而Rapa+Fer-1组迁移细胞数量较Rapa组增多,但低于其余2组,差异有统计学意义(P<0.05)。Fer-1组与对照组相比,差异无统计学意义(P>0.05,图6)。
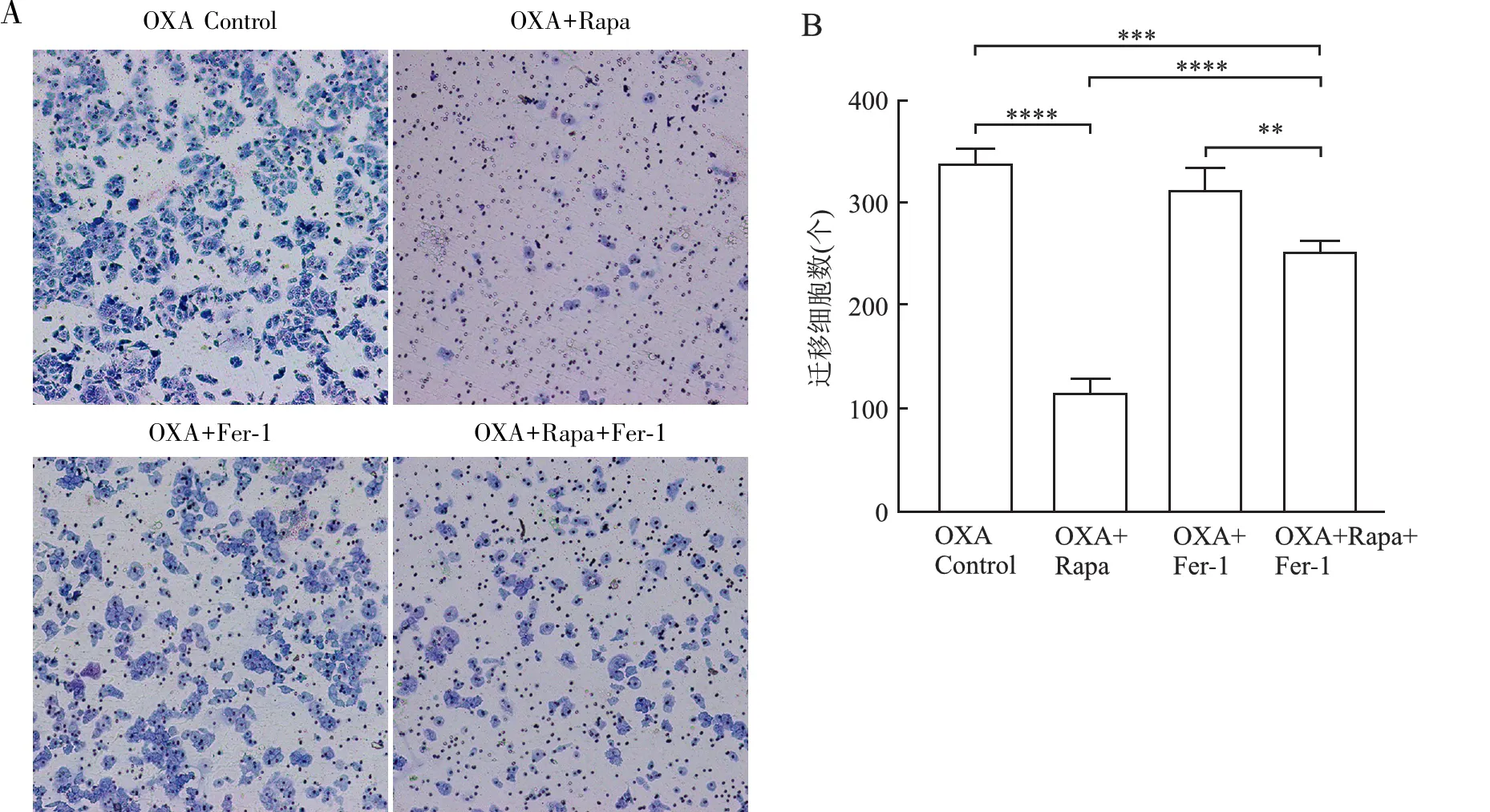
图6 Rapa和Fer-1联合OXA对HCT-116/OXA细胞侵袭能力的影响:A.Transwell细胞侵袭实验结果;B.不同干预组的迁移细胞数;∗∗P<0.01,∗∗∗P<0.001,∗∗∗∗P<0.000 1
自噬抑制剂联合应用OXA后,与对照组相比,Erastin组、CQ+Erastin组和CQ组细胞迁移数量均减少,其中Erastin组最低,CQ+Erastin组迁移细胞数量高于Erastin组、低于CQ组,各组间相比,差异均有统计学意义(P<0.05,图7)。
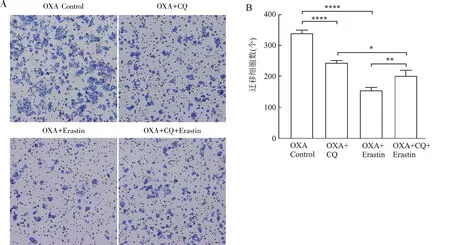
图7 CQ和Erastin联合OXA对HCT-116/OXA细胞侵袭能力的影响:A.Transwell细胞侵袭实验结果;B.不同干预组的迁移细胞数;∗P<0.05,∗∗P<0.01,∗∗∗∗P<0.000 1
2.7 自噬和铁死亡干预剂联合OXA对HCT-116/OXA细胞株克隆形成能力的影响平板克隆实验结果显示,自噬激活剂联合应用OXA后,Rapa组的细胞克隆形成数较其余三组明显减少;Rapa+Fer-1组细胞克隆形成数量较Rapa组增多,但较其余两组少,组间相比差异有统计学意义(P<0.05)。Fer-1组与对照组相比,差异无统计学意义(P>0.05,图8)。

图8 Rapa和Fer-1联合OXA对HCT-116/OXA细胞克隆形成能力的影响:A.克隆形成实验检测细胞增殖;B.不同干预组细胞克隆形成数;**P<0.01,***P<0.001,****P<0.000 1
自噬抑制剂联合应用OXA后,Erastin组、CQ+Erastin组和CQ组三组细胞克隆形成数量均低于对照组(P<0.05);其中Erastin组的细胞克隆形成数量最少,CQ+Erastin组高于Erastin组,但低于CQ组,各组间相比,差异均有统计学意义(P<0.05,图9)。
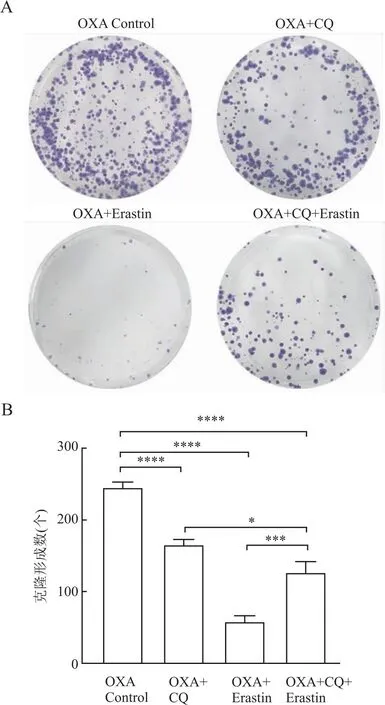
图9 CQ和Erastin联合OXA对HCT-116/OXA细胞克隆形成能力的影响:A.克隆形成实验检测细胞增殖;B.不同干预组细胞克隆形成数;*P<0.05,***P<0.001,****P<0.000 1
自噬抑制剂联合应用OXA后,Erastin组、CQ+Erastin和CQ组三组细胞克隆形成数量均低于对照组(P<0.05);其中Erastin组的细胞克隆形成数量最少,CQ+Erastin组高于Erastin组,但低于CQ组,各组间相比,差异均具有统计学意义(P<0.05,图9)。
3 讨论
肿瘤耐药是多基因、多信号通路的复杂过程,与药物摄入减少、泵出增加、DNA修复能力增强、凋亡抑制等相关[10]。OXA作为中晚期结直肠癌一线化疗药物,其主要作用机制是与细胞核内DNA交联,激活凋亡途径,导致细胞死亡[11]。此外,OXA还可以通过破坏细胞内的氧化还原稳态,导致细胞死亡[12]。但部分中晚期结直肠癌患者对OXA产生的耐药性已成为影响预后的重要因素,因此,逆转OXA耐药,更好地发挥其持久的抗癌作用,提高患者的生存率,成为临床医师和研究人员关注的热点。
铁死亡是近年来发现的一种新型细胞死亡形式,是一种铁依赖性脂质过氧化物过度累积诱导细胞死亡的方式[4]。铁死亡的发生机制复杂,主要通过内、外两种途径启动:外源性的转运蛋白依赖途径和内源性的酶调节途径。其中,以抗氧化酶GPX4为主内源性酶调节途径最为经典[13]。铁死亡发生时,过量的铁离子导致大量活性氧的产生与积累,GSH耗竭,GPX4活性下降,继而氧化膜脂质,MDA升高,促使细胞膜完整性缺失,引发铁死亡。GPX4是抗氧化体系中的关键分子,以GSH作为电子供体,使过氧化脂质转化为无毒的醇,减少对细胞损伤,从而抑制铁死亡[14]。越来越多的证据表明,GPX4的降低是铁死亡发生的关键标志。Lu等[15]研究发现,在肾透明细胞癌细胞中,抑制GPX4可激活铁死亡,抑制细胞迁移和侵袭。Deng等[16]研究发现,抑制GPX4表达可激活铁死亡,增强肺腺癌细胞对顺铂的药物敏感性。本研究结果显示,不同结直肠癌细胞中GPX4的表达不同,虽然OXA耐药细胞株中铁离子及脂质过氧化水平较高,但其GSH、GPX4表达水平显著高于亲本细胞株。作者认为该现象符合肿瘤耐药细胞的生物学特点,高水平的铁满足了癌细胞的高代谢需求[17],而GPX4的增高又恰好增加了癌细胞的抗氧化应激能力,抵抗铁死亡。因此,通过降低GPX4表达引发肿瘤细胞铁死亡,有望成为肿瘤耐药治疗的新靶点。
自噬是真核细胞内高度保守的溶酶体介导的代谢途径,主要负责清除错误折叠的蛋白质、受损的细胞器等,对于维持细胞稳态起重要作用[7]。作为重要的选择性自噬接头蛋白,p62被认为是清除泛素化蛋白的重要自噬生物学标志物,p62与泛素化的蛋白质结合并以其为靶点,通过自噬进行降解,其含量随自噬流的产生而降低[18]。Nrf2是一种碱性亮氨酸拉链转录因子,通过激活解毒酶、调控抗氧化基因和蛋白的表达来防止氧化损伤。GPX4已被确定为Nrf2的转录靶标,其表达可被Nrf2上调[19]。在正常生理情况下, Keap1与Nrf2结合并通过泛素-蛋白酶体途径快速降解。而在氧化应激状态下,Keap1介导的Nrf2降解受到抑制,Nrf2被激活并释放入核,发挥转录功能[20]。有研究发现,自噬蛋白p62可以在Nrf2和Keap1的结合部位与Keap1竞争性结合,促进Nrf2释放,激活抗氧化系统。Li等[21]研究报道,激活p62-Keap1/Nrf2通路可减轻辐射所致肺损伤中的铁死亡。然而,关于p62-Keap1/Nrf2-GPX4通路是否会影响结直肠癌铁死亡的研究报道较少。本研究显示,HCT-116/OXA细胞中铁离子和脂质过氧化水平均处于较高水平,且GSH、GPX4等抗氧化的活性同样维持在较高水平。同时,p62、Nrf2、GPX4蛋白高表达,提示HCT-116/OXA细胞的铁死亡抑制和耐药可能与p62-Keap1/Nrf2-GPX4通路处于异常激活状态有关。因此,通过影响p62-Keap1/Nrf2-GPX4通路进而促进铁死亡,有可能成为逆转结直肠癌耐药的新途径。
自噬与铁死亡关系密切,共同参与多种肿瘤的发生、发展,但目前两者的关系尚不统一。Tang等[22]研究发现,姜黄素通过激活自噬诱导非小细胞肺癌铁死亡,增强非小细胞肺癌的治疗效果。而在胶质母细胞瘤干细胞中,抑制自噬可诱导铁死亡的发生且增强细胞对替莫唑胺的敏感性[23]。然而,在结直肠癌中自噬对铁死亡的影响尚未明确。本研究分别应用自噬激活剂Rapa和自噬抑制剂CQ,观察两者对铁死亡影响的分子机制。结果显示,在结直肠癌HCT-116/OXA细胞中,应用自噬激活剂Rapa后,LC3水平升高的同时伴随p62水平降低、Keap1高表达、Nrf2低表达,GPX4表达下降,铁死亡生化指标Fe2+、MDA含量上升,GSH含量下降,细胞存活率下降。应用自噬抑制剂CQ后,结果与之相反。提示,干预自噬可通过p62-Keap1/Nrf2-GPX4通路影响铁死亡。为进一步证明自噬与铁死亡的关系,本研究同步应用了铁死亡抑制剂Fer-1和激活剂Erastin。结果显示,Rapa诱导的细胞死亡可被铁死亡抑制剂Fer-1所抑制,而CQ抑制自噬则是通过提高抗氧化酶GSH和GPX4的表达,从而抑制铁死亡激活剂Erastin诱导的细胞铁死亡。因此,本研究结果提示,自噬可通过p62-Keap1-Nrf2-GPX4影响铁死亡,进而影响细胞生存,干预此通路可能成为结直肠癌治疗的新途径。
许多研究表明,铁死亡的激活有助于多种肿瘤的治疗,在部分肿瘤中,铁死亡可以增强化疗药物的疗效。Du等[24]研究报道,双氢青蒿素可通过诱导铁死亡克服胰腺导管腺癌对顺铂的耐药性。Song等[25]研究证实,抑制GPX4可刺激细胞铁死亡,增强三阴型乳腺癌对吉非替尼的敏感性。但干预自噬调控铁死亡这一过程是否能逆转耐药肿瘤细胞对OXA的敏感性尚不清楚。本研究结果显示,应用自噬激活剂Rapa后诱导细胞发生铁死亡,同时细胞对OXA的敏感性显著升高,并且其增殖活性和迁移能力均显著下降,而联合应用铁死亡抑制剂Fer-1后OXA的作用效果显著降低。联合应用铁死亡激活剂Erastin后,细胞对OXA的敏感性升高,其增殖活性和迁移能力均显著下降。作者认为,在肿瘤细胞高铁代谢的环境中,激活自噬可诱导铁死亡的发生,进一步增强了肿瘤细胞对OXA的敏感性。
综上,本研究发现干预自噬可通过p62-Keap1/Nrf2-GPX4通路调控铁死亡,从而逆转结直肠癌对OXA耐药性。因此,深入探索自噬与铁死亡的关系,研究其在抗肿瘤治疗中的潜在作用,为逆转肿瘤耐药提供新思路。