宁夏贺兰山东麓不同子产区‘马瑟兰’干红葡萄酒颜色和酚类物质组成比较
2024-02-28王驰兰义宾段长青何非
王驰,兰义宾,段长青,何非
(中国农业大学食品科学与营养工程学院葡萄与葡萄酒研究中心,农业农村部葡萄酒加工重点实验室,北京 100083)
葡萄酒专业术语中的“风土”一词,源于法语“terroir”,是指一个特定产区或地块的互动生态系统,包括葡萄园的地理、土壤、气候和微生物环境等,广义的风土甚至包括当地的葡萄栽培和葡萄酒酿造习俗[1]。一般而言,葡萄酒的风土效应是指葡萄酒的风格与品质受葡萄园的气候因素(包括光照、温度、降水、地形地貌等因素)和土壤因素(包含土壤质地、土壤容重、pH 值、电导率等)相互作用的影响[2]。
葡萄酒中的酚类物质主要来源于酿酒葡萄果实本身,由于其特殊的理化性质,酚类物质赋予了葡萄酒颜色、涩感、苦味等感官品质[3]。按照其分子结构,可以将葡萄酒中的酚类物质分为非类黄酮类物质(C6)和类黄酮类物质(C6-C3-C6)两大类[4]。非类黄酮类物质主要包括羟基苯甲酸类和羟基肉桂酸类物质,这类物质主要来源于葡萄的果皮和果肉[5]。类黄酮类物质包括花色苷、黄酮醇和黄烷-3-醇。花色苷类物质主要来源于红葡萄果皮,主要为红葡萄酒贡献红色色调;黄酮醇为葡萄酒提供淡黄色的色调和苦味。此外,后两类物质由于其特殊的分子结构可以与花色苷产生辅色效应而稳定葡萄酒的颜色[6]。葡萄酒中的酚类物质受风土的影响。研究表明,高温会抑制‘赤霞珠’果实中花色苷的合成[7],在其他品种中也发现20 ℃时果皮中花色苷的积累明显高于30 ℃时[8],这可能是高温抑制了花色苷生物合成基因的表达水平,降低了花色苷生物合成酶活性所致。此外,光照与葡萄果实花色苷与类黄酮物质含量密切相关,光照会促进类黄酮物质的积累,而弱光则会减少花色苷与类黄酮物质含量[9]。水分胁迫会抑制与类黄酮类物质合成相关的基因表达,会增加红葡萄品种中花色苷的合成,而在白葡萄品种中会促进黄酮醇的合成[10]。
‘马瑟兰’(Vitis viniferaL.cv.,‘Marselan’)是来源于法国的一个杂交而来的酿酒葡萄品种,育成至今仅有六十余年,其亲本是‘赤霞珠’(V.viniferaL.cv.,‘Cabernet Sauvugnon’)和‘歌海娜’(V.viniferaL.cv.,‘Grenache’)[11]。中国最早于2001 年由中法庄园从法国引入‘马瑟兰’嫁接苗,由于其在栽培和酿酒方面的突出表现,已成为该酒庄的特色品种,并引种至我国许多重要的葡萄酒产区,取得了良好的效果[12]。‘马瑟兰’酿制的干红葡萄酒品质优良,酒色紫黑不透光,香气浓郁,单宁含量高,适合长期陈酿。法国朗格多克产区生产的‘马瑟兰’干红葡萄酒呈紫黑色,具有薄荷、荔枝、青椒的香气,口感柔和,平衡性好,回味悠长[13]。
宁夏贺兰山东麓产区位于宁夏回族自治区境内,地处东经105 °45′~106 °47′,北纬37 °43′~39 °23′,属中温带干旱气候区,具有适于酿酒葡萄栽培的独特气候类型和便利的灌溉条件,成为我国近年来最具有发展潜力的葡萄酒产区之一[14]。该产区独具特色的风土条件、适宜的酿酒葡萄品种以及所采用的葡萄栽培方式和葡萄酒酿造工艺等,决定了其葡萄酒的优良品质和独特风格[15]。本研究选取宁夏贺兰山东麓产区的西夏区、贺兰县、永宁县和青铜峡市四个风土小产区共21 款商品‘马瑟兰’干红葡萄酒作为研究对象,采用紫外-可见光分光光度计测定其颜色参数,采用高效液相色谱三重四极杆联运质谱(HPLC-QqQ-MS)法测定其酚类物质组成,探究葡萄酒酚类物质和颜色的产区特异性,以期为该产区不同风土条件下葡萄酒风格特征的深入研究提供一定的研究基础。
1 材料和方法
1.1 样品信息
样品选自宁夏贺兰山东麓产区旗下,西夏区、贺兰县、永宁县和青铜峡市4 个不同风土条件的小产区,共收集不同酒庄的成品‘马瑟兰’干红葡萄酒21 款,酒样信息详见表1。所有样品采集于由各酒庄自储酒库或酒窖随机选取2 瓶作为供试样品,用于理化指标(结果如附表1 所示)与酚类物质的检测分析。
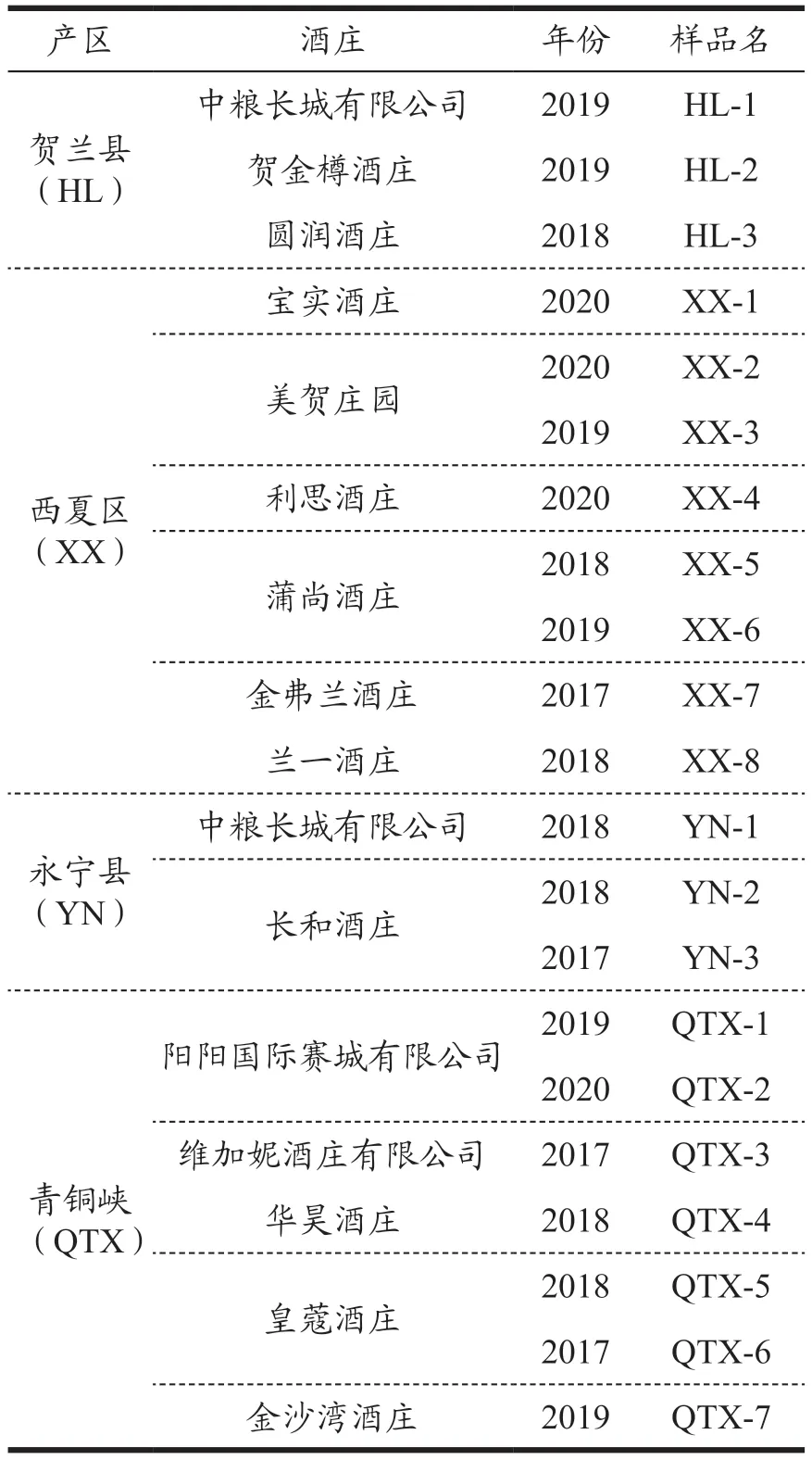
表1 酒样信息表Table 1 Wine sample information
1.2 各子产区风土条件统计
根据国家气象网的气象数据,统计了近30 年各子产区的气象数据如表2 所示。贺兰山东麓产区的土壤类型主要是冲积扇灰钙土、风沙土、灰钙土和少量的黄河灌淤土。HL 子产区位于贺兰山苏峪口北侧,为贺兰山洪积扇地貌,土壤类型为重砾石及沙石土壤,越靠近山脚,砾石越大,越多。XX子产区是最早集中发展精品酒庄的产区,靠近山脚的土壤类型为沙石土壤、砾石含量高,开发时需要大面积筛土和改良土壤。YN 子产区呈东西分布。西部靠近贺兰山脚下的区域为砾石土壤,东部为风沙土壤。QTX 子产区位于贺兰山脉的末端,土壤以灰钙土为主,矿物质丰富,微量元素含量高。土壤中含有较多的砂质,透水性好。

表2 宁夏贺兰山东麓产区4个子产区近30年气象数据统计表aTable 2 Climate survey of four sub-regions at the eastern foothills of Helan Mountain in Ningxia in recent 30 years
1.3 试剂与标准品
花色苷标准品,二甲花翠素-3-O-葡萄糖苷(Marvidin-3-O-Glucoside);非花色苷酚类物质标准品,包括(+)-儿茶素((+)-Catechin)、(-)-表儿茶素((-)-Epicatechin)、原儿茶酸(Protocatechuic Acid)、4-羟基苯甲酸(4-Hydroxybenzoic Acid)、咖啡酸(Caffeic Acid)、槲皮素(Quercetin)等均购于美国Sigama-Aidrich 公司。其它酚类物提取试剂及液相色谱流动相所用试剂,如甲醇、甲酸、乙腈等均为色谱纯级,采购于美国Fisher 公司
1.4 仪器设备
UV-2450 紫外可见光分光光度计,日本岛津公司;1200 系列高效液相色谱-6410 系列三重串联四级杆质谱联用仪、Poroshell120 EC-C18 色谱柱(150 mm×2.1 mm,2.7 μm)、安捷伦液相上样瓶,美国安捷伦科技有限公司;一次性使用无菌注射器(1 mL),上海治宇医疗器械有限公司;一次性孔径0.22 µm 聚醚砜微孔滤膜,天津津腾有限公司。
1.5 酒样理化指标测定
葡萄酒样品经8 000 r/min 离心5 min 后,取上清液测定理化指标。采用WINESCAN(FT120)快速扫描红外傅里叶变换光谱仪和FOSS Wine Scan 2.2.1 软件(Foss Electric,Hillerød,丹麦)检测酒样的酒精度、总酸、挥发酸、总糖、pH 值等理化指标,每个样品重复测定三次。
1.6 颜色的检测
采用CIELAB 颜色空间法对各样品的颜色特征进行分析,使用D65 标准光源照明和10°的视野条件。葡萄酒样品经0.22 µm 水系滤膜过滤,选择2 mm 光径的玻璃比色皿,使用440、530、600 nm波长处测定的吸光值,每个样品重复测定3 个平行,根据公式计算CIELAB 参数(亮度L*、红/绿色调a*、黄/蓝色调b*),色彩饱和度C*值的计算参考Zhang等[16,17]。模拟色卡通过CIELAB颜色参数(L*、a*和b*)使用Color Tell 颜色工具进行绘制。
1.7 酚类物质检测
酒样花色苷的检测采用美国安捷伦1200 系列高效液相色谱仪,配备6410 三重串联四级杆质谱仪(QqQ)。所用色谱柱为Poroshell 120 EC-C18 色谱柱。样品测定前经0.22 µm 水系滤膜过滤,进样量5 µL。洗脱采用的流动相为:0.1%体积比的甲酸水溶液为A相,含0.1%体积比甲酸的50/50 的甲醇乙腈溶液为B相。洗脱程序如下(%均表示体积分数),0~10 min:0% 的B 相;10~15 min:100% 的B 相;后运行程序5 min。流动相流速为0.4 mL/min。柱温箱温度控制在55 ℃。质谱采用ESI 离子源,正离子模式,喷雾电压为4 kV,离子源温度为150 ℃,干燥气温度为350 ℃,流量为12 L/h,雾化器压力为35 psi。检测器为多反应监测模式(Multiplereaction Monitor,MRM)。
酒样非花色苷酚类物质的检测除洗脱程序外均与花色苷的检测方法一致。梯度洗脱程序(%均表示体积分数)为0~28 min:10%~46% B;28~29 min:46%~10% B。洗脱结束后,维持10%B 相冲洗5 min,平衡色谱柱。流速0.4 mL/min;进样量1 µL。质谱条件同花色苷检测方法。
花色苷及非花色苷酚的定性依据为农业部葡萄酒加工重点实验室所建立的葡萄与葡萄酒酚类物质(高效液相色谱-质谱联用)指纹谱库[18]。定量采用外标法定量,各花色苷均以二甲花翠素-3-O-葡萄糖苷单体标准品的含量计算,各非花色苷酚的含量均以相应的非花色苷酚标准品的含量计算。
1.8 数据分析
每个样品测定三个平行,来自相同子产区的酒样被看作为一个组计算平均值与标准偏差。采用SPSS 软件(Chicago,IL,USA)进行方差分析(P<0.05)。采用OriginPro 9.1 软件(Microcal,Northampton,MA,USA)进行相关性图表绘制。采用Excel 2016 软件进行表格制作,采用XLSTAT 2016 进行判别分析。
2 结果与讨论
2.1 酒样颜色分析
CIELAB 是CIE 的一个颜色系统,LAB 包含三个指标,L*表示颜色的明暗;a*值表示绿红轴上颜色的饱和度,a*值越大表示颜色越红;b*值表示蓝黄轴上颜色的饱和度,b*值越大表示颜色越黄[16]。C*表示颜色的饱和度。表3 所示是各产区酒样的颜色指标,YN 的L*值和b*值最高表明相比于其他三个子产区该产区酒样颜色较亮,黄色色调偏高,QTX 的a*值和L*较高表明相比于其他子产区该产区酒样偏红。但是单因素方差分析结果表明在颜色指标上不同子产区不存在显著差异,这与颜色复现的色卡结果一致(如图1 所示),不同子产区酒样颜色与年份相关性较大,如图1 所示20 年的酒样整体颜色偏红而18 年的酒样颜色偏黄,已有研究表明瓶储时间、储藏温度也会对红酒颜色有较大影响[19],因此在不控制年份的条件下,酒样颜色可能不能作为区分不同子产区葡萄酒的依据。

图1 各子产区酒样LAB 色卡模拟图Fig.1 Mock-ups color cards of each sub-regions

表3 各产区颜色指标比较Table 3 Color Indicators of each sub-regions
2.2 花色苷和非花色苷酚类物质含量
如表4 所示,各个子产区均可以检测到11 种单体花色苷,包括5 种未酰化单体花色苷,4 种乙酰化的单体花色苷,2 种香豆酰化的单体花色苷。XX 的单体花色苷总量最高可达69.83 mg/L;HL 和QTX 其次,均在40~50 mg/L;YN 含量最低仅有19.37 mg/L,显著低于XX。在未酰化的花色苷中花翠素-3-O-葡萄糖苷,甲基花翠素-3-O-葡萄糖苷,甲基花青素-3-O-葡萄糖苷,二甲花翠素-3-O-葡萄糖苷在不同子产区存在显著差异,均表现为XX 最高,显著高于YN,而花青素-3-O-葡萄糖苷在不同子产区不存在显著差异;在乙酰化和香豆酰化的花色苷中,均表现为XX 显著高于YN。

表4 各子产区酒样单体花色苷含量(mg/L)Table 4 Monomeric anthocyanin content of each sub-region (mg/L)
研究表明成熟早期高温会抑制花色苷合成相关基因的表达[20],光照可以影响葡萄花色苷合成过程中的光诱导酶的活性,弱光会使得花色苷合成减少,而强光会促进花色苷的积累[21]。此外,单体花色苷含量与陈酿时间密切相关,在新酒中含量最高,总量可达200 mg/L 以上,随着陈酿和瓶储的进行单体花色苷会与多种分子反应形成花色苷衍生物导致花色苷含量下降,陈酿24 个月后花色苷会下降至50 mg/L 或者更低的水平[22]。本研究中XX 的多种花色苷含量显著高于YN,结合表2可知,虽然XX 的年有效积温与光照时长均低于YN,但XX 有更多2020 年酒样,因此花色苷的差异可能是年份效应与风土效应共同作用的结果。为验证年份效应是否掩盖了风土带来的影响,单独选取酒样较全的2018 年对酒样的单体花色苷组分进行统计分析,结果如附表2 所示。在所有检测到的单体花色苷中,YN 显著低于XX,HL 与QTX 的个别花色苷含量也显著低于XX,这与前文的结论一致,风土效应贡献了子产区间花色苷含量的差异。
如表5 所示,在各子产区共检测到非花色苷酚类物质21 种,其中包括黄酮醇9 种,黄烷醇6种,羟基苯甲酸4 种,羟基肉桂酸2 种。在总量上XX 含量最高可达406.63 mg/L,显著高于YN的233.36 mg/L,这与单体花色苷的表现一致。在黄酮醇中,QTX 的杨梅酮含量最高为6.98 mg/L 显著高于YN 的2.37 mg/L,其他8 种黄酮醇在不同子产区之间不存在显著差异。原花青素B 是含量最丰富的黄烷醇类物质,表现为XX 含量最高为135.82 mg/L,显著高于YN 的61.71 mg/L,(-)-表儿茶素和(-)-表棓儿茶素也表现出相同的趋势,(+)-棓儿茶素,(+)-儿茶素,原儿茶酸在各子产区之间没有显著差异。在羟基苯甲酸类物质中,HL 的龙胆酸含量最高为2.44 mg/L,显著高于XX 的1.50 mg/L 和YN 的1.31 mg/L,其他三种物质在不同子产区间不存在显著差异。3-羟基肉桂酸在不同子产区之间差异较大,XX 含量最高为46.37 mg/L,显著高于QTX和YN,HL 的41.63 mg/L 显著高于YN。

表5 各子产区酒样非花色苷酚类含量(mg/L)Table 5 Non-anthocyanin phenols content of wine samples of each sub-regions (mg/L)
黄酮醇是葡萄酒中一类重要的酚类化合物,它来源于葡萄果皮,是植物为对抗紫外线过度照射而产生的次生代谢产物[23]。黄酮醇的合成受光照影响较大,在遮光的果实中几乎没有黄酮醇合成[24],适度的水分胁迫也会促进果实中黄酮醇的积累[25]。此外,黄酮醇是葡萄酒中较为稳定的物质,在陈酿和瓶储过程中变化不明显。QTX 的黄酮醇含量较高与其总日照较长有关。黄烷醇类物质是葡萄酒中最重要的成分之一,为葡萄酒提供苦味和收敛性的感官特征。尤其在干红葡萄酒中,黄烷醇物质支撑起了酒的“骨架感”[26]。研究表明,绿果期高温会使黄烷醇合成相关基因上调,但转色期的高温则会抑制这个作用[27]。水分胁迫也会促进黄烷醇的合成[28]。此外,在葡萄酒中黄烷醇可以在含有醛基的物质介导下发生聚合反应[29,30]。YN 的黄烷醇含量较低可能是风土效应与年份效应共同作用的结果。羟基苯甲酸是具有C6-C1骨架的物质,主要以游离态的形式存在于葡萄酒中。葡萄酒中的羟基苯甲酸类物质不仅来源于葡萄果实,在陈酿过程中橡木多酚的浸入也是重要的来源[31]。葡萄酒中羟基肉桂酸含量与葡萄的品种、产区、栽培和酿造时采取的工艺有关。随着葡萄酒储存和陈酿,酒石酸酯化的羟基肉桂酸逐渐被水解,释放出更多游离的羟基肉桂酸[4]。贺兰县的羟基苯甲酸和羟基肉桂酸含量最高,可能是环境因素有关或由其酒庄所采取的生产工艺有关。
为验证年份效应影响,单独选取酒样较全的2018 年对酒样的非花色苷酚类组分进行统计分析,结果如附表3 所示。在黄酮醇中,杨梅酮、二氢山奈酚、槲皮素等在QTX 与HL 的含量均高于其他子产区,与其日照时长较长有关;在黄烷醇中原花色素B、(-)-表儿茶素和(-)-表棓儿茶素XX 均显著高于YN,(+)-棓儿茶素、原儿茶酸表现与前文一致;HL 的龙胆酸含量高于其他三个子产区但差异不具显著性;3-羟基肉桂酸表现与前文一致。因此,除少数物质外年份效应对大部分非花色苷酚类物质含量影响不及风土效应,研究所得结论基本可靠。
2.3 酚类物质判别分析
为了研究特征性酚类物质对不同风土子产区‘马瑟兰’干红葡萄酒产区分化的贡献,将各酚类物质的含量进行归一化作为自变量,以子产区作为分类依据,根据类等式原理和Wilks λ 统计最小值,进行逐步判别分析。依次分析了每种酚类物质对模型识别能力的贡献,并消除了贡献不显著的自变量。将检测到的32 种酚类物质输入,消除了10 种贡献不显著的变量,最终筛选出22 种特征酚类物质。根据所选物质,得到3 个典型判别函数,特征值分别为53.49、44.49、2.02,分别可以解释模型方差的53.49%、44.49%、2.02%。其中,前两个典型判别函数可以解释97.98%的方差变化,包括不同产区酚类物质成分的主要信息,可以表明不同子产区酚类物质之间的差异和关系。将不同子产区‘马瑟兰’干红葡萄酒酚类物质的值代入这两个典型判别函数,并绘制为散点图。如图2 所示,典型判别函数很好地将不同子产区的‘马瑟兰’干红葡萄酒划分在不同的象限,这表明进入方程的22 种酚类物质可以作为区分不同子产区‘马瑟兰’干红葡萄酒的特征物质。
2.4 酚类物质与颜色相关性分析
为了探究葡萄酒颜色和酚类物质含量的联系,利用检测到的颜色参数和所有酚类物质含量构建Pearson 相关系数模型,结果如图3 所示。葡萄酒的L*值和b*值和甲基花翠素类、二甲花翠素类、花色苷总量、黄酮醇和黄烷醇的含量呈显著负相关。相反的是,a*值和C*与花色苷总量、二甲花翠素类、黄酮醇和黄烷醇的含量呈显著正相关。羟基苯甲酸和羟基肉桂酸含量则与颜色参数没有显著的相关性。此外,花色苷总量与黄烷醇和羟基苯甲酸含量也有显著正相关。研究表明,花色苷类物质是葡萄酒颜色的主要来源,黄酮醇和黄烷醇类物质因其独特的分子结构,在葡萄酒中可作为辅色素通过辅色作用维持葡萄酒颜色的稳定[6]。通常来说,红葡萄酒颜色与其中花色苷的组成和含量有着密切的关系,也与其花色苷辅色效应的强弱密切相关[32]。花色苷B 环取代基的类型和数量会影响其呈色,一般来说,取代基的增多能够使得花色苷的最大吸收波长向长波方向移动,增加蓝紫色调,并且相比于羟基,甲氧基的存在能够产生更大的红移效应有研究表明[33]。蓝紫色调的增加在CIELAB 中表现为a*值增大而b*值减小,与本研究中分析结果一致。

图3 LAB 与酚类物质相关性分析图Fig.3 LAB and phenolics correlation analysis graph
宁夏贺兰山东麓不同小产区的‘马瑟兰’干红葡萄酒在颜色上不存在显著性差异,而在酚类物质含量上存在显著性差异,通过相关性分析颜色和花色苷以及类黄酮物质间存在显著相关性。在酚类物质和葡萄酒颜色存在着更加复杂的关系,不同酚类物质对颜色的贡献度不同[6,34]。总花色苷含量在不同子产区存在显著差异,西夏区显著高于永宁县,可能是永宁县多年陈酿酒样偏多的原因,而在颜色上这两个产区不存在显著差异,这可能是某些差异不显著的物质对葡萄酒颜色有更大的贡献度,也可能是不同酚类物质对颜色的贡献存在相互作用[35],这些相互作用掩盖了物质含量的差异。随着葡萄酒的陈酿,酒样的a*值和L*值会缓慢下降,而b*值呈逐渐上升的状态[23]。在本研究中,永宁县的b*值较高,但在颜色上的差异并没有显著性,可以在控制年份条件的情况下进一步开展实验来探究产区风土对葡萄酒颜色的直接影响。
3 结论
本研究以宁夏贺兰山东麓产区贺兰县、西夏区、永宁县和青铜峡市4个风土小产区的成品‘马瑟兰’干红葡萄酒为实验材料,测定其颜色参数以及花色苷以及非花色苷酚类物质的组成与含量。结果表明,永宁县酒样的L*值和b*值最高,该产区酒样颜色较亮,黄色色调偏高,青铜峡市酒样的a*值最高,但不同子产区在颜色上不存在显著性差异,酒样颜色似乎与年份间有更显著的关系。在花色苷总量上,西夏区最高而永宁县最低;花青素-3-O-葡萄糖苷在不同子产区没有显著差异,其余花色苷均表现出和总量相同的趋势。贺兰县和青铜峡市的杨梅酮显著高于永宁县;西夏区的葡萄酒中原花青素B,(-)-表儿茶素,(-)-表棓儿茶素显著高于永宁县;贺兰县的龙胆酸含量显著高于西夏区和永宁县;3-羟基肉桂酸含量在不同子产区之间差异较大,西夏区显著高于青铜峡和永宁县,贺兰县显著高于永宁县;基于单一年份的验证结果与上述结论大致相同。基于酚类物质含量进行逐一判别分析可以将不同子产区的酒样显著分开。相关性分析结果显示,葡萄酒的花色苷,黄酮醇,黄烷醇与葡萄酒的L*值和b*值呈显著负相关,与a*值和C*值呈显著正相关,而羟基苯甲酸和羟基肉桂酸与颜色没有显著相关性。宁夏贺兰山东麓各子产区‘马瑟兰’干红葡萄酒在颜色上差异不显著,在酚类物质组成上具有显著的风土特异性。
附表:

附表1 各子产区酒样理化指标表Sup-table 1 Basic physicochemical indicators of wine samples by each sub-region

附表2 各子产区2018年酒样单体花色苷含量 (mg/L)Sup-table 2 Monomeric anthocyanin content of each sub-region in 2018 (mg/L)

附表3 各子产区2018年酒样非花色苷酚类含量 (mg/L)Sup-table 3 Non-anthocyanin phenols content of wine samples of each sub-regions in 2018 (mg/L)
