25G+与27G+玻璃体切割术治疗特发性视网膜前膜疗效比较
2024-02-27马君锴马萧萧马艺丹苏绍波曹梓轩马高恩
马君锴,张 庆,马萧萧,马艺丹,苏绍波,闫 琼,曹梓轩,马高恩
(新乡医学院第三附属医院眼科,河南 新乡 453003)
随着微创眼底手术的不断发展,23G+、25G+玻璃体切割术(pars plana vitrectomy,PPV)已被广泛应用于治疗各种玻璃体视网膜疾病;然而,由于其自身设计的局限性,可导致患者术后穿刺口渗漏相关并发症,如眼球萎缩、脉络膜脱离、术后低眼压等。为了减少这些并发症,近来研发切口更小的27G+2PPV。27G+PPV在2010年首次由OSHIMA报道[1]。有多项研究报道,玻璃体积血与玻璃体浑浊患者应用27G+PPV治疗后,视力恢复良好,且未观察到明显的术中及远期手术并发症[2-4]。但是,由于27G+PPV的玻切头管道口径缩小可能会对手术效率和安全性产生负面影响,初期仅使用27G+PPV处理一些简单的玻璃体视网膜疾病。伴随27G+PPV与眼内观察系统、眼内照明技术及超高速切割系统的整合应用,其已经逐渐被应用于治疗复杂的眼底疾病,如特发性视网膜前膜、增生性糖尿病视网膜病变、复杂性视网膜脱离等[5]。本研究主要比较25G+PPV与27G+PPV治疗特发性视网膜前膜的疗效和安全性,以期为临床特发性视网膜前膜治疗的选择提供依据。
1 资料与方法
1.1 一般资料
选择2019年12月至2022年8月新乡医学院第三附属医院收治的特发性视网膜前膜患者50例(50眼)为研究对象,其中男18例,女32例;年龄56~78岁。病例纳入标准:(1)符合特发性视网膜前膜诊断标准[6];(2)单眼发病;(3)视力显著下降并伴不同程度的视物扭曲或复视;(4)光学相干断层扫描(optical coherence tomography,OCT)检测显示黄斑区水肿或明显渗漏。排除标准:(1)由糖尿病、高血压等基础性疾病所引发的视网膜前膜;(2)既往有视网膜血管病及外伤史;(3)既往有玻璃体视网膜手术史;(4)有玻璃体视网膜疾病家族史;(5)患有其他系统疾病无法进行PPV。根据手术方式不同将患者分为对照组与观察组, 每组25例25眼。对照组:男10例,女15例;年龄56~76(62.62±10.35)岁,术前早期治疗糖尿病视网膜病变研究组 (early treatment of diabetic retinopathy study,ETDRS) 视力表视力5~71(43.60±22.85)字母数,眼压10~21(15.76±2.24)mm Hg(1 mm Hg=0.133 kPa),黄斑中心凹厚度(central macular thickness,CMT)307~553(423.20±70.09)μm。 观察组:男8例,女17例;年龄60~78(63.51±11.52)岁,术前ETDRS视力5~61(34.60±22.76)字母数,眼压12~19(15.64±2.03)mm Hg,CMT 319~544(435.20±56.03)μm。2组患者的性别、年龄、术前ETDRS视力、眼压、CMT比较差异无统计学意义(P>0.05),具有可比性。本研究符合人体试验伦理学标准,并得到医院医学伦理委员会审核批准,患者和(或)家属知情同意并签署知情同意书。
1.2 手术方法
对照组患者接受25G+PPV:患者全身麻醉后消毒铺巾,用开睑器开启术眼,0.25 g·L-1聚维酮碘溶液冲洗结膜囊,停留10 s后用生理盐水冲洗;然后,使用带套管的 25G+穿刺针头分别于颞上、鼻上、颞下角膜缘后3.5 mm处经结膜行20°~30°巩膜穿刺,穿刺针头进入巩膜后垂直于眼球表面穿刺进入玻璃体内,分别放置光导纤维、玻璃体切割头、灌注头,于3:00、9:00位角膜缘处缝制固定环;放置小斜镜,切割前部及中央部玻璃体;换用高斜镜,顶压巩膜切割周边玻璃体,用0.1 mL吲哚菁绿(5 g·L-1)染色视网膜前膜10 s,剥除视网膜前膜至血管弓范围;手指检测眼压在正常范围,撤除管道系统;检查术眼是否存在光感,然后用棉签轻压3个穿刺口并检查穿刺口密闭情况,按压一定时间穿刺口后,观察切口如仍存在渗漏,则行8-0可吸收缝线缝合穿刺口。
观察组患者接受27G+PPV:患者全身麻醉后消毒铺巾,开睑器开启术眼,0.25 g·L-1聚维酮碘溶液冲洗结膜囊,停留10 s后用生理盐水冲洗;使用27G+PPV操作系统及相关配套手术器械进行手术,操作同对照组。
为控制采集数值误差,50例患者手术均由同一高年资医师操作,手术助手与护理均固定人员。
1.3 观察指标
(1)玻璃体内手术时间:记录2组患者玻璃体内手术时间;(2)结膜下出血及水肿范围:记录2组患者术后1 d手术切口结膜下出血及水肿范围;(3)CMT:分别于术前及术后1 d、1周、1个月、3个月,应用OCT检查2组患者的CMT(内界膜到色素上皮层之间距离);(4)ETDRS视力:分别于术前及术后1 d、1周、1个月、3个月,按照ETDRS视力表标准检查流程测2组患者的视力;(5)眼压:分别于术前及术后1 d、1周、1个月、3个月,应用Callon型非接触眼压计测2组患者眼压,将眼压≤9 mm Hg定义为低眼压,眼压≥22 mm Hg定义为高眼压;(6)并发症:观察2组患者术中黄斑损伤、视网膜裂孔及术后脉络膜脱离、视网膜出血、视网膜脱离、眼内感染等并发症发生情况。
1.4 统计学处理

2 结果
2.1 2组患者玻璃体内手术时间比较
对照组和观察组患者的玻璃体内手术时间分别为(26.32±4.39)、(23.48±4.28)min;观察组患者的玻璃体内手术时间显著短于对照组,差异有统计学意义(t=2.314,P<0.05)。
2.2 2组患者切口结膜下出血及水肿范围比较
术后1 d,对照组和观察组患者结膜下出血及水肿范围分别为(8.08±1.44)、(2.76±1.30)mm;观察组患者结膜下出血及水肿范围显著小于对照组,差异有统计学意义(t=13.706,P<0.01) 。
2.3 2组患者ETDRS视力比较
对照组和观察组患者术后1 d 、1周、1个月和3个月的ETDRS视力显著高于术前,差异有统计学意义(P<0.05)。术后1 d、1周、1个月和3个月,2组患者的ETDRS 视力比较差异无统计学意义(P>0.05)。结果见表1。
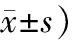
表1 2组患者ETDRS视力比较Tab.1 Comparison of ETDRS vision of patients between the two groups (字母数,
2.4 2组患者术后眼压比较
术后1 d,观察组患者的眼压高于对照组,差异有统计学意义(P<0.05)。术后1周、1个月和3个月,对照组与观察组患者的眼压比较差异无统计学意义(P>0.05)。结果见表2。对照组患者术后1 d出现一过性低眼压2例,观察组均未出现一过性低眼压。

表2 2组患者术后眼压比较
2.5 2组患者CMT比较
术前2组患者均有视网膜神经上皮层牵拉伴不同程度视网膜水肿增厚及血管扭曲;术后1 d,2组患者视网膜前膜均解除牵拉,视网膜黄斑区解剖结构较术前有大幅改善;结果见图1。术后1 d、1周、1个月、3个月,2组患者的CMT均显著小于术前,差异有统计学意义(P<0.05);术后1 d、1周、1个月、3个月,2组患者的CMT比较差异无统计学意义(P>0.05) 。结果见表3。

图1 2组患者术前、术后1 d黄斑区解剖结构Fig.1 Anatomical structure of the macular area of patients in the two groups before and 1 day after surgery

表3 2组患者CMT比较Tab.3 Comparison of CMT of patients between the two groups
2.6 2组患者术中、术后并发症比较
对照组患者18眼(72.0%)因穿刺口渗漏而缝合巩膜穿刺口;观察组患者均未行穿刺口缝合。2组患者均顺利完成手术,术中未出现黄斑损伤、视网膜裂孔等并发症。随访3个月,2组患者均未发现脉络膜脱离、视网膜出血、视网膜脱离、眼内感染等术后并发症。
3 讨论
自1971年MACHEMER首次报道17G+PPV至今,微创玻璃体切割术在眼科领域已发展50余年[7]。随着科学技术的进步,人们不断研发出新的PPV系统。27G+PPV在器械设计方面做出较大改动,相较于 25G+PPV,27G+切割手柄切口端更为膨大且向顶端移动,这更有利于靠近视网膜时的精密操作。在器械设计方面,27G+PPV液体流量单位时间内小于 25G+PPV,这使 27G+PPV在切割和分离过程中对周围临近的组织扰动更小,减少了对视网膜等组织的牵拉和造成医源性裂孔的可能性,增加了临近视网膜操作的安全性和稳定性[8]。为更好地应对日益精细化的手术要求,管道更小的27G+PPV成为眼底疾病患者更好的选择。
手术时间是术后视觉恢复与手术安全性的重要关联因素。王睿等[9]、王蕾等[10]研究发现,PPV手术时间可能会影响手术后患者视力的恢复与角膜内皮细胞数量。本研究结果显示,观察组患者的玻璃体内手术时间显著短于对照组。分析其原因为:(1)25G+PPV虽然在设定切割功率上胜于27G+PPV,但25G+切割手柄切口端在贴近视网膜操作时却存在缺乏精细化分离增生膜与正常组织的问题,术者为了确保手术的安全,被迫降低负压,放慢切割功率,因此,增加了手术时间。(2)27G+切割手柄既能保证在视网膜与增生膜间进行切割操作的连贯性,也能替代笛针和眼内镊等剥膜器械的使用,减少了手术器械反复更换所需要的时间和手术操作不连贯所导致的切口损伤。有研究发现,27G+PPV在切割过程中对周边受到液流扰动的视网膜组织干扰更小,操作更加高效安全,缩短了手术时间[10-12],这一结论与本研究结果一致。但是,CHARLES等[13]、NARUSE等[14]研究发现,27G+PPV所需玻璃体切割时间长于 23G+PPV和 25G+PPV。推测这种差异发生的原因可能是:(1)不同研究所统计的样本量存在差异。(2)术者操作习惯与熟练程度不同。

PPV术后患者眼压情况是反映手术安全性的重要指标。本研究结果显示,观察组患者术后1 d的眼压显著高于对照组;术后1周、1个月和3个月,2组患者的眼压比较差异无统计学意义;对照组2例患者术后1 d出现一过性低眼压,观察组患者均未出现一过性低眼压。出现这种情况的原因可能为:25G+PPV术后渗漏导致相较于27G+PPV更低的眼内压,而在术后1周后穿刺口损伤部位以瘢痕方式修复,使眼球内液体渗漏终止而恢复正常眼压。MITSUI等[11]也在报道中提到,巩膜穿刺口越小,撤出管道系统后切口闭合越快,术后眼压越稳定,这与本研究结果相符合。ITO等[18]研究发现,更小的管道系统使患者拥有更稳定的眼压,切口渗漏相关并发症较少。NARUSE等[19]研究发现,27G+PPV术后低眼压发生率低于25G+PPV。SHINKAI 等[20]研究报道,对患者行内眼手术后立即测量眼压,27G+组管道系统的眼压波动幅度明显小于25G+组。以上研究结果表明,27G+PPV在术后眼压稳定性方面优于25G+PPV。

随着 25G+与 27G+PPV的广泛应用,与穿刺切口相关的并发症被报道的次数逐渐升高,如眼内组织损伤、脉络膜脱离、眼内炎等[24]。但是,李杰等[25]研究报道,应用 25G+与 27G+PPV治疗玻璃体视网膜疾病,术后均未观察到感染性眼内炎、脉络膜脱离等严重并发症。本研究结果显示,2组患者均未出现视网膜出血、脉络膜脱离、眼内炎等手术并发症。以上研究表明,25G+PPV与 27G+PPV治疗特发性视网膜前膜均具有良好的手术安全性。
4 结论
25G+PPV和27G+PPV治疗特发性视网膜前膜均安全有效。与25G+PPV相比,27G+PPV手术时间更短,术后眼压更稳定,且术后结膜下出血及水肿更轻,可提高患者的舒适性和满意度。
