雷帕霉素对慢性肾衰竭大鼠主动脉平滑肌细胞钙化及自噬的影响
2024-02-22郑金花韦泽丰王自强
郑金花 韦泽丰 王自强
(海南医学院第一附属医院血液净化中心,海南 海口 570100)
慢性肾衰竭(CRF)患者常伴有血管弹性功能低下,极易导致心血管疾病。血管钙化是CRF患者发生心血管事件的高危因素〔1〕。自噬作为细胞的一种保护性机制,主要通过细胞降解并再利用多余大分子或无功能细胞器,为机体其他生命活动提供原料和能量,可有效抑制血管钙化〔2〕。自噬相关分子机制及信号通路较复杂,其中哺乳动物雷帕霉素靶蛋白(mTOR)是诸多通路与分子机制作用的交汇点,是自噬的负性调控因子〔3,4〕。雷帕霉素可通过抑制mTOR通路的 mTOR 复合物(mTORC)1来诱导自噬〔5〕。以往研究报道〔6,7〕,雷帕霉素可促进肾小球足细胞、神经细胞等多种细胞的自噬活动。然而鲜有研究报道雷帕霉素是否可抑制肾脏平滑肌细胞(VSMC)钙化及其分子机制。本研究通过雷帕霉素抑制剂干预钙化的大鼠肾脏VSMC,探讨雷帕霉素抑制剂对CRF VSMC钙化的影响机制。
1 材料与方法
1.1实验动物 健康SPF级,10~12周龄,雄性,Wistar 大鼠,体质量(200±20)g,购自海口奇力制药有限公司,动物的使用许可证号:SYXK(琼)2017-0014。大鼠饲养在无特定病原体(SPF)级动物实验室〔使用许可证号:SYXK(琼)2017-0014〕,饲养室湿度(50±10)%、温度(25±2)℃、12 h循环光照、通风良好。正常饲养1 w,第2周开始实验。本研究中大鼠相关实验获得医院动物管理伦理委员会批准(批准号:IACUC-20180217-61)。
1.2药品与主要试剂 腺嘌呤(BR沃凯,购自国药集团化学试剂有限公司),Western印迹试剂盒(美国BD公司),全蛋白抽提试剂盒(德国QIAGEN公司),戊巴比妥钠(Sigma公司,美国),茜素红染料〔购自北京索莱宝科技有限公司,规格:25 g/瓶,用Tris-HCl将其配制成0.1%茜素红-Tris-HCl(pH8.3)溶液〕。
1.3动物模型建立及分组 按照参考文献〔8〕的方法构建模型,取33只雄性昆明大鼠自由饮用2%葡聚糖硫酸钠(DSS)水溶液共7 d,再普通饮水14 d。随机选取3只大鼠取肾脏组织进行病理学检查,按照米海燕等〔9〕的方法证实模型构建成功,将剩余30只大鼠随机分为模型组、CRF+I组和CRF+I+3-甲基腺嘌呤(MA)组,每组10只。模型组、CRF+I组和CRF+I+3-MA组实验第1~4周给予腺嘌呤混悬液及含1.8%高磷饲料每日1次喂养,第5~8周腺嘌呤改为隔日灌胃。CRF+I组同时给予雷帕霉素〔西罗莫司口服液,C51H79NO13,0.4 mg/(kg·d),杭州中美华东药业有限公司,浙江杭州〕灌胃治疗,1次/d。CRF+I+3-MA组给予相同剂量的雷帕霉素和5 mmol/L的3-MA灌胃,剂量2 ml,另取10只大鼠自造模第1天开始始终给予生理盐水灌胃作为对照组。共给药8 w。实验结束2 d后小鼠断颈处死。取出肾脏组织,生理盐水冲洗后一半存储于-80 ℃冰箱备用,另一半放于4%多聚甲醛溶液固定。
1.4血生化检测 大鼠称重后,以2%戊巴比妥钠麻醉固定于操作台,剖开腹腔,使用负压采血针从腹主动脉采血,离心,吸取上清液置于Ep管,保存于-20 ℃冰箱。用于后续生化指标检测。
1.5苏木素-伊红(HE)染色检测大鼠肾脏组织形态:看组织病理变化 肾脏组织在多聚甲醛中浸泡,经脱水、石蜡包埋、切片(厚度约4 μm)、脱蜡,HE染色、二甲苯充分浸泡2 h直至透明、干燥。常规封片,光学显微镜下观察组织形态。
1.6茜素红染色及细胞钙沉积量检测 每组随机选取5只大鼠,剥离胸主动脉,包埋、切片、脱蜡、石蜡切片、水洗;加入1%茜素红-Tris-HCl(pH8.3)液染色;水洗;常规脱水透明,封片。显微镜下观察钙化结节。
1.7免疫组化检测大鼠主动脉上α-平滑肌肌动蛋白(SMA)和runt相关转录因子(Runx)2蛋白表达 按照免疫组化试剂盒操作说明书,将主动脉组织石蜡切片脱蜡水化,修复抗原,先后予以3%H2O2灭活内源性过氧化物酶10 min、10%山羊血清封闭15 min,各加入大鼠抗α-SMA和兔抗Runx2单抗,经4 ℃冰箱过夜后,加入生物素标记二抗,清洁后二氨基联苯胺(DAB)显色,镜检。采用Image-Pro Plus6.0分析,各切片随机选取视野,测定阳性部位(棕黄色颗粒)的吸光度值。
1.8透射电镜观察VSMC内自噬体的数量 分别收集各组样本,将各组细胞培养72 h,弃掉培养基,加入电镜固定液,收集细胞,更换固定液,固定2 h。透射电镜下观察自噬体。
1.9免疫荧光检测微管相关蛋白轻链(LC)3蛋白表达 各组细胞培养72 h后,磷酸盐缓冲液清洗3次,固定20 min。磷酸盐缓冲液洗3次,破膜5 min。山羊血清封闭2 h,LC3抗体(1∶200倍稀释)在4 ℃孵育过夜,后续操作均避光,二脒基苯基吲哚(DAPI)室温染核5 min,DAPI蓝色荧光曝光100 ms、拍照,200倍荧光显微镜下拍摄。
1.10Western印迹检测大鼠肾脏组织激活腺苷酸活化蛋白激酶(AMPK)/mTOR信号通路蛋白及自噬相关蛋白表达 分别收集各组样本,提取组织匀浆总蛋白,测定蛋白含量。制备蛋白样品并进行凝胶电泳,转至聚偏氟乙烯(PVDF)膜,封闭液封闭2 h。加入一抗4 ℃封闭过夜。次日加入二抗,室温孵育1 h,加入显色液显影。
1.11统计学分析 采用SPSS19.0软件进行t检验,作图工具采用Graphpad5.01。
2 结 果
2.1雷帕霉素对大鼠24 h尿蛋白定量(Upro)的影响 与对照组相比,模型组中24 h Upro明显升高(P<0.05);与模型组相比,CRF+I组中24 h Upro明显降低(P<0.05);与CRF+I组相比,CRF+I+3-MA组中24 h Upro显著升高(P<0.05),见表1。
2.2雷帕霉素对大鼠尿液和血液相关生化指标的影响 与对照组相比,模型组中尿素氮(BUN)和肌酐(Scr)、血磷(P)显著升高,血钙(Ca)显著下降(P<0.05);与模型组相比,CRF+I组中BUN和Scr、血P显著降低,血Ca显著升高(P<0.05);与CRF+I组相比,CRF+I+3-MA组中BUN和Scr、血P显著升高,血Ca显著下降(P<0.05),见表1。
2.3雷帕霉素对α-SMA、Runx2蛋白表达水平的影响 对照组主动脉平滑肌层大量表达α-SMA,胞质呈棕黄色;与对照组相比,模型组α-SMA表达显著降低(P<0.05);与模型组相比,CRF+I组α-SMA表达明显升高(P<0.05),CRF+I+3-MA组无明显变化;且CRF+I+3-MA组α-SMA明显低于CRF+I组(P<0.05)。此外,对照组主动脉壁上Runx2微量表达;与对照组相比,模型组Runx2表达明显升高(P<0.05);与模型组相比,CRF+I组中Runx2表达显著降低(P<0.05),CRF+I+3-MA组Runx2蛋白表达显著升高(P<0.01);且CRF+I+3-MA组主动脉上Runx2表达明显高于CRF+I组(P<0.05),见表1、图1。
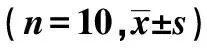
表1 雷帕霉素抑制剂对大鼠24 h Upro、BUN、Scr、血P、α-SMA、Runx2蛋白表达水平的影响
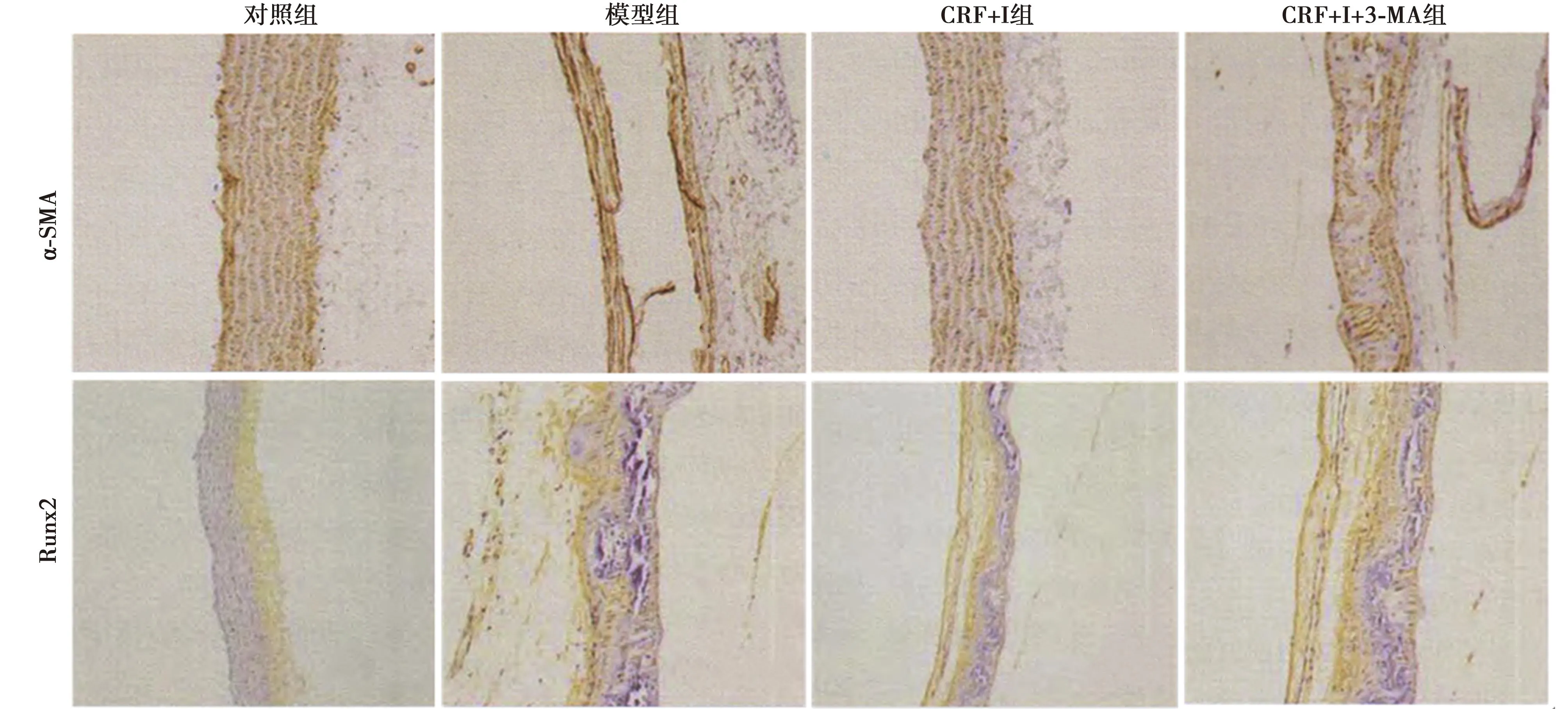
图1 各组主动脉上α-SMA和Runx2蛋白表达(免疫组化,×400)
2.4雷帕霉素对大鼠肾组织形态的影响 除对照组外,其他各组肾脏均可见明显病变,主要表现为肾小管上皮细胞胞质空亮、空泡变性、增生伴扩张,有脱落和管腔内蛋白小滴,皮质浅层肾小管扩张。与对照组相比,模型组上述病变发生率明显升高;与模型组相比,CRF+I组上述病变发生率明显降低;与CRF+I组相比,CRF+I+3-MA组上述病变发生率明显升高,见图2。

图2 各组肾组织形态(HE染色,×400)
2.5茜素红染色观察主动脉壁钙化情况 茜素红染色显示,对照组主动脉壁未见深红色。模型组主动脉壁中膜层出现呈线性连续的钙化结节,呈深红色,弹性纤维断裂。用雷帕霉素预处理后,CRF+I组钙化结节减少。加入3-MA抑制自噬后,CRF+I+3-MA组钙化结节又显著增加,见图3。
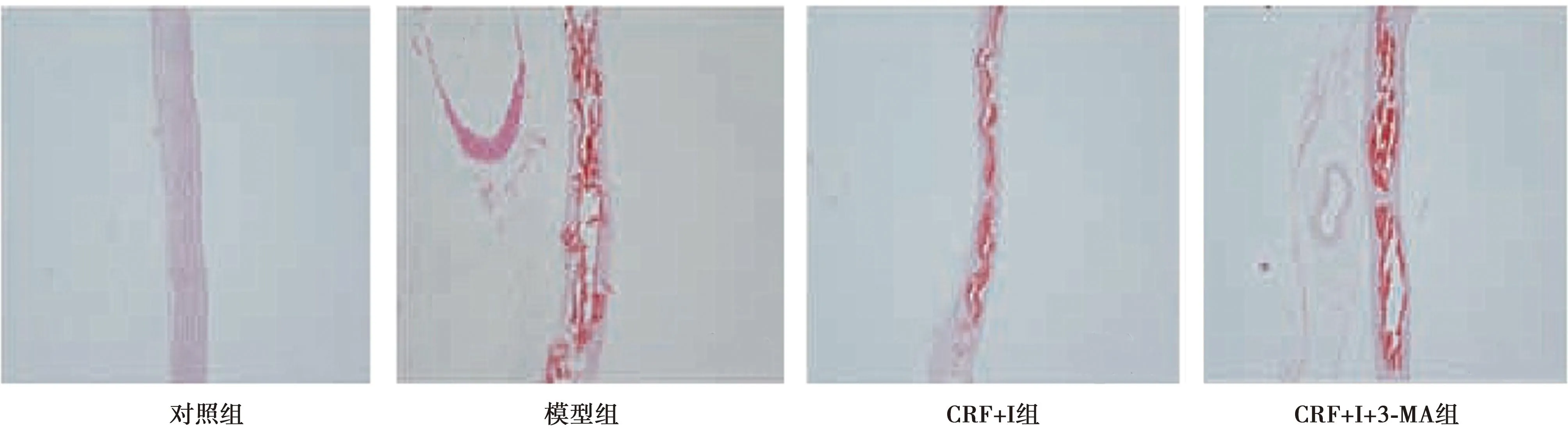
图3 各组主动脉壁钙化情况(茜素红染色,×100)
2.6雷帕霉素通过抑制AMPK/mTOR信号通路激活自噬减轻VSMC钙化 透射电镜观察各组中VSMC内自噬体数量,对照组中有少量自噬体;与对照组相比,模型组有大量自噬体形成;与模型组相比,CRF+I组VSMC内自噬体数量明显增加;与CRF+I组相比,CRF+I+3-MA组VSMC内自噬体数量明显减少。说明雷帕霉素可以激活VSMC的自噬活动。见图4。与对照组相比,模型组LC3Ⅱ/Ⅰ及自噬相关蛋白(Beclin)1蛋白表达明显升高(P<0.01);但给予雷帕霉素预处理后,LC3Ⅱ/Ⅰ及Beclin1蛋白表达明显升高(P<0.01);给予3-MA预处理后,LC3Ⅱ/Ⅰ及Beclin1蛋白表达明显降低(P<0.05)。见表2、图5。免疫荧光染色也显示,与对照组相比,模型组细胞质内LC3点状聚集增多;与模型组相比,CRF+I组LC3点状聚集明显增加;与CRF+I组相比,CRF+I+3-MA组LC3点状聚集也明显减少。见图6。

红色箭头表示自噬体图4 透射电镜观察各组VSMC内自噬体数量(×20 000)
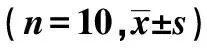
表2 雷帕霉素对LC3、Beclin1表达的影响
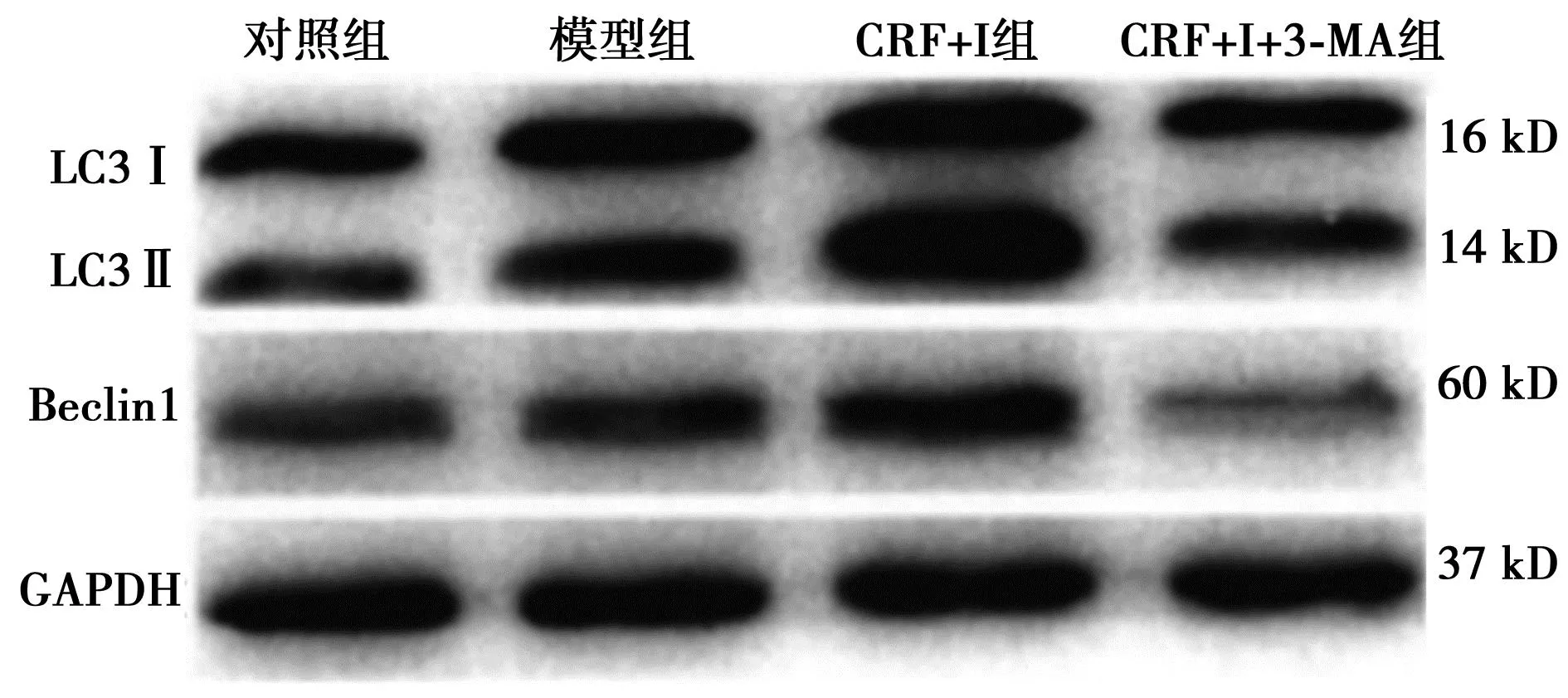
图5 各组LC3Ⅰ、LC3Ⅱ、Beclin1蛋白表达
2.7Western印迹检测p-mTOR蛋白表达 4组p-mTOR蛋白表达差异有统计学意义(F=5.602,P=0.028)。与对照组(1.08±0.21)相比,模型组p-mTOR表达显著升高(1.61±0.35,P<0.01);与模型组相比,CRF+I组p-mTOR表达显著降低(0.50±0.11,P<0.01);与CRF+I组相比,CRF+I+3-MA组p-mTOR蛋白表达显著升高(0.92±0.18,P<0.05),见图7。

图6 免疫荧光检测LC3蛋白表达(×200)

图7 各组p-mTOR蛋白表达水平
3 讨 论
许多研究发现〔8,9〕,mTOR信号通路在成骨分化中起着重要的调控作用。雷帕霉素抑制剂对CRF具有一定的防治作用〔10〕,但其作用机制研究还很少。本研究证明,雷帕霉素抑制剂对CRF大鼠有较好的治疗效果。VSMC的病理变化是构成CRF血管钙化的主要原因。有研究证实〔11〕,自噬在血管及VSMC的病理生理过程中发挥关键作用。验证自噬的主要方法有Western印迹结果检测LC3Ⅱ/LC3Ⅰ、Beclin1蛋白表达、荧光显微镜下观察LC3点状聚集及电镜下观察自噬体的形成〔12,13〕。有研究证实,阿托伐他汀通过下调β-连环蛋白(catenin)来诱导VSMC自噬,进而抑制VSMC钙化〔14〕。研究显示,自噬可通过减少VSMC基质囊泡的释放而减缓VSMC钙化〔15,16〕。沈凤等〔17〕研究发现血小板源性生长因子(PDGF)可通过诱导VSMC自噬而降低钙调蛋白和α-SMA蛋白表达,上调波形蛋白和骨桥蛋白的表达,从而增强细胞钙化。本研究使用雷帕霉素治疗CRF大鼠发现,雷帕霉素会促进肾脏VSMC自噬,从而抑制VSMC钙化,进而发挥对CRF的治疗作用。
mTOR处于许多细胞信号通路的关键位置,在细胞生长、分化及调控自噬过程中起着重要作用〔18〕。有研究发现,敲除小鼠软骨中的mTOR 相关基因,自噬信号明显增加,降低细胞凋亡〔19〕。有研究报道〔20〕,雷帕霉素通过上调自噬相关因子的表达,从而促进软骨细胞生存。杨羽菲等〔21〕在探讨治疗性低温(TH)在缺氧期对心肌细胞自噬活性及自噬流的影响机制研究中,使用雷帕霉素作用于TH作用的缺氧期H9c2细胞,发现细胞自噬活性激活,且逆转了TH对p-mTOR和p-S6的促表达作用。雷帕霉素对自噬的调控机制在其他器官研究较多,但是雷帕霉素抑制剂对肾脏VSMC钙化的影响机制还鲜有研究。雷帕霉素可通过激活自噬改善足细胞损伤,这可能与雷帕霉素抑制mTOR/4EBP1/P70S6K信号通路有关〔22〕。刘磊〔23〕研究肾脏足细胞结构与功能改变在糖尿病肾病(DN)发病过程中的作用机制,证实雷帕霉素可通过mTOR-S6K1-LC3Ⅱ通路调控DN大鼠肾脏足细胞自噬。本研究提示,雷帕霉素抑制剂可通过抑制p-mTOR的生物学活性,减弱其对下游蛋白的作用,进而激活VSMC的自噬机制,减轻VSMC的钙化。
综上,雷帕霉素抑制剂对大鼠CRF起到一定疗效,其机制可能与雷帕霉素抑制剂对AMPK/mTOR信号通路的调控,从而促进自噬,减弱VSMC钙化有关。
