高温胁迫对小黄鱼肝脏组织结构和细胞凋亡的影响
2024-02-05张天乐魏福亮
何 雨,刘 峰,张天乐,楼 宝,魏福亮,叶 挺
(1.湖州师范学院 生命科学学院,浙江 湖州 313002; 2.浙江省农业科学院 水生生物研究所,农产品质量安全危害因子与风险防控国家重点实验室,浙江 杭州 310021; 3.中国计量大学 生命科学学院,浙江 杭州 310018)
小黄鱼(Larimichthyspolyactis)又名小鲜、黄花鱼等,隶属于鲈形目(Perciformes)石首鱼科(Sciaenidae)黄鱼属(Larimichthys),广泛分布于渤海、黄海、东海以及朝鲜半岛西岸地区,昼夜栖息于近底层,与大黄鱼(Larimichthyscrocea)、带鱼(Trichiurusjaponicas)、曼氏无针乌贼(Sepiellamaindron)并称为我国传统“四大海产”[1]。继大黄鱼之后,小黄鱼于2020年成功实现了规模化人工养殖[2],逐渐成为新兴的重要海水养殖种类,具有极高的经济价值和发展前景。目前,对小黄鱼的研究已从多方面展开,在人工繁育技术[3]、生物学特征[4]、形态性状分析[5]、种质资源挖掘[6]等方面均有部分研究报道。随着小黄鱼养殖业的不断发展,水体环境对小黄鱼养殖的影响逐渐成为热点问题。鱼类为变温动物,缺乏自身体温调节机制,其体温可随水温而变化[7]。所以,水温是鱼类生长发育过程中重要的环境因子,当水温发生变化时,会直接影响鱼体内活性氧含量及抗氧化酶的活性,使机体的自由基代谢发生紊乱,继而使鱼体产生胁迫反应以响应环境的改变[8]。鱼体对胁迫有一定的耐受性,当遭受轻度或短期性的胁迫时,随着刺激的减弱,机体可以较快地恢复至正常,但过度或长时间的胁迫则会导致内脏组织及机体丧失应对能力,内部生理平衡状态被打破,鱼体表现出免疫机能降低及炎症反应等病理状态,更甚者则会导致死亡[7]。研究显示,高温易导致鱼体产生高温应激反应[9]。小黄鱼属于广温性鱼类,已有研究表明其高温致死温度为32 ℃[10],夏季高温时期我国近海养殖区水温偶有达到该温度,对小黄鱼的养殖存在巨大威胁。因此,探明高温胁迫对小黄鱼的影响作用,对于增强小黄鱼在高温条件下抗应激能力、提高高温条件下养殖成活率实现健康养殖具有非常重要的实际意义。
高温胁迫是影响鱼类生理状态的关键非生物因素之一[11],对鱼类有诸多不利影响,如降低代谢活性[12]、导致鱼体肝脏受损[13]、诱导细胞凋亡[14]等。鱼类肝脏具有解毒、免疫防御和激素合成等作用,是与应激反应密切相关的重要代谢器官[15]。高温胁迫导致肝脏损伤的研究在白梭吻鲈(Sanderlucioperca)[16]、虹鳟(Oncorhynchusmykiss)[13]、团头鲂(Megalobramaamblycephala)[17]等许多鱼类中均有报道。此外,多项研究显示,高温胁迫造成鱼体细胞凋亡,如陆健等[18]研究发现,高温胁迫会使大口黑鲈(Micropterussalmoides)幼鱼发生细胞凋亡甚至细胞坏死,郭晓丽等[19]和Jia等[20]研究分别指出高温胁迫造成大菱鲆(Scophthalmusmaximus)心脏细胞和肝细胞凋亡。组织形态学变化是生化和生理损伤的综合表现,因此,它是应激反应的极佳生物标志[21]。通过观察鱼类肝脏的组织形态学变化情况,可以判断出机体是否适应当前环境[22]。细胞凋亡是受细胞外微环境和细胞内基因调控的一种细胞主动自杀性死亡方式。胁迫对细胞凋亡有调控作用,可通过多途径激活细胞凋亡程序[23]。高温对小黄鱼的影响研究已有部分报道,主要包括高温对肝脏氧化应激指标[10]、基因差异表达[24]的影响,而对于小黄鱼肝脏组织形态以及细胞凋亡的影响还未见报道。
鉴于此,本次研究拟采用石蜡切片、显微观察及超微观察技术研究高温胁迫处理条件下小黄鱼肝脏的显微与超微结构形态变化,通过TUNEL法检测高温胁迫条件下小黄鱼肝脏组织的细胞凋亡情况,深入了解高温胁迫对小黄鱼肝脏组织的影响作用,从而进一步认识高温对小黄鱼的影响,为小黄鱼的健康养殖管理提供理论依据。
1 材料与方法
1.1 试验材料
从浙江省农业科学院宁波象山基地海区网箱养殖的小黄鱼中选取健壮个体共200尾,体长(16.90±1.37)cm、体重(45.20±12.42)g,置于2.5 m3的圆形养殖桶中暂养14 d。暂养期间水温(15.0±0.3)℃,24 h不间断增氧,保证溶氧5.5 mg·L-1以上。其间每天定时(7:00和17:00)投喂天邦膨化饲料(饲料粒径3 mm),投喂后30 min左右虹吸法排水2/3,清理桶底残渣粪便,并添加黑暗沉淀后过滤海水以保持养殖水体洁净。
1.2 试验方法
1.2.1 小黄鱼高温胁迫试验
暂养结束后,选取体表无损伤、规格整齐的小黄鱼放入6个0.5 m3容积的蓝色塑料桶中,每桶25尾。实验鱼分为2组,每组3个平行。其中一组为急性高温处理组,通过功率为1 000 W的加热棒(圣盾)将水温从(15.0±0.3)℃以2 ℃·h-1的恒定速率升高到(31.0±0.2)℃,并维持此温度。对照组保持自然水温养殖不做处理,实验持续时间为96 h,实验期间持续充氧,根据实验鱼摄食情况进行饱食投喂。
1.2.2 取样
在实验组水温达到31℃的0、6、12、24、48、72、96 h,实验组和对照组随机各取9尾,每个平行3尾,丁香酚麻醉后解剖鱼体,取肝脏组织。每份样品剪取一部分保存于4%多聚甲醛溶液中,用于石蜡切片苏木精-伊红(HE)染色实验,剩余样品保存于电镜固定液中,用于电镜切片。
1.2.3 石蜡切片观察
肝脏组织石蜡切片制备参照王云锋[22]的实验方法,概述如下:取经4%多聚甲醛溶液固定24 h以上的小黄鱼肝脏组织,将其放入乙醇中脱水,再放入二甲苯中透明,然后将其包埋于石蜡中,将石蜡切片成4 μm的厚度,再对其进行常规的脱蜡,并使用HE染色,然后使用中性树胶封片,最后使用光学显微镜(徕卡DM4B)观察并拍照。
1.2.4 透射电镜观察
肝脏组织电镜切片制备参照周阳等[25]的实验方法,概述如下:取经电镜固定液保存的小黄鱼肝脏组织,切成约1mm3小块后置于质量分数为2.5%戊二醛溶液中,4 ℃下固定2 d,经0.1 mol·L-1磷酸缓冲液PBS(pH值7.4)漂洗3次(每次15 min)后,置于质量分数为1%锇酸溶液避光室温固定2 h,经0.1 mol·L-1磷酸缓冲液PBS(pH值7.4)漂洗3次(每次15min)后,酒精梯度(30%-50%-70%-80%-95%-100%-100%)脱水(每次15 min),100%丙酮2次(每次20 min),用812包埋剂渗透并包埋,包埋板放于60 ℃烤箱聚合48 h后取出树脂块,利用徕卡Leica UC7型切片机进行超薄切片,经2%醋酸铀及2.6%枸橼酸铅染色后于日立HT7800/HT7700型透射电子显微镜下观察并拍照。
1.2.5 细胞凋亡检测
TUNEL法检测肝脏细胞凋亡,步骤如下:取经4%多聚甲醛溶液固定24 h以上的小黄鱼肝脏组织,依次放入乙醇中脱水、二甲苯中透明,然后将其包埋于石蜡中,将石蜡切片成4 μm的厚度,再对其进行常规的脱蜡,并使用中性树胶封片,然后按照说明使用TUNEL 细胞凋亡检测试剂盒(Servicebio G1501)进一步处理切片。最终获得的切片置于光学显微镜(徕卡DM4B)下观察并拍照。
2 结果与分析
2.1 高温胁迫对小黄鱼肝脏显微结构的影响
HE染色结果显示,对照组小黄鱼的肝组织细胞形状较规则,具有球形并带有核仁的细胞核,而且细胞核基本都处在细胞的中间,各细胞结构保持正常形态,其中肝细胞之间分布少量的空泡(图1-A)。经31 ℃高温处理0 h的实验组肝脏组织未出现组织结构变化,即还未呈现明显的肝损伤(图1-B);随着高温处理时间的延长,肝脏表现出不同程度、不同形式的损伤:高温条件持续6 h后,肝脏出现了肝淤血病理学变化(图1-C);12 h后,肝脏出现了细胞核移到肝细胞外围、空泡变性和轻微水肿等病理学变化(图1-D);24 h后,肝脏组织出现血窦扩张、空泡相对增多和细胞核位于肝细胞的一侧等病理学变化(图1-E);48 h后,肝脏组织出现空泡增多、肝淤血和水肿等病理学变化(图1-F);72 h后,肝脏出现了严重的淤血、水肿以及细胞核移到肝细胞外围等病理学变化,在细胞间和细胞质中可见到大量的血球颗粒(图1-G);在高温持续96 h后,小黄鱼肝脏出现了更为严重的病理学变化,包括肝脏出现水肿、细胞核消失甚至溶解和肝组织局部坏死,肝细胞原有结构破坏等一系列肝损伤表征(图1-H)。
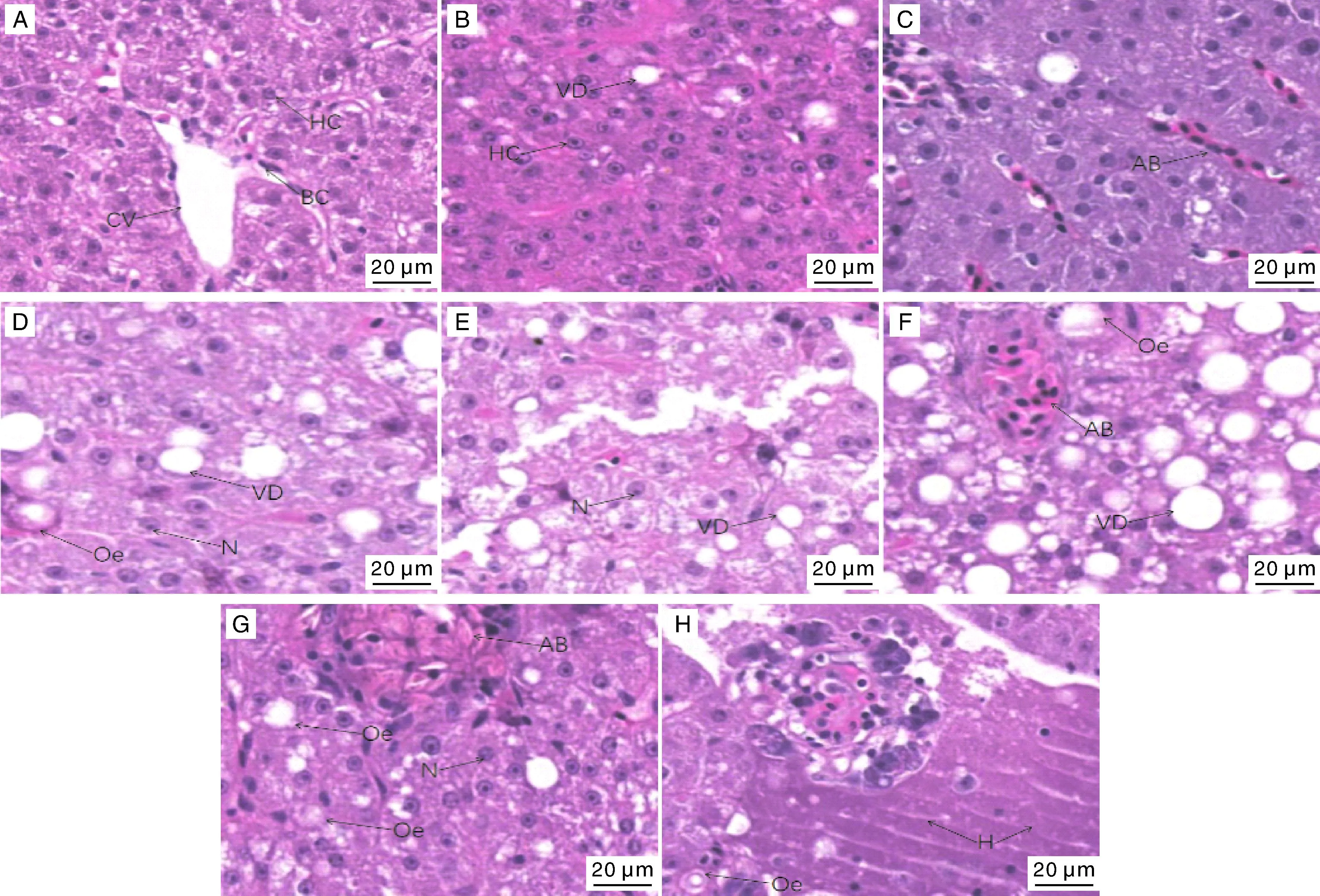
A,对照;B,高温处理0 h;C,高温处理6 h;D,高温处理12 h;E,高温处理24 h;F,高温处理48 h;G,高温处理72 h;H,高温处理96 h。CV,中央静脉;HC,肝细胞;BC,血细胞;VD,空泡;AB,淤血;N,细胞核;Oe,水肿;H,结构破坏。A, Control; B, 0 h high temperature stress; C, 6 h high temperature stress; D, 12 h high temperature stress; E, 24 h high temperature stress; F, 48 h high temperature stress; G, 72 h high temperature stress; H, 96 h high temperature stress. CV, Central veins; HC, Hepatocyte; BC, Blood corpuscle; VD, Vacuolation; AB, Gore; N, Nucleus; Oe, Oedema; H, Structural damage.图1 高温胁迫后小黄鱼肝脏显微结构变化(H.E 染色,400×)Fig.1 Histology of Larimichthys polyactis liver after high temperature stress (H.E, 400×)
2.2 高温胁迫对小黄鱼肝脏超微结构的影响
使用透射电子显微镜观察高温处理条件下各个取样时间点的小黄鱼肝组织超微结构变化,结果如图2所示。从图中可以看出,对照组小黄鱼的肝脏细胞核呈卵圆形,核内核质均匀,细胞中罕见溶酶体,偶见脂滴,内质网和线粒体清晰可见;内质网以粗面内质网为主,层次整齐地排列在细胞核以及线粒体周围;线粒体丰富,结构清晰,双膜完整,肝细胞具有发达的嵴和基质(图2-A)。高温处理0 h实验组的肝脏组织形态没有出现明显变化(图2-B);高温持续6 h后,肝脏组织细胞核总体呈圆形(图2-C);12 h后,大小脂滴充斥肝细胞内(图2-D);24 h后,肝脏细胞核萎缩且核膜变形弯曲不光滑(图2-E);48 h后,细胞内初级溶酶体和次级溶酶体增多,多聚集在细胞膜附近,且细胞内出现了大量脂褐质(图2-F);高温持续处理72 h后,大小脂滴充斥肝细胞内,其中一些甚至比细胞核大,挤压细胞核及其他细胞器,细胞内粗面内质网和滑面内质网数量均减少(图2-G);96 h后,细胞内粗面内质网和滑面内质网数量均急剧减少,同时,线粒体数量减少,线粒体双膜结构被破坏,部分线粒体由于肿胀出现基质斑块化(图2-H)。
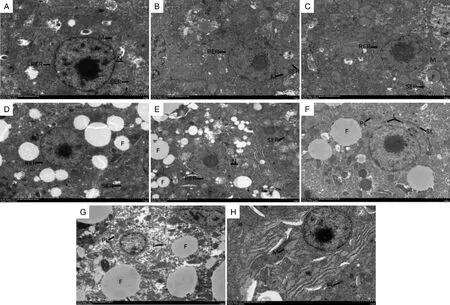
A,对照;B,高温处理0 h;C,高温处理6 h;D,高温处理12 h;E,高温处理24 h;F,高温处理48 h;G,高温处理72 h;H, 高温处理96 h。RER,粗面内质网;M,线粒体;F,脂滴;SER,滑面内质网;L,脂褐质;PL,初级溶酶体;SL,次级溶酶体。A, Control; B, 0 h high temperature stress; C, 6 h high temperature stress; D, 12 h high temperature stress; E, 24 h high temperature stress; F, 48 h high temperature stress; G, 72 h high temperature stress; H, 96 h high temperature stress. RER, Rough endoplasmic reticulum; M, Mitochondrion; F, Lipid droplet; SER, Smooth endoplasmic reticulum; L,Lipofuscin; PL,Primary lysosome; SL, Secondary lysosome.图2 高温胁迫后小黄鱼肝脏超微结构变化(4 000×)Fig.2 Ultrastructure of Larimichthys polyactis liver under high temperature stress(4 000×)
2.3 高温胁迫对小黄鱼肝脏细胞凋亡的影响
脱氧核糖核苷酸末端转移酶介导的缺口末端标记法[terminal dexynucleotidyl transferase (TdT)-mediated dUTP nick end labeling, TUNEL]是研究生物体组织细胞凋亡情况的最广泛使用的技术[26]。本研究通过TUNEL法检测高温胁迫下小黄鱼肝脏细胞的凋亡情况,检测结果如图3所示。对照组小黄鱼肝脏细胞核基本正常(图3-A);与对照组相比,随着高温胁迫时间的持续,高温胁迫导致肝脏细胞凋亡现象逐渐加重(图3-B-H),说明高温胁迫时间的延长导致肝损伤程度逐渐加重,其中一个鲜明特征即为肝脏细胞凋亡率逐渐增加。
3 讨论
3.1 小黄鱼胁迫温度的选择
小黄鱼属于广温性鱼类,研究表明,一定范围的水温升高,对小黄鱼的生长发育具有促进作用[27]。但是报道指出,当水温按照1 ℃·d-1的速率缓慢上升至32 ℃持续养殖2 d后开始出现个体死亡,一周内累计死亡率达16.67%,同时存活个体的抗氧化酶活性明显降低,表现出严重的应激损伤[10]。同时,急性高温胁迫处理小黄鱼的研究[24]表明,水体温度按照2 ℃·h-1的速率快速上升至32 ℃时,维持此温度24 h后,实验鱼全部死亡。为了进一步研究高温胁迫对小黄鱼肝脏组织的损伤作用,本次研究设定高温胁迫处理水温为31 ℃。
3.2 高温胁迫对小黄鱼肝脏组织及细胞结构的影响
肝脏是鱼体内最大的消化器官,也是储存糖原的主要部位。肝脏具有重要的生理功能,例如新陈代谢、排泄和解毒功能,其在生物体内的状态可以很好地反映出机体的生理和病理状态[13]。已有研究表明,各种环境压力都可能导致肝脏组织结构发生变化,甚至影响其功能。如饲料中的外源组胺可能导致黄颡鱼(Tachysurusfulvidraco)肝脏出血和炎症细胞浸润[14];亚硝酸盐暴露可能导致鳙(Hypophthalmichthysnobilis)的肝脏细胞核肥大和窦性扩张[15];持续高温胁迫可能导致虹鳟肝脏脂肪变性、水泡变性、肝细胞坏死[16]。在本研究中,对照组小黄鱼的肝组织细胞形状较规则,具有球形并带有核仁的细胞核,而且细胞核基本都处在细胞的中间,各细胞结构保持正常形态,但是,肝细胞之间分布少量的空泡,可能是肝糖原和脂肪被溶解所致,肝细胞内的物质合成速率与释放速率的不平衡,导致组织学观察空泡[22]。随着高温胁迫时间的延长,实验组小黄鱼肝细胞的肝糖原和脂肪被溶解加剧以提供大量消耗的能量,故表现为空泡增多[17]。本研究中,持续高温胁迫后细胞核位于肝细胞的一侧,研究结果与草鱼(Ctenopharyngodonidellus)肝组织病变症状[18]相似,这些现象显示小黄鱼肝脏的组织学变化随着高温胁迫的持续,呈现出逐渐恶化的趋势,说明长时间的高温胁迫将会给小黄鱼肝脏带来严重损害,诱发肝脏疾病。
由于肝脏是排毒的主要器官,它极易受到损害,因此肝脏的变化可作为既往环境胁迫源暴露的标志物[28-29]。大量资料显示,高温胁迫导致鱼体肝脏组织损伤[16,30-31],表现为较多肝细胞均出现空泡化、细胞间界限杂乱模糊、细胞核萎缩,严重的甚至出现溶解。祝璟琳等[32]研究还指出,高温胁迫使病原菌感染对尼罗罗非鱼(Oreochromisniloticus)肝脏损伤更为迅速,感染后期受损更严重。在本研究中,透射电镜图像显示小黄鱼肝脏细胞内线粒体数量减少、线粒体双膜结构被破坏、部分线粒体由于肿胀出现基质斑块化,该现象与刘波[23]报道的高温胁迫对团头鲂肝脏超微结构的影响相一致。此外,随着高温胁迫时间的延长,小黄鱼肝细胞细胞核萎缩,严重的甚至出现溶解,该现象与大口黑鲈报道结果相一致[29]。持续高温胁迫后大小脂滴充斥小黄鱼肝细胞内,其中一些甚至比细胞核大,挤压细胞核及其他细胞器,这一结果在团头鲂的研究报道中已有类似报道[33]。所以,长时期的高温胁迫将对小黄鱼肝脏细胞内细胞核、线粒体等各个细胞器均造成严重损害。
3.3 高温胁迫对小黄鱼肝脏细胞凋亡的影响
正常的细胞凋亡是生物体的一种生理机制,在维持机体内环境稳定方面起着非常重要的作用,但是严重的细胞凋亡会对鱼类产生负面影响[34]。已有研究指出,多种胁迫源均能触发鱼体的细胞凋亡,如急性高温胁迫可以诱导河豚(Takifuguobscurus)血细胞凋亡[35];持续高温胁迫引起虹鳟肝脏细胞凋亡[36];高温和低温胁迫均会诱导青鳉(Oryziaslatipes)鳃组织发生凋亡[37];喹乙醇可引起鲤鱼(Cyprinuscarpio)肝细胞凋亡[38];高浓度铜胁迫将诱导斑马鱼(Daniorerio)鳃细胞凋亡[24]。本研究基于TUNEL法检测31℃高温胁迫对小黄鱼肝脏细胞凋亡的影响,发现高温胁迫会导致小黄鱼肝脏细胞的凋亡,且随着高温胁迫时间的持续凋亡现象明显加重,该现象与王云锋[22]对白梭吻鲈的研究结果相一致。研究结果进一步证实了高温胁迫将导致包括小黄鱼在内的多种鱼类的肝脏细胞的非正常凋亡,出现严重的肝损伤。
