基于SRAP分子标记的华顶杜鹃遗传多样性
2024-02-05汤紫依田盛野何海叶潘伟伟王军峰鲍洪华张慧娟
吴 倩,汤紫依,田盛野,何海叶,潘伟伟,王军峰,鲍洪华,张慧娟,蒋 明,*
(1.台州学院 生命科学学院,浙江 台州 318000; 2.华东药用植物园科研管理中心,浙江 丽水 323000; 3.台州市生态环境保护局路桥分局,浙江 台州 318050)
杜鹃花属(Rhododendron)是杜鹃花科(Ericaceae)最大的一个属,约有1 200多个物种,主要分布于大洋洲、美洲、欧洲和亚洲,在北极也有分布,但种类很少,仅2种,分别为杜鹃亚属(Subgen.Rhododendron)的高山杜鹃(R.lapponicum)和云间杜鹃亚属(Subgen.Therorhodion)的堪察加杜鹃(R.camtschaticum)[1-2]。我国有720余种野生杜鹃花属植物,主要集中在华南和西南地区;浙江的杜鹃花属物种数量相对较少,仅19种,如羊踯躅(R.molle)、云锦杜鹃(R.fortunei)、马银花(R.ovatum)和华顶杜鹃(R.huadingense)等[3-4]。华顶杜鹃是丁炳扬等[5]于1990年在浙江省天台县天台山华顶发现的新物种,它生于海拔700~1 200 m的针阔叶混交林中,株高1~4 m,树皮呈斑块状纵裂。华顶杜鹃的花期较长,开花时无叶,花色艳丽,花瓣上有橙红色的斑点;新叶绿中带红,色泽鲜明,具有较好的观赏价值(图1)。华顶杜鹃的植株十分稀少,分布区域十分狭窄,该物种已被列入国家Ⅱ级和浙江省重点保护野生植物名录。近年来的研究发现,华顶杜鹃种间关系松散,整体关联性差,种群存在着不同程度的衰退现象,该物种亟需保护[6-7]。

A,花;B,新生枝条。A, Flowers; B, Newborn branches.图1 华顶杜鹃Fig.1 Rhododendron huadingense
遗传多样性是指一个物种居群间、居群个体间遗传差异的总和,体现物种对环境的适应能力,通常多样性越高,适应能力越强[8]。分子标记是以DNA多态性为基础的遗传标记方法,与形态学标记、细胞学标记和生化标记相比,分子标记不受外界环境因素的影响,具有稳定性好、重复性高的优点。分子标记是研究遗传多样性的重要工具,已广泛应用于基因图谱构建、种质资源鉴定和遗传多样性评价等[9]。相关序列扩增多态性(sequence-related amplified polymorphism, SRAP)是一种基于PCR的新型分子标记技术,以复性变温法为核心,利用特定引物扩增开放阅读框(open reading frame, ORF)。相比简单序列重复区间(inter-simple sequence repeat, ISSR)、随机扩增DNA多态性(random amplified polymorphic DNA, RAPD)、简单重复序列(simple sequence repeat, SSR)等分子标记,SRAP具有共显性高、重复性好、操作简便等优点,被广泛应用于种质资源鉴定评价、基因定位克隆、遗传多样性分析等方面的研究[10-11]。近年来,华顶杜鹃相关研究主要集中在群落结构、种子萌发与育苗等方面,在分子层面的研究较少,未见采用SRAP分析华顶杜鹃遗传多样性的报道。本研究利用SRAP分子标记,对不同居群华顶杜鹃的遗传多样性进行分析,为开展该珍稀植物的保护和合理利用提供理论依据。
1 材料与方法
1.1 样品采集
叶片样品采自华顶杜鹃的5个居群,分别为天岗尖(TGJ)、道场矶(DCJ)、池澡(CZ)、括苍山(KCS)和天台山(TTS),经纬度和海拔等信息如表1所示。采集华顶杜鹃不同植株的叶片,共50份样品,装入自封袋后带回实验室。叶片先用大量的自来水冲洗,再用无菌水冲洗多次,以去除表面的异物。叶片晾干后保存在-80 ℃冰箱,用于基因组DNA的提取。

表1 不同居群华顶杜鹃的地理信息
1.2 基因组DNA的提取
取2 g叶片,置于无菌研钵中,加入液氮后用研棒迅速磨成粉末。粉末转移至1.5 mL离心管中,采用十二烷基磺酸钠法(SDS法)提取华顶杜鹃叶片基因组DNA。取5 μL用于电泳检测,剩余DNA溶液分装后放入-20 ℃冰箱保存备用。
1.3 SRAP-PCR扩增
PCR反应体系:2 μL 10× PCR缓冲液、0.5 μL dNTPs(10 mmol·L-1)、上/下游引物(20 μmol·L-1)各0.45 μL、DNA模板0.7 μL(30 ng·μL-1)、0.9 μLTaq酶(2 U·μL-1)和ddH2O 15 μL。利用这一体系,从140对引物中筛选重复性好、多态性高的组合,用于SRAP-PCR扩增。SRAP-PCR扩增程序设置为:94 ℃ 5 min;随后进入首个循环,包括94 ℃变性1 min,37 ℃退火1 min,72 ℃延伸1 min,共5次;94 ℃预变性1 min然后进入下一个循环,该循环包括94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,共35次;循环结束后,72 ℃最后延伸10 min。用1%琼脂糖凝胶电泳,电泳结束后拍照记录。
1.4 数据统计
分别以“0”与“1”表示条带的缺失和存在,用Excel构建0/1矩阵。将SRAP-PCR的统计结果导入Popgene32软件,计算居群水平和物种水平的遗传参数。利用软件NTSYS 2.10进行UPGMA聚类分析;用OriginPro软件进行主成分分析。
2 结果与分析
2.1 SRAP引物的筛选
总共筛选到8个引物组合,分别是ME 2/em 6、ME 3/em 6、ME 3/em 14、ME 4/em 11、ME 4/em 14、ME 4/em 17、ME 5/em 4、ME 8/em 1(表2)。利用这些引物扩增得到的条带清晰度高、稳定性好、多态性丰富,可用于后续的读带和统计分析(图2)。

表2 SRAP引物组合
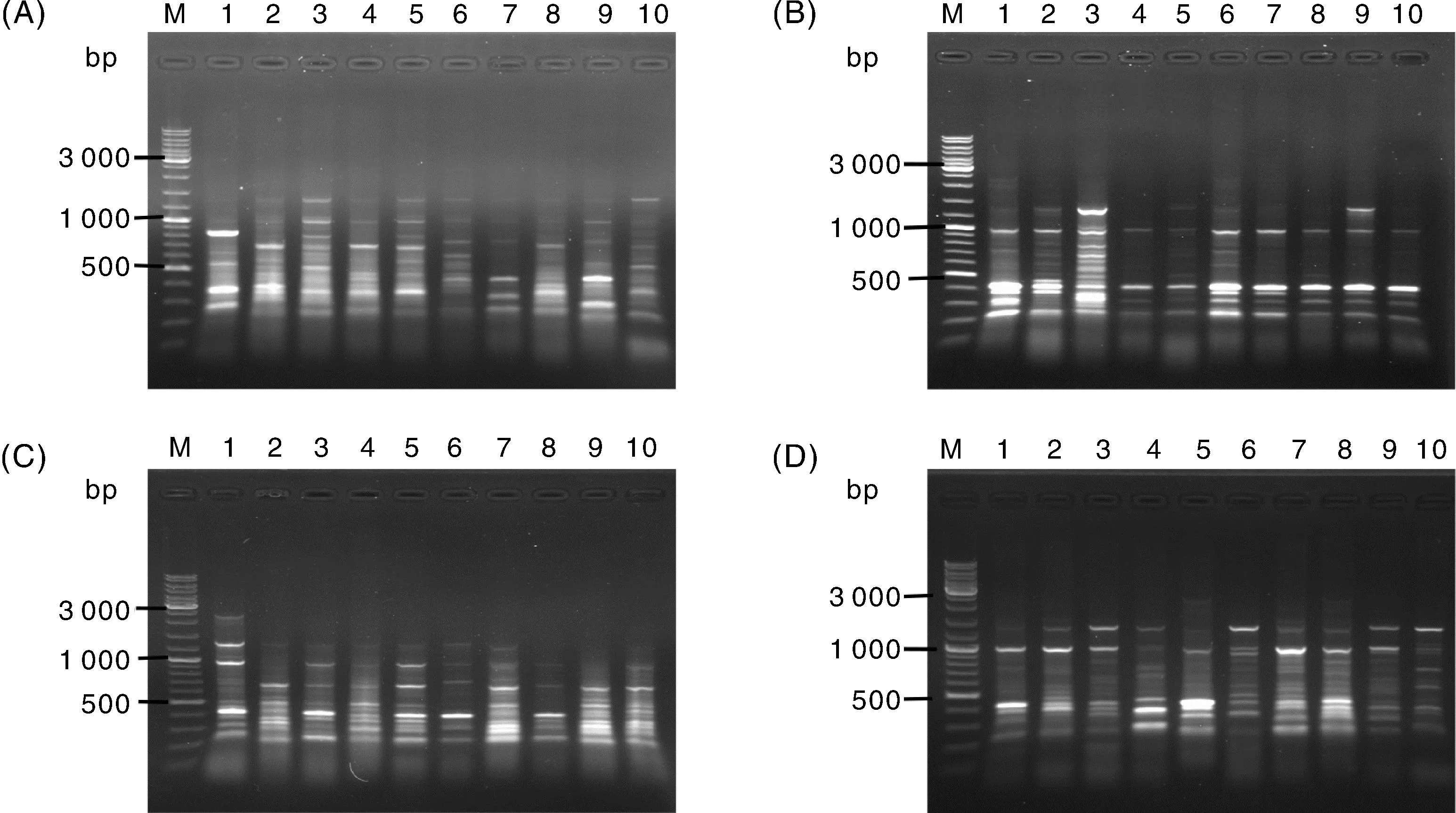
M,DNA标准分子量;A~D,池澡、天岗尖、道场矶和括苍山样地;1~10,10个样品。M, DNA marker; A-D, Sampling sites of CZ, TGJ, DCJ and KCS; 1-10, Ten samples.图2 ME5/em4引物的PCR扩增产物Fig.2 PCR products using ME5/em4 primer pairs
2.2 居群间的遗传多样性分析
利用8对引物共扩增出263个位点,其中多态性位点261个,多态位点百分率为99.24%,平均每对引物扩增出32.87个位点(表3)。观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)和Shannon's信息指数(I)如表3所示。物种水平上,华顶杜鹃的H为0.221 5,I为0.357 9,而居群水平的PPB均值为36.96%,I与H的均值分别为0.181 7和0.119 9,数据低于物种水平。各居群的遗传参数也存在较大的差异,KCS的遗传参数(Na、Ne、H、I)都大于其他居群,具有较高的遗传多样性。
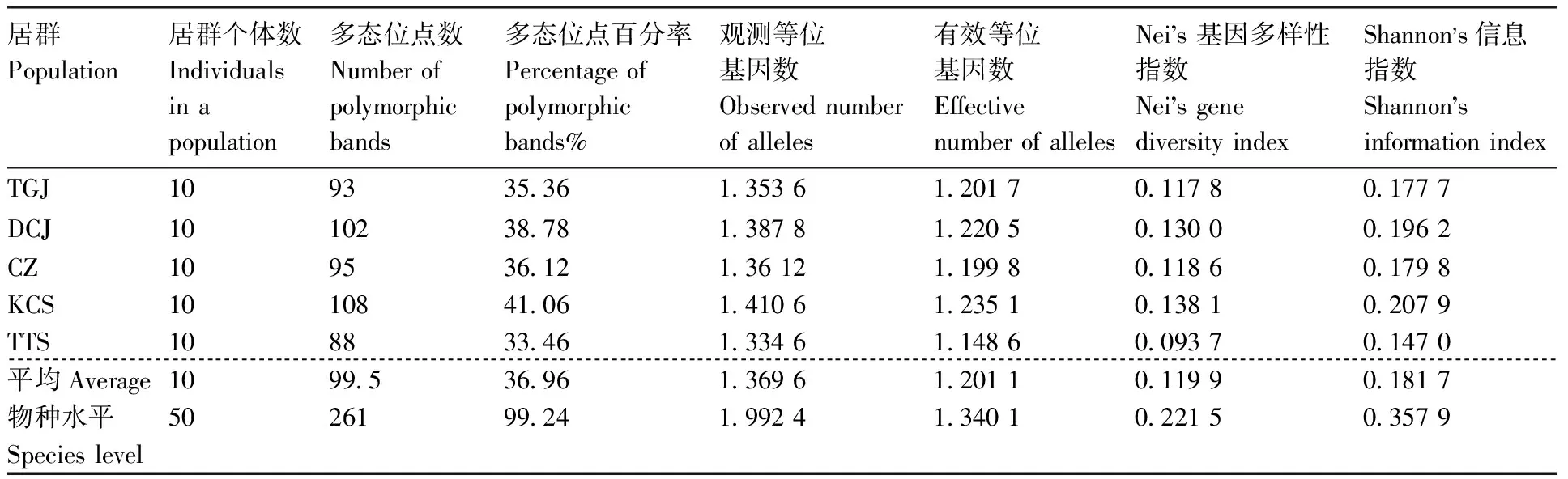
表3 华顶杜鹃居群的遗传多样性
2.3 居群间的遗传结构分析
各居群间遗传距离范围为0.116 7~0.217 3,平均遗传距离为0.156 7,其中KCS和CZ的遗传距离最大,为0.217 3,遗传一致度最小,为0.804 7,说明居群间存在较大的遗传差异,它们的关系较远;DCJ与CZ的遗传距离最小,为0.116 7,遗传相似系数最大,为0.889 9,表明2个居群的遗传差异性最小(表4)。遗传分化系数(Gst)和基因流(Nm)的计算结果表明,5个居群间的Gst为0.459 6,即遗传变异中有45.96%来自于居群间,54.04%存在于居群内;Nm为0.587 8,该值小于1,表明居群间的遗传交流少。
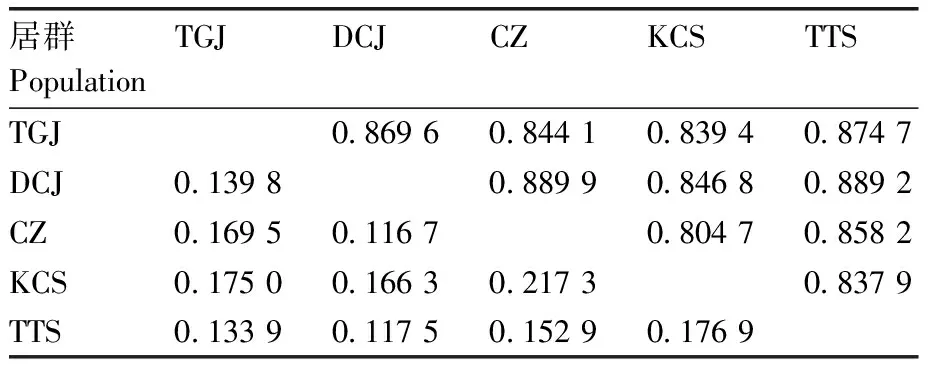
表4 华顶杜鹃4个居群的遗传距离与遗传一致性
2.4 聚类分析
聚类分析结果显示,遗传相似系数为0.31时,5个居群聚为2个不同的分支,第一支包括居群TGJ、KCS和TTS,另一支包括居群DCJ和CZ,表明DCJ、CZ与其他3个居群间的关系相对较远;随着相似系数的升高,居群个体间的遗传关系更加明确,同一地理来源的样品聚为一组,居群之间没有任何交叉。遗传相似系数约为0.56时,TTS居群的10个样品被分为两支,TTS3单独聚于一支,说明TTS3与该居群内其他个体间存在一定的差异(图3)。利用OriginPro软件进行主成分分析,结果表明,来自5个不同居群的50个样品可分为5组,每组10个样品,与聚类分析的结果一致(图4)。
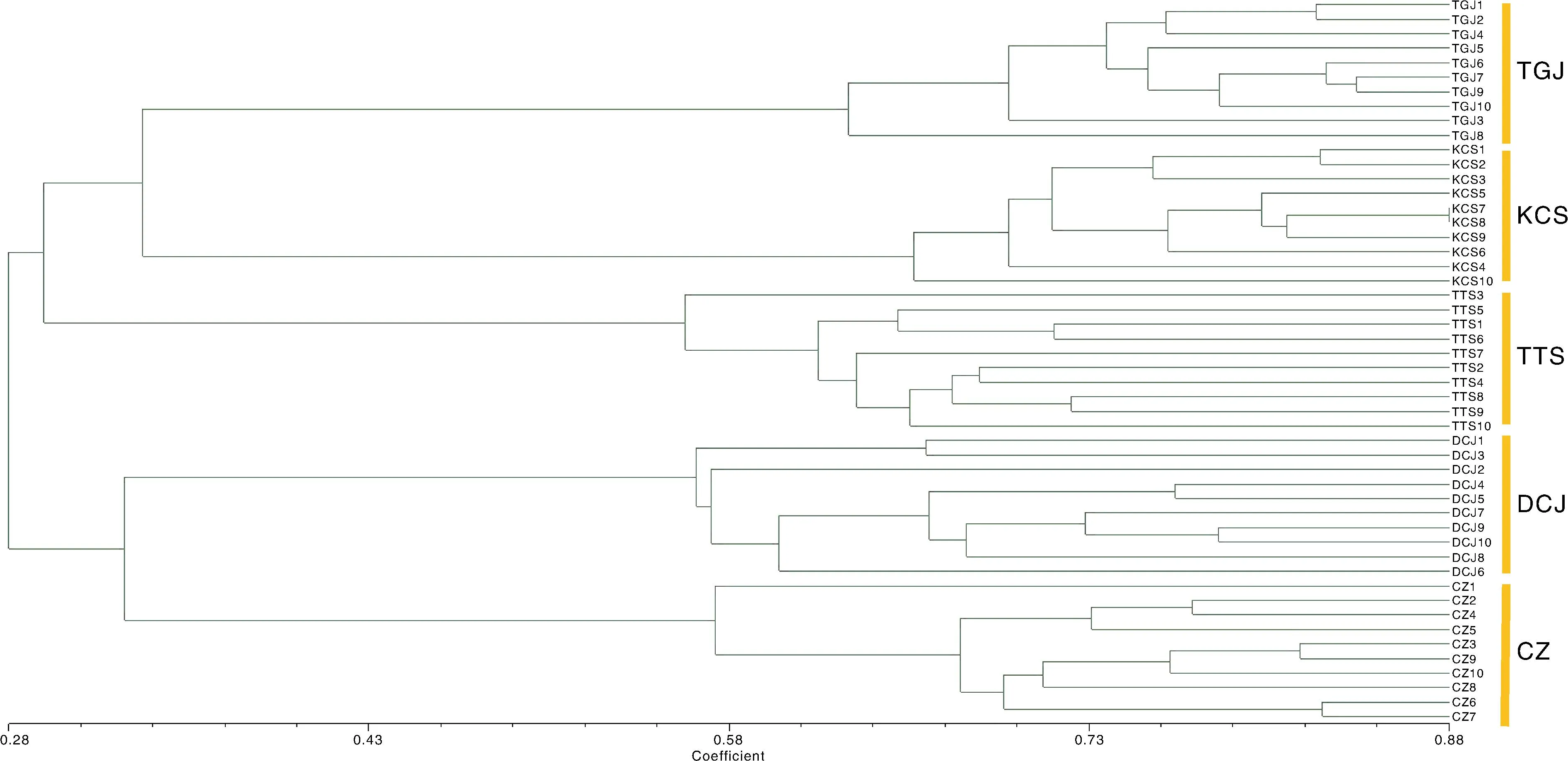
TGJ,天岗尖;DCJ,道场矶;CZ,池澡;KCS,括苍山;TTS,天台山。TGJ, Tiangangjian; DCJ, Daochangji; CZ, Chizao; KCS, Kuocangshan; TTS, Tiantaishan.图3 华顶杜鹃5个居群的UPGMA聚类图Fig.3 Dendrogram of 5 Rhododendron huadingense populations based on UPGMA
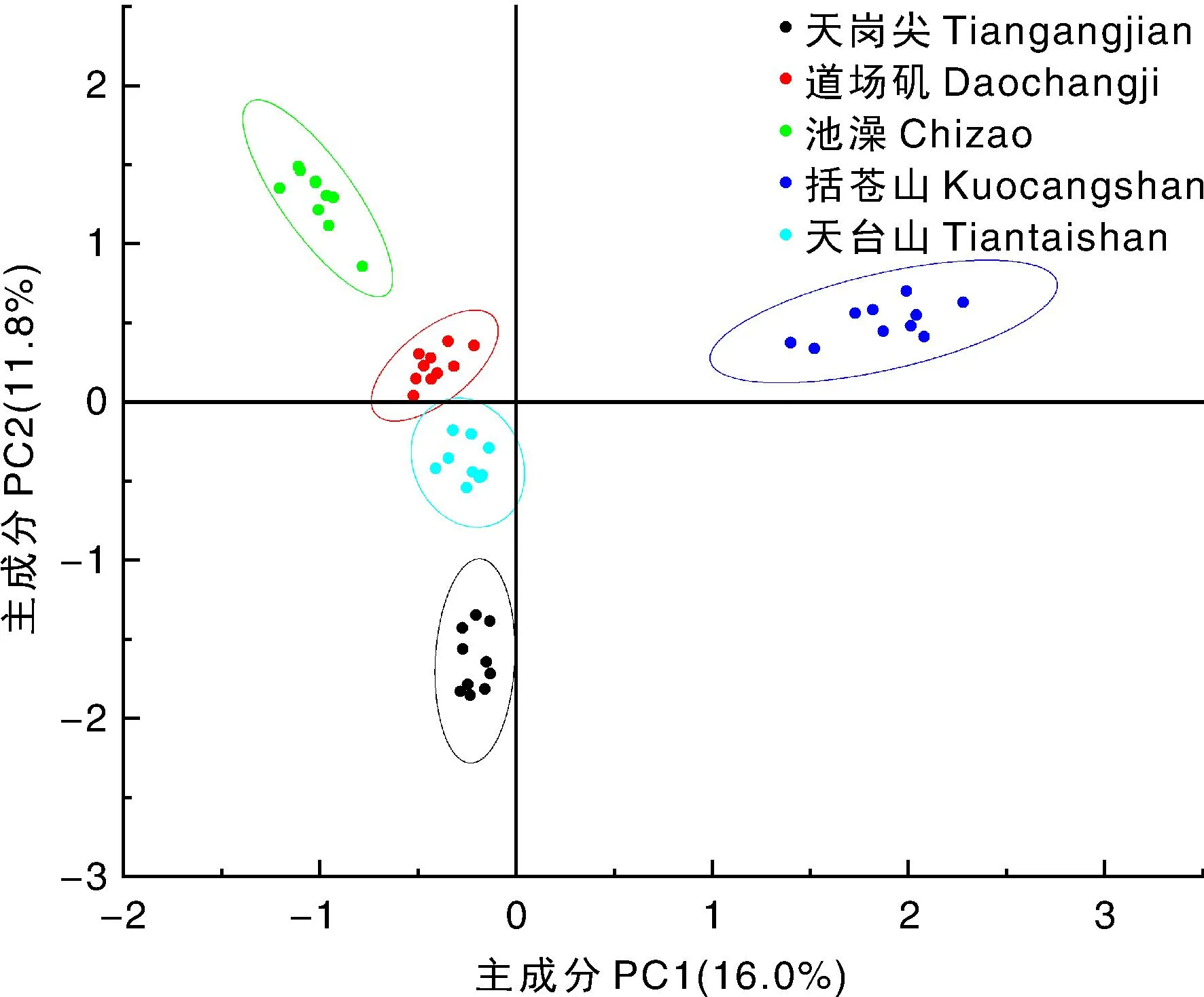
图4 华顶杜鹃居群的主成分分析Fig.4 Principal component analysis of Rhododendron huadingense populations
3 结论与讨论
遗传多样性是评判物种进化潜力和适应能力的依据,遗传多样性水平越高,物种内所含的等位基因就越丰富,适应环境能力越强,进化潜能越大[12]。通常广布种的遗传多样性水平较其他物种高,但也有研究表明,一些窄域种、濒危种或特有种的遗传多样性水平高于广布种。由永飞等[13]利用SRAP分子标记分析濒危植物金毛狗(Cibotiumbarometz)的遗传多样性,结果显示,其物种水平多态性百分率为85.98%,具有较高的遗传多样性水平。叶兴壮等[14]对濒危植物半枫荷(Semiliquidambarcathayensis)进行研究,发现其遗传多样性水平远高于部分广布种。王长林等[15]利用SRAP分子标记研究珍稀濒危植物明党参(Changiumsmyrnioides)10个居群的遗传多样性,发现其多态性位点百分率为86.50%,显示了较高的遗传多样性。本研究也得到了类似的结果,在物种水平上,华顶杜鹃的PPB值高达99.24%,I值为0.357 9,H值为0.221 5,高于许多濒危的灌木物种,而居群水平上的遗传参数远小于物种水平,表明华顶杜鹃居群内个体的遗传变异水平相对较低。
植物种群的遗传变异主要受到种群大小、繁育系统、基因流等因素的影响,其中基因流的迁移可以防止种群分化,阻止种群内遗传变异的减少[16]。植物的基因交流需要依靠花粉、孢子等携带遗传物质的媒介,而华顶杜鹃的繁育系统为异交,可以通过种子或花粉的扩散进行居群间和居群内基因的交流[17]。任雪锋等[18]对异花授粉植物狗牙根(Cynodondactylon)进行遗传多样性研究,结果显示,狗牙根居群间的遗传分化系数为0.385 7,说明其居群内存在频繁的杂交现象,而居群间的基因交流受到地理隔绝的限制。槭属(Acer)植物青榨槭(A.davidii)种群内存在一定程度的自交和近交,加之生境片段化的影响,使得居群间的遗传分化水平较低[19]。本研究中,华顶杜鹃居群间的遗传分化系数为0.459 6,表明遗传变异大部分出现在居群内,其余发生在居群间。Wright[20]研究发现,当Nm<1时,遗传漂变会导致种群间发生明显的遗传分化。华顶杜鹃Nm为0.587 8,说明居群间发生了遗传漂变,它是居群间发生遗传分化的重要原因之一。
本研究在野外采样、基因组DNA提取、引物筛选的基础上,利用SRAP分子标记明确了华顶杜鹃的遗传多样性,为后续开展华顶杜鹃的保护和合理利用提供了依据。
