水稻泛素连接酶D3与抗病相关蛋白VOZ2的互作分析
2024-02-05罗英杰崔维军王忠华吴月燕林宏友严成其王栩鸣
罗英杰,崔维军,王忠华,吴月燕,林宏友,周 洁,严成其,3,*,王栩鸣,*
(1.浙江万里学院 生物与环境学院,浙江 宁波 315100; 2.浙江省农业科学院 农产品质量安全危害因子与风险防控国家重点实验室,浙江 杭州310021; 3.宁波市农业科学研究院 生物技术研究所,浙江 宁波315100)
水稻是我国主要的粮食作物和口粮,其生产关系到我国的粮食安全。然而,水稻在生长发育过程中受到多种病虫害的威胁。其中,由水稻黄单胞菌水稻致病变种(Xanthomonasoryzaepv.oryzae,Xoo)引起的水稻白叶枯病,是水稻生产过程中一种常见且严重的病害[1],对水稻的生产安全造成严重的威胁。
据报道,施用噻唑锌、噻森铜等农药可有效防治白叶枯病[2-3],但农药的不当使用容易造成环境污染,破坏生态平衡,不符合绿色、可持续的发展理念。同时,化学农药的过度使用容易使病原菌产生抗药性。培育和推广抗病品种是防治水稻白叶枯病最为经济、有效且环保的措施。因此,挖掘相关基因资源并解析其抗病机制对于水稻生产具有重要意义[4]。已有研究表明,独脚金内酯(strigolactone, SL)及其通路中的重要组成部分多蘖矮秆基因dwarf-3(D3)在植物生长发育过程中起到重要作用[5-7]。SL是一类新发现的调控植物株型的重要激素[6,8-9],与植物抗病性有着非常密切的关联[10],D3编码的D3蛋白是一个与拟南芥Max2/ORE9同源的富含亮氨酸重复序列的F-box蛋白[11]。相关研究表明,D3蛋白能抑制水稻分蘖芽的活性,维持其休眠性[12]。D3组装成的SCFD3复合体正调控SL信号[13],SL通过蛋白酶体-泛素途径以一种依赖于D14/D14L-SCFD3复合体的方式诱导D53/OsSMAX1泛素化与降解[14],进而控制水稻地上分蘖枝[6]与中胚轴的伸长[15];D14L-SCFD3复合体作用于丛枝菌根(arbuscular mycorrhizal, AM)信号途径上游,对水稻与AM共生关系的建立至关重要[7]。SCFD3复合体能降解糖原合成酶激酶2(glycogen synthase kinase 2, OsGSK2)磷酸化的细胞周期蛋白CYC U2并抑制中胚轴的伸长[16];D3蛋白可以延缓黑暗诱导的植物叶片衰老过程和过氧化氢诱导的植物叶片细胞死亡过程[17]。
据报道,拟南芥MAX2基因参与植物对果胶杆菌(Pectobacteriumcarotovorum)和丁香假单胞菌(Pseudomonassyringae)的防卫反应[18],推测水稻中MAX2的同源基因D3可能在水稻的免疫防卫反应中发挥着重要的作用。前人研究发现,水稻d3突变体对白叶枯病的抗性明显增强[19],然而其机制尚不明确。本研究中,我们通过酵母双杂交(yeast two hybrid, Y2H)试验筛选到了多个与D3存在互作的蛋白,其中包括维管植物单锌指蛋白VOZ2。已有研究表明,VOZ2与白叶枯病菌Ⅲ型效应子XopN存在相互作用,共同调控水稻对部分白叶枯病菌小种的抗性[20]。在稻瘟病菌侵染过程中,VOZ1和VOZ2负调控水稻的基础免疫防卫反应,但增强了稻瘟菌效应子触发的免疫反应[21]。D3是SL激素信号传导的重要基因,影响植物分蘖;而SL在植物防御反应中发挥积极作用。对D3基因功能的研究不仅能为抗病基因挖掘提供丰富资源,还可以为进一步阐述SL在水稻免疫防御反应机制提供分子基础。
1 材料与方法
1.1 材料
试验中所使用水稻为野生型日本晴(OryzasativaL. spp.japonicavar Nipponbare, Nip),烟草为野生型本氏烟草(Nicotianabenthamiana),均由实验室提供。
KOD FX DNA聚合酶购自东洋纺生物科技有限公司;InFuion同源重组酶、酵母菌株Y2H Gold购自宝日医生物技术有限公司;纤维素酶、果胶酶购自Yakult(养乐多投资有限公司);Flag抗体、Actin抗体、HRP标记二抗购自Abcam[艾博抗(上海)贸易有限公司];硝酸纤维素膜(NC膜)购自Merck(默克化工技术有限公司);cDNA模板、大肠埃希菌DH5α和农杆菌GV3101均为本实验室保存。
1.2 方法
1.2.1 载体构建
从中国水稻数据库(www.ricedata.cn)中获得D3、VOZ2基因的CDS序列,然后用Primer Premier 5.0软件设计引物,序列见表1。以逆转录所得的日本晴叶片cDNA为模板进行PCR扩增,PCR体系参照KOD FX DNA聚合酶说明书。
扩增获得D3、VOZ2基因的CDS序列,通过InFusion同源重组将上述片段与经限制性核酸内切酶BciVⅠ线性化的pB2E-T载体连接。通过LR重组分别构建C端有绿色荧光蛋白(green fluorescent protein, GFP)、红色荧光蛋白(red fluorescent protein, RFP)标签的表达载体,以及nYFP(yellow fluorescent protein,YFP)、cYFP的表达载体,获得D3-GFP、VOZ2-RFP、D3-nYFP、VOZ2-cYFP表达载体。
以pB2E-D3和pB2E-VOZ2质粒为模板,利用Primer Premier 5.0软件设计引物。通过InFusion同源重组将D3与VOZ2基因的CDS片段分别与经限制性核酸内切酶NdeⅠ和BamHⅠ线性化的载体pGBKT7、pGADT7连接,获得酵母表达载体pGBKT7-D3、pGADT7-VOZ2。通过同样的方式将VOZ2基因的CDS片段与经限制性核酸内切酶BamHⅠ、SalⅠ线性化的载体pCAMBIA1300-35S-3×Flag连接,获得带Flag标签的VOZ2-3×Flag表达载体。
1.2.2 酵母自激活与双杂交验证
通过聚乙二醇(PEG)/醋酸锂转化法将pGBKT7-D3质粒转入酵母菌株Y2H Gold中,并涂布在SD/-Trp缺陷培养基上,30 ℃培养2~4 d,待长出单克隆后,挑取单克隆进行梯度稀释,点板至预先涂布在含4 mg·mL-1X-α-Gal(5-溴-4-氯-3-吲哚-α-D-半乳糖苷)溶液的SD/-Trp缺陷培养基上;以共转pGBKT7-Lam和pGADT7-T的Y2HGold酵母菌株作为阴性对照,以共转pGBKT7-53和pGADT7-T的Y2H Gold酵母菌株作为阳性对照,在30 ℃培养箱倒置培养2~3 d,观察酵母的生长情况。通过PEG/醋酸锂转化法,将pGBKT7-D3和pGADT7-VOZ2共转酵母菌株Y2H Gold中,并涂布在SD/-Trp-Leu缺陷培养基上,30 ℃培养3~4 d;待长出单克隆后,挑取单克隆、阴性、阳性对照分别进行梯度稀释,点板至SD/-Trp-Leu、SD/-Trp-Leu-His培养基,以及涂布在含4 mg·mL-1X-α-Gal溶液的SD/-Trp-Leu-His缺陷培养基上。30 ℃培养箱倒置培养3~5 d,观察酵母的生长情况。
β-半乳糖苷酶活性测定。挑取上述单克隆至YPDA液体培养基中,30 ℃、230 r·min-1培养至吸光度D600至0.6左右,取出放置于冰上,加入Z buffer(100 mmol·L-1Na2HPO4,40 mmol·L-1NaH2PO4,10 mmol·L-1KCl,1 mmol·L-1MgSO4,1% β-巯基乙醇)、氯仿和质量分数0.1%的SDS进行裂解,酵母细胞进行充分裂解后加入4 mg·mL-1邻硝基酚-β-半乳糖苷(ONPG)溶液,充分混匀后立即置于30 ℃水浴30~60 min,显色。待颜色变黄后加入1 mol·L-1Na2CO3溶液终止反应,吸取上清测定各酵母菌株在420 nm和550 nm的吸光度。采用下式计算β-半乳糖苷酶活性:
E=1 000×[(D420-1.75×D550)]/(t×V×D600)。
(1)
式(1)中:E为β-半乳糖苷酶活性酶活性(单位为Miller units);D420和D550分别为显色后的反应液在420 nm和550 nm的吸光度;D600为用于显色分析的酵母细胞培养液在600 nm的吸光度;t为显色反应时间(单位min);V为用于显色分析的酵母细胞培养液体积(单位mL)。
1.2.3 水稻白叶枯病菌接种
将冻存的水稻白叶枯病菌P10小种接种至协本哲液体培养基中,在摇床(28 ℃,230 r·min-1)中活化培养过夜。随后转接至新的协本哲液体培养基中培养2~3 h,至D600为0.6~0.8,收集菌体。
采用剪叶法对14 d苗龄的Nip植株进行白叶枯病菌接种,以接种H2O的Nip植株为对照。分别于接种后0、2、6、8、12、24、36、48、60、72 h收集相同位置的水稻叶片组织,提取RNA并进行逆转录。通过实时荧光定量PCR(qRT-PCR)检测VOZ2基因在白叶枯病菌侵染不同时间点的表达水平。
1.2.4 水稻原生质体制备与转化
取9311(Oryzasativassp.indicavar 9311)水稻种子,用体积分数75%的乙醇浸泡1 min,然后用体积分数30%次氯酸钠溶液浸泡30 min,无菌水清洗3次后,播种至1/2 MS培养基上,于30 ℃培养箱中黑暗培养7~10 d。取出完成培养的水稻幼苗,用剪刀剪掉水稻根部保留部分茎杆;再用刀片将水稻叶鞘每段切成0.5 mm左右的薄片,随后转移至酶解液[含质量分数1.5%纤维素酶,质量分数0.75%果胶酶,质量分数0.1%牛血清白蛋白(BSA),0.6 mol·L-1甘露醇,10 mmol·L-1CaCl2,10 mmol·L-1MES(2-吗啉乙磺酸),pH值5.7]中,25 ℃、60 r·min-1酶解4~5 h;用40 μm的尼龙过滤筛过滤碎渣,800×g离心3 min后收集沉淀,用W5溶液(154 mmol·L-1NaCl,125 mmol·L-1CaCl2,5 mmol·L-1KCl,2 mmol·L-1MES,pH值5.7)清洗原生质体,重复1~2次后加入MMG溶液(0.4 mol·L-1mannitol,15 mmol·L-1MgCl2,4 mmol·L-1MES,pH值5.7)重悬,静置备用。
参考已报道的水稻原生质体解离[22]的方法,利用PEG转化法将载体D3-GFP与VOZ2-RFP转化至水稻原生质体中。
1.2.5 农杆菌介导的烟草叶片瞬时表达
将野生型本氏烟草种子播种于土钵中,置于25 ℃温室培养至子叶完全伸展开,然后移栽到一次性小钵中培养约4周。将载体D3-nYFP、VOZ2-cYFP用电击转化的方式转化至农杆菌GV3101中。挑取完成转化的农杆菌转移至LB液体培养基(含50 μg·mL-1卡那霉素和50 μg·mL-1利福平)中,在摇床(28 ℃,230 r·min-1)中培养至D600为0.8~1.0。5 000×g离心3 min收集菌体。用侵染液(含10 mmol·L-1MgCl2,10 mmol·L-1MES,150 μmol·L-1乙酰丁香酮,pH值5.6)调整两者的菌液浓度至D600=0.6,然后混合均匀。使用无针头注射器将菌液注射至合适的叶片背部,浸润烟草叶片,48~72 h后在显微镜下观察。
1.2.6 共定位与双分子荧光互补(BiFC)实验
将共转D3-GFP和VOZ2-RFP的水稻原生质体培养16 h后,通过奥林巴斯共聚焦显微镜FV1000观察水稻原生质体中的GFP和RFP荧光信号。观察GFP荧光信号所使用的激发光和发射光波长分别为488 nm和520 nm,观察RFP荧光信号所使用的激发光和发射光波长分别为561 nm和620 nm。
共浸润转D3-nYFP和VOZ2-cYFP载体的农杆菌48~72 h后,剪取部分浸润区域的烟草叶片,于Lecia SPS激光共聚焦扫描显微镜下观察YFP荧光信号。激发光和发射光波长分别为512 nm和518~566 nm。
2 结果与分析
2.1 D3不存在自激活现象
由于某些蛋白可以在酵母中发挥转录激活作用,在无特异激活结构域的条件下便可使DNA结合结构域激活报告基因GAL4,产生“假阳性”结果[23]。因此,在进行酵母双杂交实验之前需要进行诱饵基因自激活检测。MEL1是GAL4酵母双杂交系统的一个报告基因,X-α-gal是酵母半乳糖苷酶(MEL1)的显色底物,MEL1编码的分泌型α-半乳糖酶可将X-α-gal水解为蓝色产物[24]。结果显示,转化pGBKT7-D3后的酵母菌可以在SD/-Trp酵母培养基上正常生长,但无法使X-α-gal变蓝(图1),说明D3无自激活活性,可以进行后续酵母双杂实验。
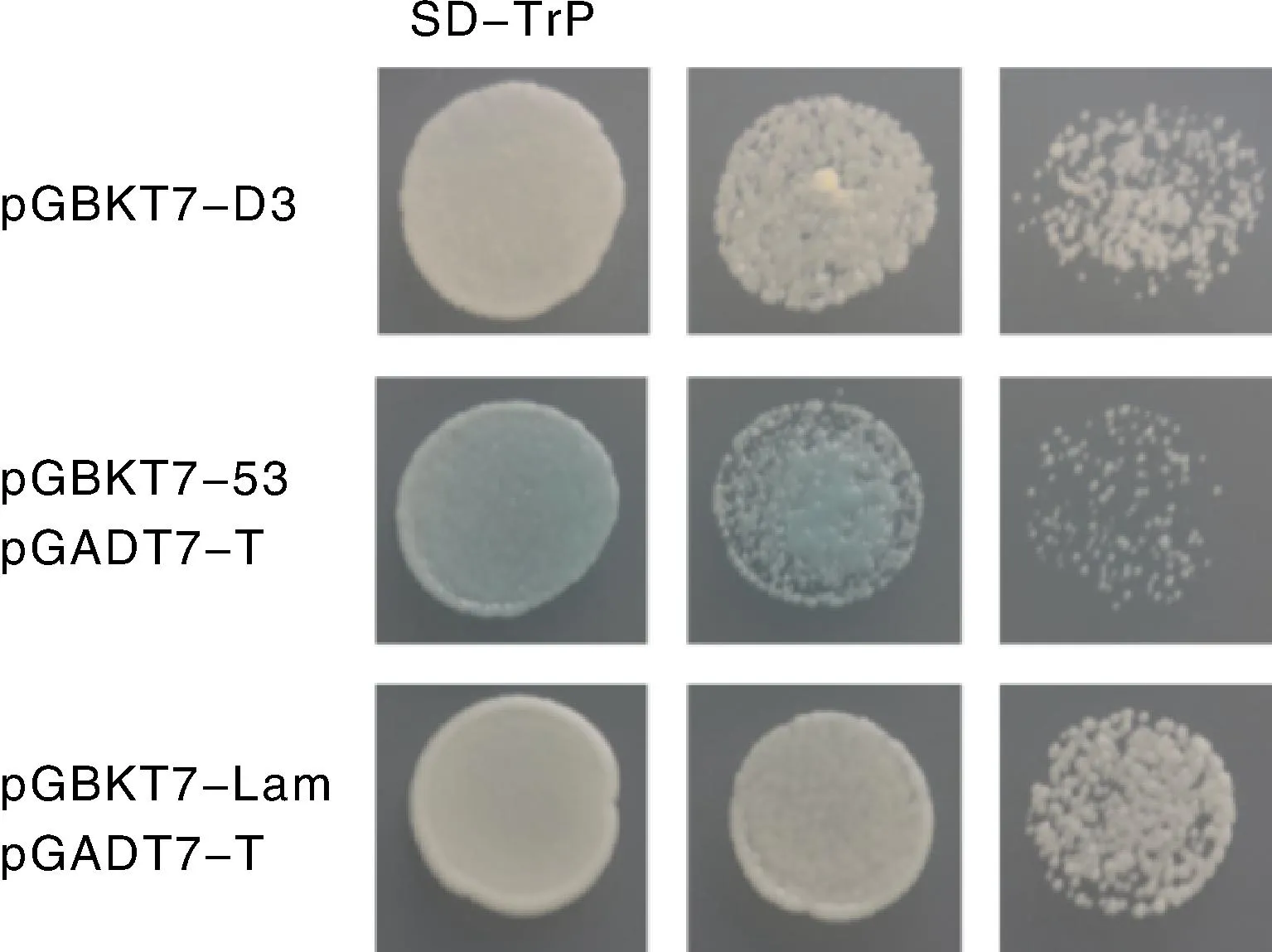
图1 D3自激活验证Fig.1 Self-activation verification of D3
2.2 D3与VOZ2在酵母中存在互作
将共同转化pGBKT7-D3和pGADT7-VOZ2的酵母菌,以及阳性对照、阴性对照酵母菌在2缺培养基(-Trp/Leu)上培养3 d后,共转pGBKT7-D3与pGADT7-VOZ2的酵母和阳性对照pGBKT7-53+pGADT7-T均可在SD-Trp-Leu-His三缺培养基上正常生长,且可以使X-α-gal变蓝。阴性对照组无法在SD-Trp-Leu-His三缺培养基上正常生长(图2)。以上结果说明,D3与VOZ2能够在酵母体内结合,并启动部分下游报告基因的表达,证明D3与VOZ2在酵母体内发生了弱互作。

图2 酵母双杂交法验证D3与VOZ2的蛋白互作Fig.2 The protein interaction between D3 and VOZ2 verified by yeast two-hybrid method
通过测定酵母的β-半乳糖苷酶活性来检测D3与VOZ2在酵母体内的互作强度。结果(图3)显示,共转pGBKT7-D3与pGADT7-VOZ2的酵母β-半乳糖苷酶活性弱于阳性对照,强于阴性对照,表明D3与VOZ2在酵母体内存在互作。
2.3 VOZ2基因受Xoo的诱导
在接种白叶枯病菌P10小种的0~6 h,Nip植株中VOZ2基因表达水平下调;6~72 h,VOZ2基因的表达水平总体上上调,且在12 h时表达水量最高(图4),由此说明,VOZ2基因确实受到水稻白叶枯病菌的诱导,表明其可能参与水稻对白叶枯病菌的免疫反应过程。
2.4 D3与VOZ2在水稻原生质体细胞核中存在共同定位
为探究D3与VOZ2的亚细胞定位情况,利用水稻原生质体瞬时表达系统进行共定位实验。将转染12~16 h的水稻原生质体置于激光共聚焦显微镜下观察荧光分布情况。转染D3-GFP的水稻原生质体在细胞核处有明显绿色荧光,表明D3主要定位在细胞核中,与前人的结果一致[6]。
转染VOZ2-RFP的水稻原生质体在细胞核和细胞质处均有明显红色荧光,表明VOZ2在水稻原生质体的细胞核与细胞质中均有分布。共同转染D3-GFP、VOZ2-RFP的水稻原生质体在细胞核处出现绿色荧光与红色荧光的叠加,表明D3与VOZ2在水稻细胞核中存在共定位(图5)。
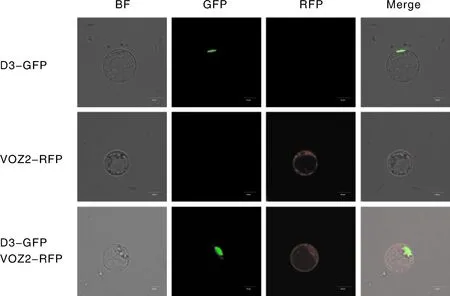
BF,明场;GFP,绿色荧光;RFP,红色荧光;Merge,混合通道。BF, Bright field; GFP, Green fluorescent; RFP, Red fluorescent; Merge, Merge channel.图5 D3与VOZ2的亚细胞定位Fig.5 Subcellular localization of D3 and VOZ2
2.5 D3与VOZ2在烟草叶肉细胞中存在互作
通过农杆菌介导的烟草瞬时表达系统进行BiFC实验。激光共聚焦显微镜下观察发现:共注射D3-nYFP、cYFP和nYFP、VOZ2-cYFP的烟草叶肉细胞在激光下无荧光信号(图6),说明单独的N端或者C端并不能引起黄色荧光的激发;共注射D3-nYFP、VOZ2-cYFP的烟草叶肉细胞在激光下细胞核与细胞质中均产生较强的荧光,表明D3与VOZ2在烟草叶肉细胞内发生互作,且发生互作的部位位于细胞核与细胞质中。
3 讨论
推广和种植抗病品种一方面可降低水稻生产过程中投入的人力、物力成本,提高水稻产量和质量;另一方面也有助于控制病害的发生与流行,是最为经济有效的防治措施。目前,由稻黄单胞菌引起的白叶枯病是我国水稻生产过程中的主流病害之一。挖掘抗病基因并研究其抗病机理对培育抗病水稻品种具有重要意义。随着水稻基因组测序工作的完成,许多抗病相关基因得以被发掘、研究、阐释。目前的研究发现,许多SCF类复合物在植物免疫调控过程中发挥着重要的作用。Ao等[25]发现,拟南芥的SNIPER7过表达植株抗病反应增强且SCFSNIPER7复合体通过调控解折叠酶CDC48的蛋白水平,进而调控拟南芥的抗病反应。已有研究发现,SCF复合体亚基GF14e对水稻的白叶枯病和纹枯病抗性具有负调控作用[26]。D3作为SCFD3复合体的重要组成部分在抗病过程中的研究较少[13-14]。
D3基因编码一个富含亮氨酸重复序列的F-box蛋白,其N端含F-box结构域,负责同SKPI蛋白互作,形成SCFD3复合体;其C端含LRRs结构域[27],能够与靶蛋白特异性结合,并由SCFD3复合物通过泛素化途径介导靶蛋白的降解[28]。目前在拟南芥中已鉴定到SMXL6、SMXL7、SMXL8为MAX2的靶蛋白[29],而在水稻中已知D3的靶蛋白只有D53。因此,进一步分析和鉴定D3的靶蛋白对于深入解析D3的调控网络具有重要意义。
本研究通过酵母双杂交试验筛选到D3与VOZ2存在互作,VOZ2可作为D3潜在的靶蛋白。VOZ最早从拟南芥中克隆出来[30],过表达VOZ2可以增强拟南芥对炭疽病菌的抗性[31];另有研究发现,VOZ2可以通过与β-氨基丁酸的受体IBI1互作,参与调控拟南芥中胼胝质介导的防卫反应[32]。在水稻中,VOZ2同样参与水稻对不同病原菌的免疫防卫反应,VOZ2与白叶枯病菌Ⅲ型效应子XopN存在相互作用[20];Wang等[21]研究发现,VOZ2降低了水稻对稻瘟病的基础防卫反应,但增强了水稻Piz-t基因介导的抗病过程。
本研究证明,VOZ2基因受白叶枯病菌的诱导,D3与VOZ2存在相互作用,D3与VOZ2在水稻原生质体的细胞核中存在共定位。但目前的研究存在以下问题:首先D3与VOZ2蛋白互作强度较弱,推测D3促进VOZ2的降解,进而减弱了D3与VOZ2之间的互作强度;其次,在水稻原生质体与烟草叶肉细胞中,D3与VOZ2的互作位置存在差异,推测可能是由于水稻与烟草为不同物种,不同物种的细胞在翻译表达基因时,其表达模式与影响因子不同,因而在互作位置上产生差异。下一步,我们将检测D3对VOZ2稳定性的影响,构建并检测voz2突变水稻材料和voz2/d3双突变水稻材料,并通过大田实验验证各材料对白叶枯病的抗性。
