鸡滑液囊支原体的分离鉴定及药敏试验
2024-01-29殷梦玉张腾飞张文婷郭云清罗青平
殷梦玉,张腾飞,张文婷,胡 巧,卢 琴,郭云清*,罗青平,2*
(1.湖北省农业科学院畜牧兽医研究所/农业农村部畜禽细菌病防治制剂创制重点实验室/畜禽病原微生物学湖北省重点实验室,湖北武汉 430064;2.湖北洪山实验室,湖北武汉 430064)
鸡滑液囊支原体(Mycoplasmasynoviae,MS)属于柔膜体纲支原体属,直径在0.2 ~0.4 μm之间[1],无细胞壁。鸡滑液囊支原体只有1种血清型,但根据VlhA基因可分为17种基因型(A-K)[2-3]。其基因组全长大小为740~850 kb,由于其GC含量相对较低,具有极强的抗原变异能力[4]。瑞氏-姬姆萨染色观察菌落形态为球形,低倍镜下观察在固体培养基上呈“煎蛋样”菌落。
M.主要引起禽类和鸟类的上呼吸道疾病、滑膜炎和关节炎等[5]。一年四季均可发生,但多发于冬春季节[6]。既可水平传播,也可垂直传播,在全球均广泛流行[7-8]。发病初期表现为食欲不振、鸡冠苍白,跛行等症状,病情重时鸡冠萎缩,关节、爪垫肿胀[9-11],剖检可见胸部起水疱,脾、肝、肾肿大等症状[12]。主要引起肉鸡生长缓慢和蛋鸡蛋品质、产蛋量明显下降,给养禽业造成巨大的经济损失。
M.的防控主要包括免疫接种和药物治疗。临床上使用的疫苗主要有鸡滑液支原体活疫苗MS-H株和鸡滑液支原体灭活疫苗YBF-MS1株[13-14];临床上主要使用泰妙菌素和磷酸替米考星等药物进行治疗[15];同时制定严格的生物安全防护措施,对于该病的预防也具有重要作用。本文通过从临床病料分离出滑液囊支原体菌株,为该病的流行病学调查和防治提供参考。
1 材料与方法
1.1 材料
1.1.1 病鸡及SPF鸡胚 2022年9月份,湖北省咸宁市某发病鸡场,存栏2 000只,180日龄,品种为红瑶,临床有咳嗽等呼吸道症状,每天死亡4~5只,产蛋率上不去。送检5只病鸡,取肝脏、脾脏、肺脏和大脑等组织用于细菌病毒的分离鉴定,喉头气管和关节分离滑液囊支原体。SPF鸡胚购自北京勃林格殷格翰维通生物技术有限公司。
1.1.2 主要试剂 改良Frey氏液体培养基和固体培养基,青岛海博生物公司产品;TSA培养基,美国BD公司产品;酚红,索莱宝公司产品;瑞氏-姬姆萨染色液、盐酸林可霉素(≥95.0%)碧云天生物技术公司产品;酒石酸泰乐菌素、泰妙菌素、替米考星、盐酸大观霉素,上海源叶生物科技有限公司产品;环丙沙星、四环素、硫酸链霉素、壮观霉素;Prime start Max Premix(2X)、HiScript ⅡQ RT SuperMix和RNA提取试剂盒,诺唯赞生物科技股份有限公司产品;细菌基因组DNA提取试剂盒,天根生化科技有限公司产品;DNA标准DL 2 000,宝生物工程(大连)有限公司产品;Agarose琼脂糖,德国Bio Froxx公司产品。
1.1.3 主要仪器设备 生物安全柜,苏州净化设备公司产品;CO2生化培养箱,湖北恒丰医疗器械公司产品;立式高压蒸汽灭菌锅,上海博讯医疗设备厂产品;PCR仪、琼脂糖凝胶成像系统,美国Bio-Rad公司产品;电泳仪,北京六一生物科技有限公司产品;小型高速离心机,德国Eppendorf公司产品;组织破碎仪,德国QIAGEN公司产品;pH计,美国Oakton公司产品;分析天平,德国Sartorius公司产品。
1.2 方法
1.2.1 病毒的分离 无菌采集病鸡肝脏、肺脏、脾脏和大脑等组织,剪碎后加入适量PBS,破碎仪破碎后反复冻融3次,吸取上清液,采用0.22 μm滤器过滤后接种10日龄SPF鸡胚,37 ℃孵化器内孵化,96 h后收集鸡胚尿囊液。利用RNA提取试剂盒提取RNA,并按照HiScript ⅡQ RT SuperMix for qPCR说明书制备模板cDNA。
1.2.2 细菌的分离 无菌采集病料的肝脏、脾脏和大脑组织,划线接种于TSA平板,置于37 ℃恒温培养箱培养12~18 h,进行的细菌的分离与鉴定。利用细菌基因组DNA提取试剂盒提取基因组DNA。
1.2.3 支原体的分离 在无菌条件下采集气管、喉头和关节并剪碎,置于适量1×PBS中,破碎仪破碎,4 000 r/min离心5 min取上清,采用0.45 μm滤器过滤接入改良Frey氏液体培养基中,置于37 ℃、体积分数为5%的CO2培养箱静置培养。次日采用0.22 μm滤器重新过滤,转接至Frey氏液体培养基中,37 ℃培养箱内进行培养,当培养基颜色由玫瑰红色变橙黄时进行传代,至少连续传5代。利用细菌基因组DNA提取试剂盒提取基因组DNA。
1.2.4 对常见的引起呼吸道症状和蛋鸡产蛋下降的致病菌进行PCR鉴定 引物序列见表1。PCR反应体系(总体积 25 μL),其中 2×TaqMaster Mix 为 12.5 μL,上、下游引物各1 μL,模板1 μL,水9.5 μL。反应程序为:94 ℃预变性5 min;94 ℃ 15 s,55℃ 15 s,72℃ 10 s,共35个循环;72℃延伸5 min。PCR 产物用0.8%的琼脂糖凝胶电泳观察结果,送生工生物工程(上海)股份有限公司进行序列测定,测序结果利用NCBI进行序列比对。

表1 引物序列信息Table 1 The sequences of the primers in this study
1.2.5 鸡滑液囊支原体的纯化 取培养好的支原体液体培养菌液100 μL按10倍倍比稀释分别涂布到改良Frey氏固体培养基上,置于37 ℃、体积分数为5% CO2培养箱内,静置培养4 d,显微镜下挑取单菌落至改良Frey氏液体培养基中进行培养。上述操作重复3次。
1.2.6 支原体的形态学观察 取纯化的支原体置于显微镜下观察其形态;并将培养的支原体菌液4 000 r/min离心20 min,取菌体均匀涂于载玻片上,烘烤固定,按照瑞氏-姬姆萨染色方法进行染色,油镜下观察菌体形态。
1.2.7 颜色变化单位(CCU)的测定 取灭菌好的西林瓶12个,每瓶各加3 mL的液体培养基,于第1瓶中加入200 μL待测支原体菌液,混匀,然后按10倍倍比稀释至第12瓶,另做1瓶空白对照。每个做3个重复。置于37℃、体积分数为5%的CO2培养箱中培养,每日观察记录颜色变化,直至变色孔不再增加。将颜色改变的最高稀释度看作1 CCU/mL。
1.2.8 支原体生长曲线的测定 取培养好的鸡滑液囊支原体菌液,按1∶10比例转接至改良Frey氏液体培养基,置于37 ℃、体积分数为5%的CO2培养箱内,此时记做0 h。分别在6 h和12 h取样,12 h后每隔4 h取样至48 h,测定颜色改变单位CCU。
1.2.9 药敏试验 参考石晓磊[20]的方法,测分离菌株对常见的几种抗菌药物的最小抑菌浓度(MIC),判定标准见表2。灭菌后的EP管中加入500 μL抗菌药物浓度为0.5 mg/mL的改良Frey氏液体培养基,倍比稀释至第20管,弃去多余液体,每管加入50 μL待测菌液。每个抗菌药物各3个重复。并设置阴性对照(改良Frey氏液体培养基)和阳性对照(改良Frey氏液体培养基+菌液)。将混匀后的菌液转移至96孔板中,置于37 ℃培养箱内培养,观察颜色变化,记录抑菌浓度。
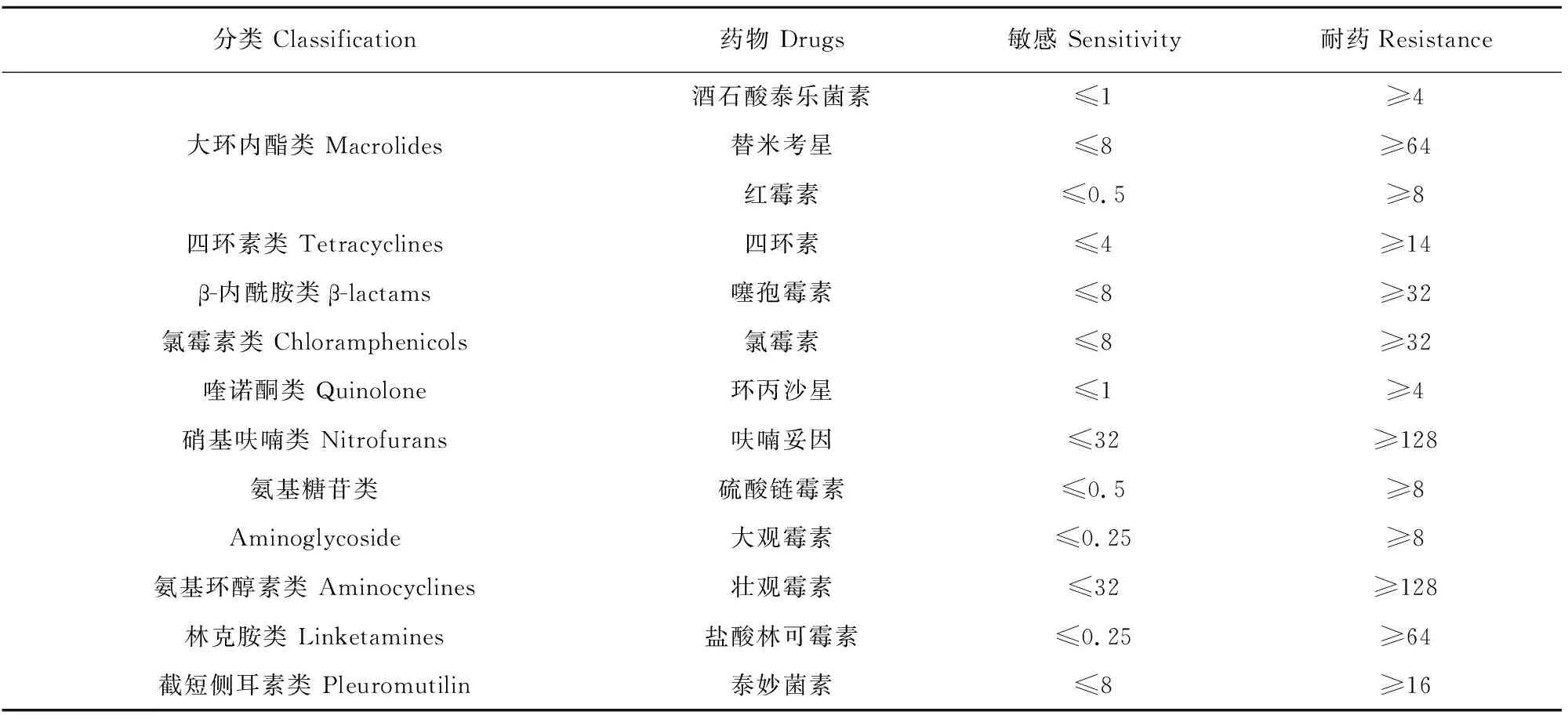
表2 MIC判断标准Table 2 MIC criteria
1.2.10 鸡胚感染试验 选取重量为50~55 g范围内的9日龄SPF鸡胚,接种前蛋壳用酒精和碘伏消毒。试验组取200 μL鸡滑液囊支原体菌液接种6枚SPF鸡胚,空白对照组接种200 μL培养基。鸡胚注射孔处用石蜡封口,置于37 ℃的恒温培养箱内培养,接种后对接种菌液的CCU进行测定确定接种量。每日观察鸡胚状态,第8天将鸡胚进行解剖观察。
2 结果
2.1 病毒、细菌与支原体的分离与鉴定
鸡胚尿囊液的禽流感病毒、新城疫病毒和传染性支气管炎病毒鉴定结果均为阴性;TSA培养基经过夜培养后无菌落生长,故细菌分离鉴定结果也为阴性。接种后的Frey氏液体培养基经3 d培养基颜色由红色转变为黄色,且无沉淀物产生(图1A),表明支原体分离结果为阳性。对支原体分离株进行纯化培养,连续传5~6代后发现生长性能良好,显微镜低倍镜下观察菌落形态为“煎蛋”样(图1B)通过瑞氏-姬姆萨染色,油镜下观察多呈球状体(图1C)。
A.支原体分离株液体培养基培养结果;1.阴性对照;2.阳性对照;3.支原体培养物;B.支原体分离株菌落形态学观察(100×);C.支原体分离株菌落形态学观察(瑞氏-姬姆萨染色,1 000×)A.Results of liquid medium culture of Mycoplasma isolates;1.Negative control;2.Positive control;3.Mycoplasma culture;B.Morphological observation of colony of Mycoplasma isolate(100×);C.Morphological observation of colony of Mycoplasma isolate(Richt-Giemsa staining,1 000×)图1 滑液囊支原体分离株形态学观察Fig.1 Morphological observation of Mycoplasma isolate
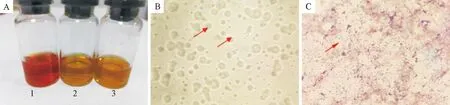
利用PCR对支原体的分离培养物进行鉴定,PCR产物经琼脂糖凝胶电泳显示条带大小为1 465 bp(图2),与预期大小一致。PCR产物测序结果在NCBI上经同源性比对分析发现与已报道的鸡滑液囊支原体16S rRNA的碱基序列同源性高达99%。结果表明分离到的支原体为鸡滑液囊支原体。
M.DNA标准DL 2 000;1~5.疑似菌落;P.阳性对照;N.阴性对照M.DNA Marker DL 2 000;1-5.Suspected colony; P.Positive control; N.Negative control图2 分离菌株PCR鉴定结果Fig.2 PCR identification results of isolate
2.2 CCU和生长曲线测定结果
经过12 d的持续观察,结果显示发生颜色改变的鸡滑液囊支原体培养物的最高稀释度为第8瓶,即颜色改变单位为10-8CCU/mL,所以鸡滑液囊支原体培养物浓度为CCU为108CCU/mL。利用CCU方法测定鸡滑液囊支原体分离株的生长曲线(图3)。结果显示,MS分离株在8~12 h进入对数生长期,在12~28 h处于平台期,28 h后进入衰亡期。

图3 鸡滑液囊支原体生长曲线Fig.3 Growth curve of Mycoplasma synoviae
2.3 鸡胚感染试验结果
在鸡胚感染试验中,CCU测定结果显示接种的滑液囊支原体培养物的CCU为108CCU/mL。试验周期内试验组和空白对照组鸡胚未见死亡,但试验组鸡胚活力有所下降。鸡胚剖检结果(图4)显示,试验组的鸡胚胚体较空白对照组小,并且从胚体中重新分离到鸡滑液囊支原体,表明该MS分离株可导致鸡胚生长缓慢和鸡胚弱小。

图4 鸡胚感染试验结果Fig.4 Results of chicken embryo infection test
2.4 药敏试验
MIC检测结果见表3,结果参照CLSI(美国临床与实验室标准协会,2021)药敏标准进行判定。MS分离株出现多重耐药现象,对四环素、氯霉素、泰妙菌素、盐酸克林霉素、壮观霉素、呋喃妥因敏感,对酒石酸泰乐菌素、红霉素、噻孢霉素、环丙沙星、硫酸链霉素耐受。

表3 药物最小抑菌浓度(MIC)测定结果Table 3 Determination results of minimum inhibitory concentration(MIC)of various drugs μg/mL
3 讨论
鸡滑液囊支原体严重危害我国养禽业发展,病鸡为主要传染源,可水平和垂直传播,传染性高,极难净化[21-22]。因此,支原体的防控净化一直是困扰养鸡业的难题。
鸡滑液囊支原体在临床上主要的检测方法是分离鉴定、血清学方法和生物学方法等[23],其中分离鉴定是检测的金标准,但临床上常与其他细菌性疾病(如葡萄球菌、链球菌引起的关节炎等)混和感染,导致临床死亡率升高和滑液囊支原体的分离率降低[24-25]。在石晓磊[26]的研究中,鸡滑液囊支原体的分离率只有12.1%;隋兆峰等[27]的研究中分离率为34.3%。滑液囊支原体的临床阳性率高,但分离率较低,极大制约了该病的防治。
本文从临床疑似支原体感染病鸡病料未有鉴定到其他病原菌,只成功分离到了支原体。并通过分离纯化、观察菌落形态、染色镜检和16S rRNA扩增鉴定该分离株为鸡滑液囊支原体。表明该病例临床上的呼吸道症状以及产蛋率下降的主要致病原为鸡滑液囊支原体。有相关文献报道了感染了滑液囊支原体的蛋鸡,均表现出产蛋量下降、跛行、关节肿大变形,剖检有黄色干酪样物质等症状和病变[28-29]。此外,王芳等[30]报道了2021年临沂市某蛋鸡场中鸡滑液囊支原体导致鸡群呼吸道症状、爪垫肿胀、跛行和产蛋量下降25%,且恩诺沙星和替米考星联合用药具有良好的治疗效果。李俊等[31]研究发现滑液囊支原体对泰万菌素和泰妙菌素敏感;招丽婵等[32]也发现泰妙菌素、泰万菌素、泰乐菌素及多西环素对MS的治疗效果较好。本文药敏试验结果显示,MS分离株对泰妙菌素敏感,但对泰乐菌素、替米考星等表现出耐药,临床上用药后引起的呼吸道症状和产蛋下降有明显改善。
