肉鸡圆圈病毒3型和A型多杀性巴氏杆菌混合感染的检测与分析
2024-01-29庄丽云雷天宇戴婷婷吴玲玲朱金玲廖悦辰包银莉黄翠琴戴爱玲郑新添
庄丽云,雷天宇,戴婷婷,吴玲玲,朱金玲,廖悦辰,牛 群,包银莉,3,黄翠琴,3,戴爱玲,3,郑新添,3*
(1.福建农林大学动物科学学院,福建福州 350000;2.龙岩学院预防兽医学与生物技术福建省高等学校重点实验室,福建龙岩 364000;3.龙岩学院动物源性人兽共患病防控福建省高校工程研究中心,福建龙岩 364012 )
多杀性巴氏杆菌(Pasteurellamultocida)是一种革兰氏阴性细菌,可以引起包括禽霍乱、牛出血性败血症和猪萎缩性鼻炎[1-2]等疾病,也可引起人的感染。鸡圆圈病毒(Gyrovirus,GyV)是细环病毒科(Anelloviridae)环病毒属(Gyrovirus)的一种单链环状DNA病毒,其与同属的鸡传染性贫血病毒 (Chicken infectious anemia virus,CIAV)均为免疫抑制病毒,鸡圆圈病毒3型(Gyrovirus 3,GyV3)是引发鸡病毒性传染性腺胃炎的主要病原[3-4]。2022年8月,福建省龙岩市某鸡场饲养的58日龄肉鸡出现发育不良、呼吸困难等症状,死亡频次由每天死亡5~10只上升至20~30只;对病鸡进行剖检、实验室诊断和病原学鉴定,确诊其为多杀性巴氏杆菌和鸡圆圈病毒3型的混合感染病例。
1 材料与方法
1.1 材料
1.1.1 病料来源 龙岩市某养鸡场送检4只肉鸡,编号为1~4号,对每只病鸡进行剖检并分别无菌采集肝脏、脾脏、肺脏、气管,腺胃及呼吸道黏膜和肠黏膜。
1.1.2 主要试剂 基因组提取试剂盒FastPure Cell/Tissue DNA Isolation Mini Kit、PCR Mix,诺唯赞生物科技股份有限公司产品;pMD19-T、DNA标准DL 2 000,宝日医生物技术(北京)有限公司产品;革兰氏染色试剂盒,索莱宝科技有限公司产品;微量生化反应管、药敏试纸,杭州滨和微生物试剂有限公司产品。
1.1.3 主要仪器设备 PCR仪、台式高速冷冻离心机、生物安全柜,赛默飞世尔科技公司产品;电泳仪,北京六一生物科技有限公司产品;恒温培养振荡器,苏州捷美电子有限公司产品;光学显微镜,麦克奥迪实业集团有限公司产品。
1.2 方法
1.2.1 引物设计与合成 参照文献[5]设计扩增细菌16SrDNA基因片段的通用检测引物16S-F/R;参照文献[6]设计多杀性巴氏杆菌荚膜基因扩增引物;参照文献[7]设计扩增GyV3VP2基因片段的特异性检测引物,引物信息见表1;引物由生工生物工程(上海)股份有限公司合成。

表1 引物信息Table 1 Primer information
1.2.2 细菌分离与鉴定 取肝脏划线于绵羊血琼脂培养基,37 ℃恒温箱中培养18 h,后进行2次纯化,挑取形态典型的菌落进行革兰氏染色镜检。挑取典型菌落到5%血清肉汤培养基中,37 ℃、200 r/min培养18 h,取纯培养物进行生化反应鉴定,具体操作步骤按照《伯杰氏细菌鉴定手册》第8版方法进行,按说明进行判定。以菌液为模板进行PCR扩增,扩增体系为2×PCR Mix 10 μL,引物16s-f/r 各1μL,模板1 μL,ddH2O补充至20 μL。扩增程序:94 ℃预变性5 min;94 ℃ 40 s,56℃ 30 s,72℃ 45 s,共35个循环;72℃再延伸5 min。将电泳鉴定后的PCR产物切胶进行产物纯化,然后连接至pMD19-T载体并转化到DH5α感受态细胞,在氨苄西林LB培养基上培养15 h。挑取单菌落扩大培养,经PCR鉴定阳性的转化子菌液送往生工生物工程(上海)股份有限公司测序,将测序获得的序列利用BLAST程序进行序列对比。
1.2.3 菌株荚膜分型 挑取单菌落在100 μL ddH2O 中,100 ℃加热10 min煮沸,离心取上清作为模板。参照《禽霍乱(禽巴氏杆菌病)诊断技术》(NY/T 563-2016)[6],巴氏杆菌荚膜分型检测方法进行PCR检测(引物序列见表1)。
1.2.4 药敏试验 将纯化菌液均匀涂布于鲜血琼脂培养基上,在无菌条件下使用Kirby-Bauer( K-B)纸片琼脂扩散法测定病鸡分离菌对常见抗菌药物的耐药性[8]。
1.2.5 GyV3 PCR检测 分别处理每只鸡病料,将肝脏与腺胃研磨并反复冻融3次,9 000 r/m离心10 min,取200 μL上清液,使用FastPure Cell/Tissue DNA Isolation Mini Kit试剂盒提取基因组。以提取的DNA为模板,分别配置25 μL PCR反应体系:2× PCR mix 12.5 μL,引物(GyV3-VP2-F/R)各0.5 μL,模板1 μL,ddH2O 10.5 μL。PCR扩增程序为:95℃ 3 min;95℃ 15 s;58℃ 15 s;72℃ 15 s;共35个循环;72℃ 5 min。取5 μL PCR扩增产物进行1%琼脂糖凝胶电泳检测。
1.2.6VP2基因克隆及序列测定 将电泳鉴定后的PCR产物切胶进行产物纯化,然后连接至pMD19-T载体并转化到DH5α感受态细胞,在氨苄西林LB培养基上培养15 h。挑取单菌落扩大培养,随后使用M13通用测序引物进行PCR鉴定阳性菌落。将鉴定为阳性的转化子菌液送往生工生物工程(上海)股份有限公司测序。
1.2.7 GyV3VP2基因遗传进化分析 将所得序列在NCBI网站进行Blast搜索比对,分析所得序列与GenBank已公布序列的同源性,选取典型GyV3VP2基因序列见表2,使用 MEGA 11.0软件构建系统发育树。

表2 GyV3参考毒株相关信息Table 2 GyV3 reference strain-related information
2 结果
2.1 病鸡剖检结果
剖检可见2号病鸡喉头及气管有出血点(图1A),腹腔有纤维素性渗出,肝脏表面有针尖大小灰白色坏死点(图1B),脾脏肿大且有灰白色坏死点,腺胃有溃疡灶(图1C),回盲瓣有明显出血点。

A.气管出血且有黄色黏液;B.肝脏表面有坏死点;C.腺胃有溃疡灶A.Tracheal bleeding with yellow mucus; B.Necrotic spots on the surface of the liver; C.Ulcer foci in the proventriculus图1 剖检结果Fig.1 Autopsy results
2.2 细菌分离培养与生化鉴定
2号鸡肝脏细菌纯化后细菌在鲜血琼脂培养基呈现圆形、微突起、表面光滑、奶油状的菌落(图2A)。取单菌落进行革兰氏染色,镜检可见革兰氏阴性短杆菌,细菌呈椭圆形,两端颜色较深,中心颜色较浅(图2B);生化鉴定结果见表3,初步判断该细菌为多杀性巴氏杆菌。

A.血平板分离培养的单菌落;B.革兰染色(1 000×)A.Single colony isolated and cultured on blood plate;B.Gram staining(1 000×)图2 细菌形态Fig.2 Morphology of bacteria

表3 分离菌株生化鉴定结果Table 3 Biochemical identification results of the isolated strains
2.3 分离株16S rDNA鉴定
用16S rDNA引物对菌液进行扩增,PCR扩增产物电泳结果见图3。扩增的16S rDNA片段大小为1 500 bp左右(图3),将该片段进行克隆测序,获得1 500 bp序列,将其与GenBank中已有序列进行Blast比对,与巴氏杆菌属16S rDNA的相似度达99.9%以上。

M.DNA标准DL 2 000;1.阳性对照;2.样品;3.阴性对照M.DNA Marker DL 2000; 1.Positive control; 2.Sample 3.Negative control图3 分离菌16S rDNA的PCR扩增结果Fig.3 PCR amplification result of bacterial 16S rDNA
2.4 菌株荚膜分型
使用PCR对分离的巴氏杆菌进行分型,PCR扩增产物电泳结果见图4。结果显示,只有荚膜A型引物可扩增出1 000 bp左右的条带,符合预期的1 044 bp片段大小,并且其他分型均未扩出任何条带,进一步判断分离细菌为A型多杀性巴氏杆菌。
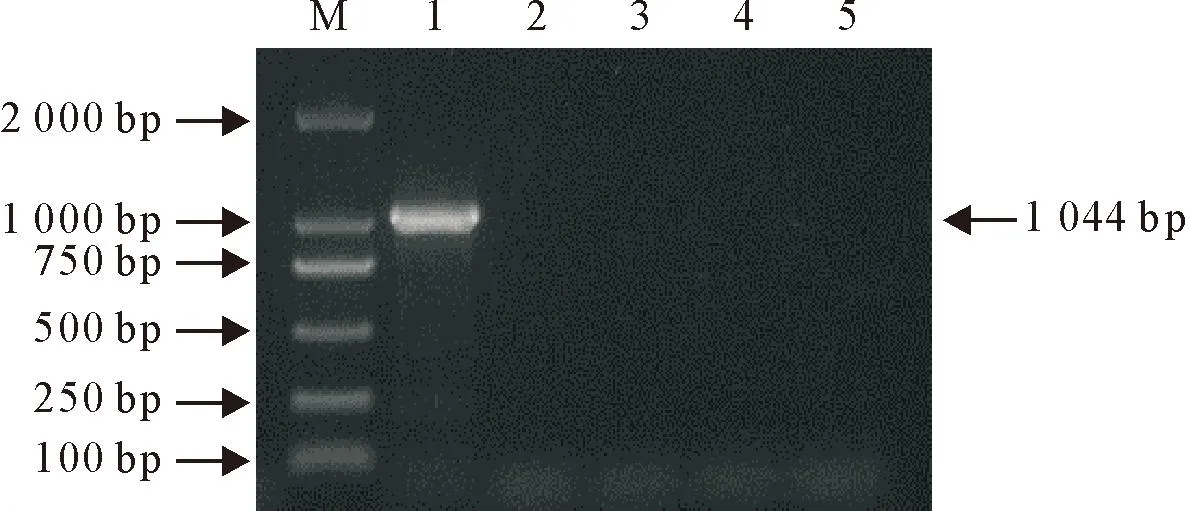
M.DNA标准DL 2 000;1~5.分别对应A、B、D、E、F多杀性巴氏杆菌荚膜分型引物PCR扩增结果M.DNA Marker DL 2000;1-5.Corresponding to A,B,D,E and F Pasteurella multocida capsular typing primer PCR amplification results图4 分离菌荚膜血清型的PCR鉴定结果Fig.4 PCR identification results of serotypes of isolated bacteria
2.5 药敏试验
菌株仅对氨苄西林、头孢唑林、头孢拉定、万古霉素、头孢曲松有耐药性,对哌拉西林、头孢氨苄、头孢他啶、庆大霉素、卡那霉素、新霉素、氧氟沙星、多黏菌素B均表现为高度敏感,对羧苄西林表现为中度敏感(表4)。

表4 药敏试验结果Table 4 Results of drug sensitivity test of isolated bacteria
2.6 GyV3 PCR检测
用GyV3特异性引物进行PCR扩增,2号鸡凝胶电泳结果显示在720 bp左右出现条带(图5),与预期片段大小相符。
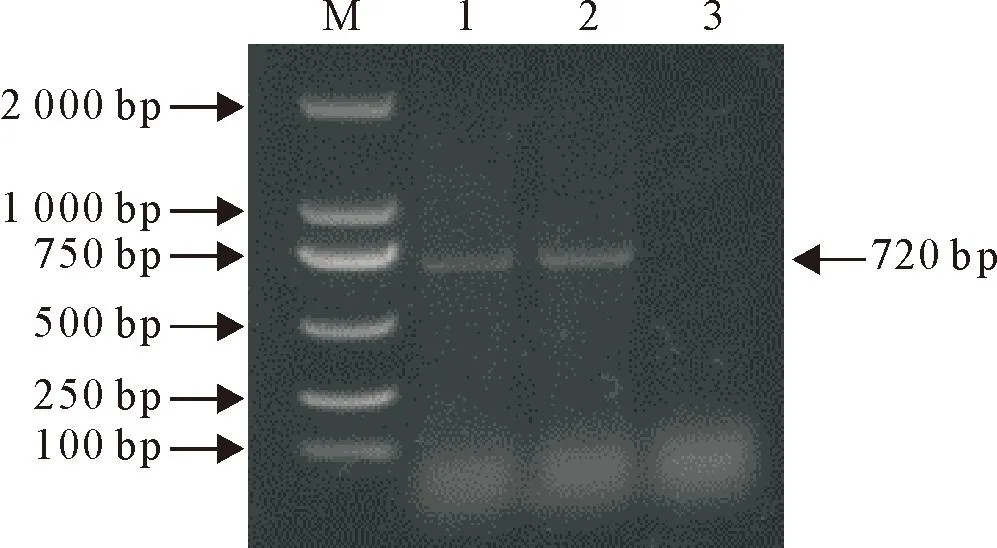
M.DNA标准DL 2 000;1.阳性对照;2.样品;3.阴性对照M.DNA Marker DL 2 000;1.Positive control; 2.Sample;3.Negative control图5 GyV3 VP2扩增结果Fig.5 PCR amplification result of GyV3 VP2
2.7 GyV3 VP2基因遗传进化分析
目的片段测序获得序列720 bp,与GenBank 进行Blast比对,显示与GenBank GyV3VP2基因序列相似度达99.9%以上,命名为LY-GyV3-202201。将测序后VP2基因与16株参考株进行核苷酸比较,利用MEGA 11软件构建进化树,通过进化树分析,LY-GyV3-202201株与长春猫源参考株(登录号MK089248)关系最近,结果见图6。

●LY-GyV3-202201为本试验分离株●LY-GyV3-202201 is the isolate of this test图6 基于VP2基因的系统进化树Fig.6 Phylogenetic tree based on VP2 gene
3 讨论
近年来,鸡传染性病毒性腺胃炎(Transmissible virus proventriculitis,TVP)发病率呈上升趋势,造成了鸡场严重损失。TVP的病原较为复杂[9],也给诊断和防控带来困难。根据临床症状和大体剖检判断,该病鸡表现出典型的TVP症状,为明确病原,对病鸡进行了鸡圆圈病毒、J亚型禽白血病毒、鸡传染性贫血病毒、马立克病病毒、腺胃坏死病毒、呼肠孤病毒、传染性法氏囊病病毒、传染性支气管炎病毒、网状内皮组织增生病毒检测,结果显示,病鸡中仅检测出GyV3,其他均为阴性;此外,还从病例中检测出多杀性巴氏杆菌,由此,该病例诊断为GyV3和A型多杀性巴氏杆菌共感染。选择较为敏感的庆大霉素进行治疗后,鸡群死亡率下降,新增病例减少,该鸡场病情得到了有效控制,进一步证实该病例中多杀性巴氏杆菌是其主要病原之一,然而由于条件限制,未能进一步对GyV3进行回归试验。GyV3感染并且导致TVP相关报道较少,本研究通过临床剖检、实验室诊断以及遗传进化分析,为GyV3的理论研究和流行病学调查提供了数据参考。
通过遗传进化分析,本次分离株与猫源参考株亲缘关系更近,文献表明在家猫粪便中也曾检测出其他环状病毒[10-11],由于鸡肉是家猫食物的主要来源,这些不同的猫源性环状病毒可能起源于携带环状病毒的鸡肉产品。研究表明GyV3是一种造成再生障碍性贫血、免疫抑制和多系统严重损伤的跨物种致病病毒[12],GyV3作为一种免疫抑制性病毒可以侵害家禽的免疫系统,导致机体更容易出现其他病原的并发或继发感染,并且GyV3是近年来在鸡群发现的新病毒,尚无特异性疫苗预防。多杀性巴氏杆菌是一种常见的共生或机会性病原体,可在大多数家禽、家畜和野生动物的上呼吸道中发现,包括鸡[13]、牛[14]和野生水禽[15]等。龙岩市8月份天气炎热多雨,高温高湿环境给细菌滋生提供良好条件,早晚温差较大致使机体抵抗力下降,最终导致病毒与细菌并发感染。本试验分离的巴氏杆菌为荚膜A型,该血清型与禽霍乱相关菌株的疾病倾向高度相关[16],且近年来在福建地区较为流行[17]。由于巴氏杆菌血清型分类较多,各血清型之间缺乏交叉保护力,因此使用疫苗防控较为困难,临床上推荐使用抗菌药物来防控。本试验结果显示,分离菌对哌拉西林、头孢氨苄、庆大霉素等8种药物表现敏感,推荐使用卡那霉素、庆大霉素等抗革兰氏阴性菌药物,做到轮换用药、缩短用药周期,防止细菌产生耐药性。鸡场应加强饲养管理,及时用药,尤其在高温或天气多变时节改善舍内环境,降低密度,增强鸡群免疫力。
传染性腺胃炎是鸡群常见疾病之一,其病原学和致病机制尚未清楚,本研究对发病鸡进行病原学检测和鉴定,证实发病鸡存在鸡圆圈病毒3型和A型多杀性巴氏杆菌感染,为传染性腺胃炎的病原学及防控研究提供了试验依据。
