小鼠亚慢性伏马毒素B1中毒对血液生化指标的影响及组织病理变化的观察
2024-01-29李若彬朱庆阁黎晓雯曹嫦妤
李若彬,朱庆阁,黎晓雯,王 凯,刘 阳,曹嫦妤*
(1.佛山科学技术学院生命科学与工程学院/佛山科学技术学院附属教学动物医院,广东佛山 528231;2.佛山科学技术学院食品科学与工程学院/全国名特优新农产品全程质量控制技术佛山中心(CAQS-GAP-KZZX043)/广东省食品智能制造重点实验室,广东佛山 528231)
伏马毒素(fumonisin)是由串珠镰刀菌、轮状镰刀菌等在适宜的温度和湿度条件下产生的一种次级代谢产物。目前已发现A、B、C、P四大类共28种伏马毒素,其中FB1、FB2、FB3最为常见,其中又属伏马毒素B1(fumonisin B1,FB1)含量最高、毒性最强、污染最为严重[1]。其热稳定性好,污染范围广泛,已成为危害畜禽健康的重要因素。伏马毒素可引起人类食管癌和神经管型缺陷病、马与兔的脑组织损伤、灵长类动物动脉粥样硬化、猪肺水肿等[2]。灌胃含3 mg/kg FB1饲料连续5 d即可造成大鼠急性肝损伤和增加肝脏的相对重量[3]。目前世界各国相继发布了对伏马毒素限量标准,美国食品与药品监督管理局规定,用于人食用的玉米制品中伏马毒素含量不得超过2 mg/kg,我国实行的《饲料卫生标准规定》指出玉米类饲料原料伏马毒素(FB1+FB2)限量60 mg/kg,但在浓缩饲料及精料补充料中,猪、兔和马小于5 mg/kg[4]。因此,本试验采取5 mg/kg FB1进行研究。目前,对FB1单一作用在同一种动物各器官组织上产生的毒理学效应研究较少。因此,本文采取对小鼠使用FB1染毒,结合各个组织器官的病理变化、器官系数与生化数据分析,为探究FB1对生物个体各组织器官影响与危害提供相关依据。
1 材料与方法
1.1 材料
1.1.1 饲料及实验动物 含FB1玉米,百奥明饲料添加剂(中国)有限公司产品;FB1的提取和定量参考黎晓雯等[5-6];雄性昆明小鼠、C组与FB1组饲料,购自广东省实验动物中心。
1.1.2 主要试剂与仪器 苏木素伊红染料试剂盒,北京索莱宝科技有限公司产品;石蜡包埋机与切片机,浙江科迪仪器设备有限公司产品;电子天平,武汉艾德姆衡器有限公司产品;冷藏冰箱,博西华家用电器有限公司产品;兽用全自动血液细胞分析仪与全自动生化分析仪,迈瑞公司产品。
1.2 方法
1.2.1 动物分组与试验设计 采用40只4周龄雄性昆明小鼠,平均体重为18.48 g±1.47 g,试验前适应性饲养1周,光照设为12 h明暗循环,室内温度为22℃±2℃,湿度为55%±5%,期间提供标准基础饲料,自由饮水。适应饲养结束后建立试验模型,随机分为2组(n=20只),对照组(C组)饲喂标准基础饲料,伏马毒素组(FB1组)饲喂5 mg/kg FB1混合基础饲料。每天定时观察小鼠饮食、临床表现、体重等情况,连续饲喂42 d。在21 d和42 d时,每组随机选取10只小鼠,麻醉后对小鼠眼球采血,用于血常规和生化检测;冰上剖检采集大脑、小脑、脑干、心脏、肝脏、肾脏、肺脏、脾脏和肠道后称重,用于脏器系数测定;部分脏器于4%甲醛溶液中固定用于制作病理切片,部分置于低温冰箱保存备用。
1.2.2 血常规与血清生化测定 使用全自动血液细胞分析仪检测小鼠血液血常规;采用全自动生化分析仪测定小鼠血清生化指标,具体指标如下:丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷氨酰基转移酶(glutamyl transferase,GGT)、肌酐(creatinine,CRE)、尿素氮(urea nitrogen,BUN)、尿酸(uric acid,UA)、羟丁酸脱氢酶(hydroxybutyrate dehydrogenase,HBDH)、肌酸激酶(creatine kinase,CK)、肌酸激酶-MB同工酶(creatine kinase-MB isoenzyme,CK-MB)、乳酸脱氢酶(lactate dehydrogenase,LDH)、电解质(Ca2+、K+、P3-、CL-、Mg2+、Na+、HCO3-)。
1.2.3 器官系数测定 称重完成的各器官根据公式计算脏器系数,器官系数(mg/g)=脏器重量/体重。
1.2.4 病理切片制作与观察 采集的器官依次进行洗涤、脱水透明、浸蜡包埋、脱蜡及复水化、HE染色,光学显微镜下观察切片,标出各器官的病变类型。
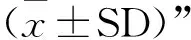
2 结果
2.1 FB1染毒后对小鼠体重的影响
FB1染毒小鼠后,小鼠体重变化见表1,与C组相比,FB1组在整个试验过程中体重无显著性差异。

表1 FB1对小鼠体重的影响Table 1 Effect of FB1 on the body weight of mice
2.2 FB1染毒后对小鼠器官系数的影响
FB1染毒小鼠后,小鼠器官系数变化见表2,与21 d C组相比,21 d FB1组肝脏、心脏器官系数显著下降(P<0.05);与42 d C组相比,42 d FB1组大脑、肾脏器官系数显著下降(P<0.05),其他脏器系数无显著性变化。

表2 FB1对小鼠器官系数的影响Table 2 Effect of FB1 on mouse organ coefficients mg/g
2.3 FB1染毒后对小鼠血清生化指标的影响
FB1染毒小鼠后,血清生化指标变化见表3,与C组相比,21 d和42 d FB1组小鼠血清GGT、ALT、AST含量均显著升高(P<0.05);与21 d C组相比,21 d FB1组小鼠血清BUN与UA含量均显著下降(P<0.05),与42 d C组相比,42 d FB1小鼠血清UA含量显著下降(P<0.05);与21 d C组相比,21 d FB1组小鼠血清CK含量显著升高(P<0.05)。

表3 FB1对小鼠血清生化指标的影响Table 3 Effect of FB1 on serum biochemical indexes of mice
2.4 FB1染毒后对小鼠血清电解质的影响
FB1染毒小鼠后,血清电解质变化见表4,与21 d C组相比,21 d FB1组小鼠血清Mg2+与Na+含量显著降低(P<0.05)。与42 d C组相比,42 d FB1组小鼠血清Ca2+、K+、Cl-含量显著升高(P<0.05),血清Na+、HCO3-含量显著降低(P<0.05)。

表4 FB1对小鼠血清电解质的影响Table 4 Effect of FB1 on serum electrolytes in mice
2.5 FB1染毒后对小鼠血液常规指标的影响
FB1染毒小鼠后,血液血常规变化结果见表5,与21 d C组相比,21 d FB1组中,白细胞计数(white blood cells count,WBC)、红细胞计数(red blood cell count,RBC)、红细胞压积(hematocrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV)、平均血小板体积(mean platelet volume,MPV)、血红蛋白浓度(hemoglobin concentration,HGB)含量显著降低(P<0.05),平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)、血小板计数(platelet count,PLT)、血小板压积(hematocrit,PCT)含量显著升高(P<0.05);与42 d C组相比,42 d FB1组中,HCT、MCV、MPV、中性粒细胞百分比(percentage of neutrophils,NE%)含量显著降低(P<0.05),MCHC、PLT含量显著升高(P<0.05)。

表5 FB1对小鼠血常规的影响Table 5 Effect of FB1 on blood routine test in mice
2.6 小鼠染毒后病理切片观察
FB1染毒后,小鼠各组织脏器都表现出一定的病理学变化。
2.6.1 肝脏 C组肝细胞形态正常,细胞分布排列有序,无炎症细胞浸润。染毒小鼠21 d主要病变为肝细胞分布杂乱,细胞肿胀,脂肪变性,有大量脂肪空泡,其数量多,面积大。42 d主要病变为细胞排列更杂乱,脂肪空泡数量更多且面积更大,出现肝细胞坏死灶,且坏死灶外围有炎性细胞浸润(图1A~D)。
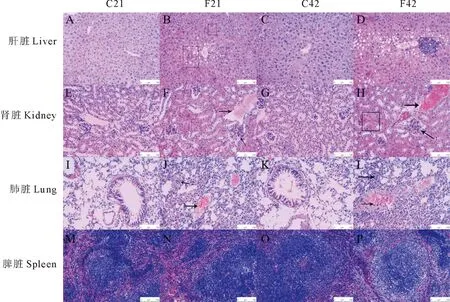
图1 FB1染毒后小鼠肝、肾、肺、脾病理组织学变化(HE,200×;标尺为100 μm)Fig.1 Histopathological lesions of liver,kidney,lung and spleen in mice after FB1 exposure (HE,200×;Bar is 100 μm)
2.6.2 肾脏 C组肾组织结构正常,肾小球结构清晰,肾小管排列紧致,结构完整。染毒小鼠21 d主要病变为肾小球结构变大且模糊,肾小管细胞排列紊乱,细胞间隙增大,肾小管上皮细胞变性肿胀且出现坏死、脱落;伴有淤血现象。42 d主要病变肾小球结构模糊,肾小管细胞排列紊乱,肾小管上皮细胞变性肿胀,上皮细胞坏死、脱落更明显;淤血现象更严重[7](图1E~H)。
2.6.3 肺脏 C组肺泡形态正常,细胞边界清晰,细支气管与肺泡结构完整,染毒小鼠21 d主要病变为肺泡细胞杂乱无章,伴有炎性细胞浸润,肺泡腔充血。42 d主要病变为肺泡细胞排列更为凌乱,炎性细胞浸润更加严重,肺泡腔充血更加明显[8](图1I~L)。
2.6.4 脾脏 C组实质内白髓区,红髓区染色对比清晰,固有结构完整。染毒小鼠脾脏细胞与C组形态结构无明显差异,病变不明显(图1M~P)。
2.6.5 大脑 C组神经细胞形态正常,排列有序,神经元结构完整。染毒小鼠大脑主要病变为细胞形态异常,排列杂乱,出现神经元固缩,伴有嗜神经元现象与卫星现象(图2A~D)。
图2 FB1染毒后小鼠脑与心脏病理组织学变化(HE,200×;标尺为100 μm)Fig.2 Histopathological lesions of brain and heart in mice exposed to FB1 (HE,200×;Bar is 100 μm)
2.6.6 脑干 C组神经细胞形态正常,神经元结构完整。染毒小鼠脑干的病变与大脑相似,也存在神经元固缩与神经元现象、卫星现象(图2E~H)。
2.6.7 小脑 C组浦肯野细胞形态正常,结构完整。染毒小鼠主要病变为浦肯野细胞变性(图2I~L)。
2.6.8 心脏 心肌细胞病变不明显(图2N、P)。
2.6.9 十二指肠 C组肠绒毛结构完整,固有层细胞形态正常。染毒小鼠21 d主要病变为肠绒毛部分脱落不完整,固有层与上皮层有部分炎性细胞浸润;42 d绒毛脱落更加严重,固有层炎性细胞浸润严重(图3A~D)。

图3 FB1染毒后小鼠肠道病理组织学变化(HE,400×;标尺为50 μm)Fig.3 Lesions of intestinal histopathology in mice exposed to FB1(HE,400×;Bar is 50 μm)
2.6.10 回肠 C组肠绒毛结构完整,固有层细胞形态正常。染毒小鼠21 d主要病变为固有层部分炎性细胞浸润;42 d肠绒毛脱落较严重,固有层炎性细胞浸润严重(图3E~H)。
2.6.11 盲肠 C组肠绒毛结构完整,固有层细胞形态正常。染毒小鼠21 d主要病变为肠绒毛部分脱落不完整,固有层与上皮层有部分炎性细胞浸润;42 d绒毛脱落更加严重,固有层炎性细胞浸润严重(图3I~L)。
2.6.12 结肠 C组肠绒毛结构完整,固有层细胞形态正常。染毒小鼠21 d主要病变为固有层与上皮层有部分炎性细胞浸润,杯状细胞数量增加;42 d固有层炎性细胞浸润更严重(图3M~P)。
3 讨论
在亚慢性毒性试验过程中,实验动物器官受到毒理作用后会发生病理性改变,其表现往往体现于器官的重量变化。脏器系数增大,表示脏器存在充血、水肿或增生肥大等现象;脏器系数减小,表示脏器萎缩及其他退行性改变。从本试验结果可以得出,在染毒前期,FB1组与C组相比心脏与肝脏的器官系数明显减小,在染毒后期,大脑与肾脏的器官系数明显减小。上述变化与文献报道一致[9],说明FB1对小鼠心脏、肝脏、大脑、肾脏具有明显的毒理作用且这些器官可能存在萎缩或退行性变化。
FB1对动物危害最严重的靶器官是肝脏和肾脏。血清中ALT、AST、GGT含量是肝功能的标志酶,当肝细胞膜受损或细胞坏死时,血清中这些酶的含量会有上升趋势,因此检测血清中上述酶的含量有助于判断机体肝细胞的损害程度[10]。从本试验结果可以得出,随着试验时间延长,与C组相比,FB1组小鼠血清中AST、GGT、ALT含量显著增加,提示5 mg/kg FB1可对小鼠肝脏造成明显损伤。
肾脏是动物机体内外毒素的主要排泄器官,BUN是动物机体蛋白质的代谢产物,当肾实质受损,肾小球滤过率降低,血清中BUN、CRE浓度便会增加,因此检测血清中BUN、CRE含量可初步了解动物机体肾脏功能的变化[11]。UA是嘌呤代谢的终末产物,主要经肾脏排泄,血清UA含量能够反映肾脏功能。从本试验可以看出,在染毒前期,FB1组与C组相比,小鼠血清中BUN、UA含量明显降低,在染毒后期,小鼠血清中UA含量明显降低,但血清中BUN、UA含量的降低对于本试验并没有参考价值,提示5 mg/kg FB1对小鼠肾脏造成的损伤还不足以引起小鼠血清中肾指标升高。
CK是心肌中重要的能量调节酶,CK-MB是CK的同工酶,主要存在于心肌中,心肌受损时在血清中出现,持续时间短,是心肌受损的早期诊断指标[12]。从本试验结果可以看出,在染毒前期,FB1组与C组相比小鼠血清中CK含量显著升高,表明5 mg/kg FB1对小鼠心肌造成了较为明显的损伤。
电解质广泛分布于细胞内外,参与体内众多功能和代谢活动,对正常生命的维持具有至关重要的作用。全身性病理过程都可能会引起电解质代谢紊乱。从本试验结果可以看出,在染毒前期,FB1组与C组相比小鼠血清中Mg2+、Na+含量显著降低,在染毒后期,Ca2+、K+、Cl-含量显著升高,Na+、HCO3-含量显著降低。表明5 mg/kg FB1严重破坏了小鼠电解质平衡。
机体各器官与组织的物质交换大多数都是通过血液循环完成,血液循环还具有调节与防御功能,当机体受到外界不良刺激时,血液中的物质成分与血细胞的理化性质会发生改变从而导致机体出现不同程度的生理或病理变化,严重还会导致机体组织与器官损伤[13]。从本试验血常规结果可以看出,在染毒前期,FB1组与C组相比小鼠血液中的WBC、RBC、HCT、MCV、MPV、HGB含量显著降低,MCHC、PLT、PCT含量显著升高;在染毒后期,FB1组与C组相比小鼠血液中的HCT、MCV、MPV含量显著降低,MCHC、PLT含量显著升高。提示5 mg/kg FB1对小鼠机体造成了一定程度损伤。
组织器官病理切片能够在微观层面上体现机体各器官的病理变化情况。作为生物体重要的消化器官,肠道拥有数量庞大的肠道菌群并存在大量的免疫细胞,因此,肠道也被认为是生物体重要的内分泌及免疫器官[14]。从结果可以得出,FB1组相较于C组,各主要器官都有一定程度的病变,其中肾脏、肺脏、肝脏较为明显,大脑、小脑、脑干、脾脏也都表现出相应的病变特征,肠道普遍存在炎症现象。FB1染毒小鼠45 d后,影响了小鼠的生长状态和血液学指标,促使肝、脾和肾脏损伤[15]。与前人研究相似,本试验使用5 mg/kg FB1染毒小鼠也可使小鼠机体各组织器官产生毒理效应,造成病理损伤。
结果表明,5 mg/kg FB1染毒对小鼠血液生化指标产生不利影响,并且对小鼠各组织器官具有一定损伤,可为探究FB1对生物个体各组织器官的影响与危害提供相关依据。
