脱氢乙酸钠对不同性别Wistar大鼠凝血功能的影响
2024-01-29毕思才肖宜容王存凯张雨梅
毕思才,肖宜容,王存凯,张 媛,江 雅,陈 新,2,张雨梅,2*
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
脱氢乙酸钠(sodium dehydroacetate,S-DHA)是一种广泛用于动物食品、药品、饲料和化妆品等中的防腐剂,可以有效抑制细菌、真菌和酵母菌的生长[1-2]。有效抑菌浓度为0.01%~0.2%。我国食品安全国家标准食品添加剂使用标准(GB2760-2019)中规定食品中的添加量最高为0.05%。S-DHA的防霉效果比常用的有机酸防霉剂丙酸、山梨酸等效果更好,能显著抑制饲料发酵过程中大肠埃希氏菌、青霉菌和酵母菌的繁殖[3-4]。尽管S-DHA被美国食品和药物管理局(FDA)指定为“公认安全使用物质”(generally recognized as safe,GRAS),但至今尚未确定人可接受的每日摄入量[5]。有研究发现,饲料中添加0.2% S-DHA会影响仔猪的抗氧化能力[6];高剂量S-DHA会诱导大鼠肝细胞发生严重的脂质过氧化和细胞损伤[7];长期给予S-DHA会导致大鼠多个器官严重出血[8]。
维生素K是肝脏合成维生素K依赖凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ所必需的物质。在γ-谷氨酸羧化酶(gamma-glutamyl carboxylase,GGCX)催化下,凝血酶原前体蛋白末端谷氨酸(glutamate residues,Glu)残基γ-羧基化为γ-羧基谷氨酸(gamma-carboxyglutamate,Gla),使维生素K依赖性凝血因子的非活性前体蛋白转化为活性形式,从而引起凝血的发生[9-11]。华法林是人医临床常用的一种抗凝血药,是具有双香豆素结构(4-羟基-2-吡喃酮)的维生素K拮抗剂,可诱导维生素K缺乏抗凝血或引起出血[12-13]。而S-DHA的主要结构为2,4-吡喃二酮钠,与华法林结构相似[14]。从化学结构方面,推测S-DHA可能具有华法林相似的抗凝血作用。通过诱导维生素K缺乏引起大鼠凝血功能障碍。
凝血酶原时间(prothrombin time,PT)和活化部分凝血活酶时间(activated partial thromboplastin time,APTT)是评价凝血功能的常用指标,分别反映外源和内源凝血系统功能状况。目前关于S-DHA对凝血功能的影响及其风险评估资料较少,因此本研究以Wistar大鼠为试验动物,给予不同剂量S-DHA后,在不同时间检测凝血指标PT、APTT及血液中维生素K水平,以及S-DHA血药浓度,了解防腐剂S-DHA对大鼠凝血功能的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠(170~200 g),雌雄各50只,购自扬州大学比较医学中心。
1.1.2 试剂 S-DHA(纯度>99.0%),Sigma Aldrich公司产品;大鼠维生素K1(VK1)ELISA试剂盒,上海通蔚实业有限公司产品;大鼠PT和APTT检测试剂盒,上海太阳生物技术有限公司产品。
1.1.3 仪器设备 全自动酶联免疫检测仪,美国Bio-Tek公司产品;Coatron M4全自动血凝分析仪,德国TECO医疗仪器公司产品;1200 HPLC仪、C18色谱柱,Agilent公司产品。
1.2 方法
1.2.1 大鼠分组 大鼠随机被分为5组,分别为50、100、150、200 mg/kg S-DHA剂量组和对照组,对照组仅给予生理盐水。每天灌胃1次,灌胃体积为5 mL/kg,连续13 d。环境温度为22 ℃,相对湿度为40%~60%。自由进食和饮水。
1.2.2 大鼠体重及饲料消耗监测 在第1、3、7、10、13天对大鼠逐只称重,并在第3、7、13天计算当天饲料消耗量。
1.2.3 PT/APTT测定 在第3、5、7、9、11、13天时,从大鼠眼眶后静脉丛采血,并立即与柠檬酸三钠以9∶1的比例混合,于4 ℃、3 000 r/min离心15 min后分离血浆,按试剂盒说明书进行PT和APTT的测定。
1.2.4 血清维生素K1的测定 在第5、7、9、11、13天时,从大鼠眼眶后静脉丛采血,室温凝固后于4 ℃、3 000 r/min离心15 min,分离血清,按试剂盒说明书测定血清维生素K1水平,检测限为0.1 ng/L。
1.2.5 S-DHA的血药浓度 用高效液相色谱法测定血清中S-DHA浓度,具体方法如下[15]:在第3、5、7、9、11、13 d从大鼠眼眶后静脉丛采血,置于用肝素浸润的离心管中,3 500 r/min离心5 min,分离血浆,准确吸取100 μL血浆样品于1.5 mL离心管中,加入40 μL乙酸、300 μL乙腈,涡旋3 min,超声振荡10 min,12 000 r/min离心15 min,将上清转移至2 mL离心管,残渣加入300 μL乙腈,超声振荡、离心重复提取1次,合并上清后氮气吹干。残渣用1 mL流动相复溶,样品溶液过0.22 μm有机系滤膜,稀释适当倍数后用高效液相色谱仪检测。HPLC条件如下:色谱柱:Agilent C18,4.6×250 mm,5 μm;流动相:甲醇-0.02 mol/L乙酸铵(pH 4.0~4.5)(35∶65,v/v);检测波长:293 nm;进样量:20 μL;流速:1.0 mL/min;柱温:35℃。外标标准曲线法计算血清中S-DHA含量。
采用Pearson检验进行相关性分析。
2 结果
2.1 S-DHA对大鼠体重及饲料消耗的影响
在整个试验过程中大鼠未出现明显异常及死亡现象。不同剂量S-DHA给药后大鼠体重和摄食量的变化见图1和图2。S-DHA对雌性大鼠体重的影响比雄性更大。在雌性大鼠中,与对照组相比,150、200 mg/kg剂量组在给药后3 d体重明显下降(P<0.05);50、100 mg/kg剂量组体重在7 d后显著降低 (P<0.05)。150和200 mg/kg剂量组雌性大鼠在整个试验时间内体重增长均为负,100 mg/kg剂量组在10 d后出现负增重,但50 mg/kg剂量组雌性大鼠在整个试验期间均未出现负增重。在雄性大鼠中,200 mg/kg剂量组体重在给药3 d后显著低于对照组(P<0.05);100、150 mg/kg剂量组体重在给药10 d后显著降低(P< 0.05);50 mg/kg剂量组体重在整个试验过程中均未观察到显著差异(P>0.05)。此外,4个剂量组雌性大鼠总增重均明显低于对照组,雄性大鼠总增重仅在100、150、200 mg/kg剂量组显著低于对照组(P<0.05)。
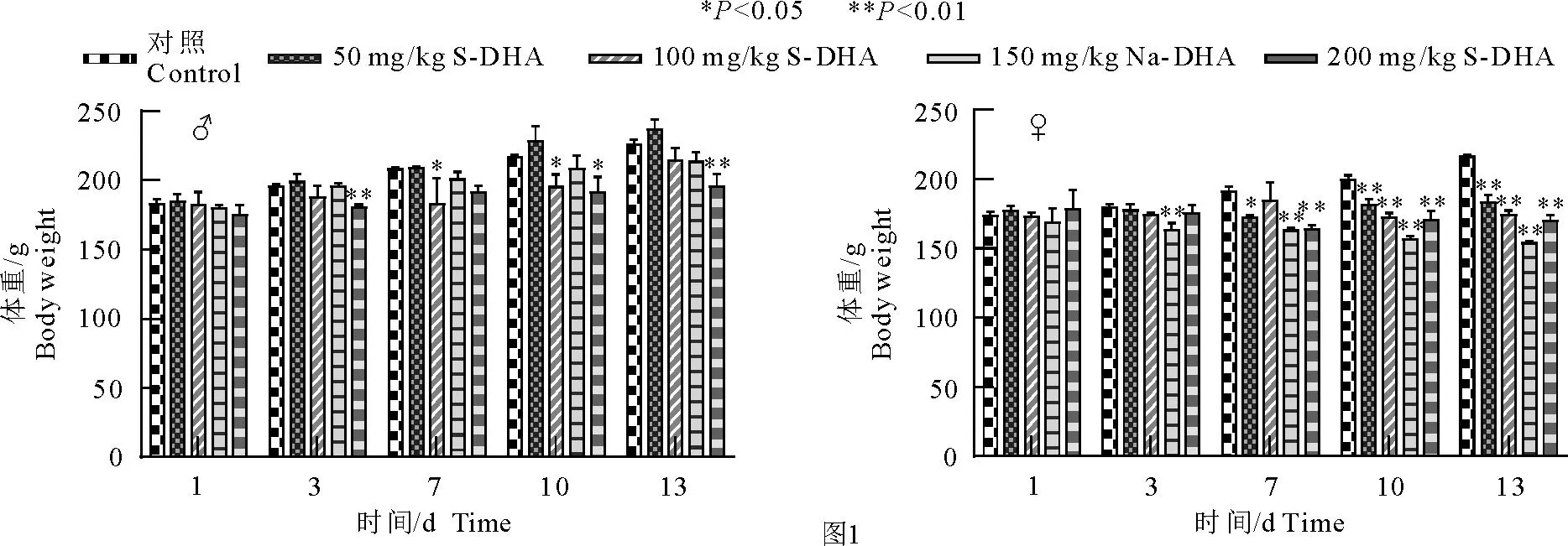
图1 大鼠体重情况Fig.1 Body weight of rats

图2 大鼠饲料消耗情况Fig.2 Feed consumption of rats
给药后的7 d内,观察到雌性大鼠的饲料消耗量显著减少。第7天时,50~200 mg/kg剂量组的饲料摄取量与对照组相比差异显著(P<0.05),且200 mg/kg剂量组的饲料摄取量显著低于50、100、150 mg/kg剂量组,50、100、150 mg/kg剂量组之间差异不显著。第13天时,50~200 mg/kg剂量组雌性大鼠的摄食量均显著低于对照组(P<0.05),4个组间差异不显著。50、100、150和200 mg/kg剂量组雄性大鼠给药7 d后的饲料消耗量较对照组显著降低(P<0.05)。
2.2 S-DHA对大鼠PT/APTT的影响
S-DHA对大鼠PT和APTT的影响如图3所示,50、100、150、200 mg/kg剂量组大鼠在给药后各时间点PT和APTT均显著延长(P<0.05)。但PT增长在雌雄大鼠之间无明显差异(P>0.05)。200 mg/kg剂量组雄性大鼠在给药后5~7 d APTT为200~300 s,较同剂量组雌性大鼠APTT(130~150 s)长,9~15 d APTT下降,维持在130~160 s。在单个时间点,雌性大鼠APTT随剂量增加而增长,且任一剂量组都随时间增加而增长,表明APTT在雌性大鼠中有明显的剂量效应和时间效应关系。
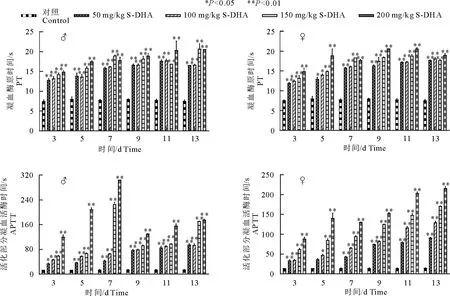
图3 S-DHA对大鼠PT和APTT的影响Fig.3 Effects of S-DHA on PT and APTT in rats
2.3 S-DHA对大鼠血清维生素K1水平的影响
在0.75~6.00 ng/L浓度下,维生素K1的标准曲线为y=0.885 3x+0.014 9,其中y为OD450 nm值,x为维生素K1浓度(ng/L);相关系数(R2)为0.998 98。S-DHA给药后大鼠血清中维生素K1的水平如图4所示,在不同时间点,雄性大鼠和雌性大鼠血清维生素K1水平与正常组相比均显著降低,但二者之间无统计学差异。

图4 S-DHA对大鼠血清VK1水平的影响Fig.4 Effect of serum S-DHA on VK1 levels in rats
2.4 血清药动学
大鼠给药S-DHA后血清S-DHA浓度变化如图5所示。在第7~13天,雄性大鼠200 mg/kg剂量组的S-DHA浓度为28~36 mg/L,150 mg/kg剂量组的S-DHA浓度为18~28 mg/L,而相对应的雌性大鼠血清中S-DHA浓度分别为33~55 mg/L和27~39 mg/L。除50 mg/kg剂量组外,100~200 mg/kg剂量组的雄性大鼠和雌性大鼠血清S-DHA浓度存在显著差异(P<0.05)。
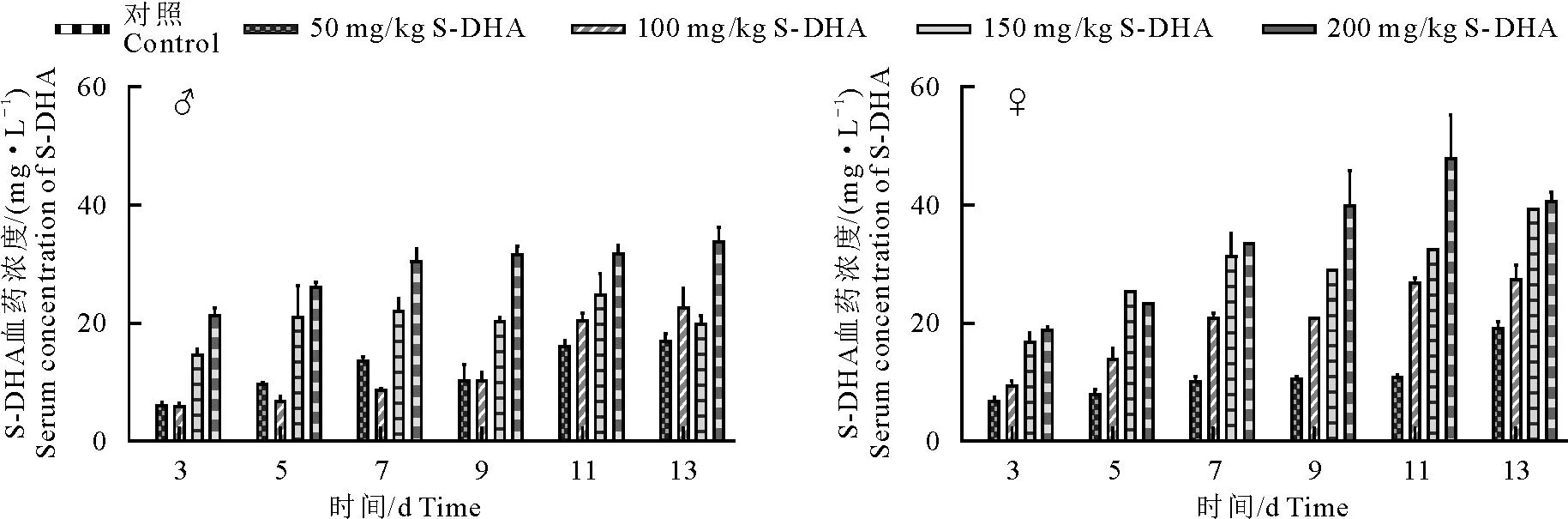
图5 S-DHA在大鼠体内的血药浓度Fig.5 Serum concentrations of S-DHA in rats
2.5 相关性分析
大鼠血清S-DHA浓度与APTT和PT的相关性分析结果如图6所示。雄性大鼠血清S-DHA浓度与APTT和PT的相关系数R分别为0.732(P=0.000)和0.764(P=0.000),雌性大鼠血清S-DHA浓度与APTT和PT的相关系数R分别为0.923(P=0.000)和0.806(P=0.000)。

图6 血清S-DHA浓度与APTT和PT的相关性分析Fig.6 Correlation analysis between serum S-DHA concentration and APTT and PT
雄性大鼠血清维生素K1与APTT和PT的相关系数R分别为-0.130(P=0.608)和-0.268(P=0.283)。雌性大鼠血清维生素K1与APTT和PT的相关系数R分别为-0.102(P=0.686)和-0.229(P=0.360)。血清S-DHA浓度与维生素K1浓度无相关性。
3 讨论
为研究S-DHA对Wistar大鼠的抗凝作用,试验设定了50、100、150、200 mg/kg 4个剂量组,连续13 d对大鼠灌胃给药。在整个试验过程中,各个剂量组雌性大鼠体重均显著低于正常组(P<0.01),而在雄性大鼠中仅100、150、200 mg/kg剂量组的平均体重低于对照组。在整个试验期间同一剂量组的雄性大鼠体重随着给药时间延长逐渐增加,而100、150、200 mg/kg剂量组的雌性大鼠在试验期间体重出现了负增长,这表明S-DHA对雌性大鼠体重的影响更大。
PT是凝血酶原活化时间,提示先天或后天凝血酶原、纤维蛋白原和凝血因子的水平。APTT 是活化部分凝血活酶时间,与内在接触激活途径中的因子有关,APTT延长反映了接触因子或因子Ⅷ、Ⅳ和Ⅺ的缺乏。在整个试验期间的任一时间点,随着S-DHA剂量的增加,雌雄大鼠PT和APTT均逐渐增长,表现出明显的剂量效应关系。此外,雄性大鼠PT和雌性大鼠APTT均表现出时间效应关系,即随着给药时间的增长,同一剂量组的雄性大鼠PT和雌性大鼠的APTT均增长。雄性大鼠APTT和雌性大鼠PT则是随着给药时间延长先增长后缩短。整体来说,雌、雄大鼠PT增长无显著差异,但雌性大鼠APTT显著高于雄性大鼠。
维生素K在凝血过程中起着关键作用[16]。已有研究发现,维生素K可明显改善出生早期胎儿凝血功能异常症状[17]。有报道称,具有4-吡喃-2-酮结构的香豆素衍生物(如华法林)可阻断VKOR活性,导致维生素K缺乏,并抑制凝血[18-19]。在本试验中,与正常组相比,4个剂量处理均显著降低雌雄大鼠血清维生素K1水平(P<0.01),且在给药9 d后均表现出明显的剂量效应关系。
根据体重增长和APTT结果,可知雌性大鼠比雄性大鼠对S-DHA更为敏感。为此本试验测定了雌雄大鼠在给药后不同时间点血清内的S-DHA浓度,结果显示在相同剂量的S-DHA处理下,雌性大鼠血清中S-DHA浓度高于雄性大鼠,这可能是雌性大鼠对S-DHA更敏感的主要原因。众所周知,人类华法林的治疗剂量在很大程度上受CYP基因多态性的影响[20-21]。CYP酶是药物代谢和消除过程中最重要的酶之一,许多外来生物制剂可以抑制或诱导CYP酶[22]。相同剂量S-DHA处理大鼠导致的雌雄性别间的代谢差异可能与S-DHA对代谢酶的影响有关。
本试验还比较了大鼠血清S-DHA浓度与PT和APTT的相关性。由图6可知,雌性大鼠血清S-DHA浓度与PT和APTT的相关性高于雄性大鼠。有研究表明,如果凝血过程中接触激活途径受非直接凝血酶抑制剂的化合物影响,则APTT与药物剂量或血清浓度的相关性高于PT与药物浓度的相关性[23]。雄性大鼠血清S-DHA浓度与PT之间的相关性较与APTT的相关性好,而雌性大鼠血清S-DHA浓度与APTT的相关性显著高于与PT的相关性,这意味着S-DHA对雌性大鼠激活途径的影响更大。或许正是由于S-DHA在雌雄大鼠间的代谢差异以及对激活途径的影响程度的不同导致了雌性大鼠对S-DHA更敏感。
50~200 mg/kg S-DHA灌胃给予Wistar大鼠后,致大鼠凝血指标PT和APTT显著延长,血中维生素K1水平显著降低,可致大鼠凝血功能异常且雌性大鼠对S-DHA更敏感。
