蜥蜴源黏质沙雷氏菌的分离鉴定与药敏试验
2024-01-29张锐铮许信刚
蒲 鹏,张锐铮,刘 寅,许信刚*,张 琪*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.西北农林科技大学博览园,陕西杨凌 712100)
黏质沙雷氏菌(Serratiamarcescens)是肠杆菌科沙雷氏菌属的一种条件致病菌,可感染各种动植物,对于一些爬行动物及经济植物、昆虫等是常见的病原菌之一[1]。在医学上,沙雷氏菌最早作为无害菌,随着对其致病性的研究不断深入,现已被认为是医院感染的一种重要条件致病菌[2]。其广泛分布于呼吸道、泌尿道及胃肠道等,可引起肺炎、尿路感染、菌血症等[3]。该菌除可导致人类患病外,还可导致各类经济动物感染甚至死亡,造成巨大经济损失。随着广谱抗菌药物的大面积使用,沙雷氏菌对多种抗菌药物产生多重耐药,致使沙雷氏菌感染率上升[4]。2023年2月,西北农林科技大学博览园饲养的1只观赏蜥蜴出现食欲废绝、精神沉郁、全身范围脓肿,尾部严重坏死等症状,笔者对蜥蜴坏死断尾及血液进行病原微生物的分离鉴定和药敏试验,以便于弄清其病原种类及其特性,为筛选出敏感性高的治疗药物提供借鉴。
1 材料与方法
1.1 材料
1.1.1 病料来源 无菌取西北农林科技大学博览园患病蜥蜴血液及坏死断尾,置于保温冰盒中送至实验室。
1.1.2 主要试剂 血液琼脂平板、营养琼脂平板、石蜡油、营养肉汤培养基、10×PBS缓冲液、革兰氏染色试剂、细菌生化鉴定管、琼脂糖、M.R试剂及V-P试剂,陕西德裕生物科技有限公司产品;药敏纸片,杭州滨和微生物试剂有限公司产品;DNA提取试剂盒及DNA回收试剂盒,北京天根生物科技有限公司产品产品。
1.1.3 实验动物 健康雌性昆明小鼠20只,体重35 g左右,购自空军医科大学实验动物中心。
1.2 方法
1.2.1 细菌分离 将无菌采集的病料处理后,分别进行有氧培养和厌氧培养。有氧培养:用无菌棉签蘸取病料,采用三区划线法接种至营养琼脂平板于恒温培养箱30 ℃培养24 h,接种环经无菌处理后取营养琼脂平板上优势单菌落再次划线接种纯化分离株,经单菌落划线接种纯化连续3次后,转接至营养肉汤置恒温摇床30 ℃;200 r/min培养18 h。厌氧培养:将病料置于加无菌石蜡油的营养肉汤中进行厌氧培养。
1.2.2 生化鉴定方法 取分离菌株新鲜菌液分别涂布纸营养琼脂平板、血液琼脂平板并进行革兰氏染色,并于显微镜下观察细菌形态及染色反应,参照生化鉴定试管说明书中操作进行相关的V-P、MR、硝酸盐还原试验、糖醇发酵试验、葡萄糖氧化发酵试验、水解淀粉试验、吲哚试验等。
1.2.3 小鼠致病性试验 分离菌株经连续纯化后,取优势单菌落转接肉汤培养基30 ℃恒温摇床培养24 h,8 000 r/min离心菌液,弃去上清并用PBS缓冲液进行吹洗。测定稀释后菌液OD 600 nm值,并结合平板计数法将菌液稀释至浓度1×108CFU/mL。将20只健康昆明系小鼠,随机分为两组,每组10只。试验组腹腔注射PBS稀释菌液0.2 mL/只,对照组腹腔注射等量PBS溶液。在合适条件下饲养小鼠并观察小鼠每日状态及发病症状,直至死亡,结束感染试验。
1.2.4 16SrRNA基因序列测定 按DNA提取试剂盒说明书操作处理所收集新鲜分离株菌液并提取样品总DNA组,选用细菌16S亚基引物16S rRNA进行PCR扩增,上游引物为:ACCATGTTTGATTCCTGCTCAG;下游引物为:CATGGTTTGATCCTGGCTCAG,目的基因片段大小约为1 500 bp。PCR反应体系20 μL:目的DNA 2 μL,上、下游引物各1 μL,2×Mix 10 μL,其余用ddH2O补足。按照以下程序进行PCR扩增:95 ℃ 10 min;95℃ 30 s,56 ℃ 30 s,72℃ 90 s,共30个循环;72℃延伸10 min。PCR产物由北京奥科生物科技公司进行测序,测序结果上传NCBI进行序列比对并确定分离株种类。
1.2.5 药物敏感性试验 参照CLSI试验标准检测分离株对药物的敏感性,选取复方新诺明、头孢噻肟、苯唑西林、替米考星、诺氟沙星、头孢噻吩、头孢曲松、林可霉素、环丙沙星、氧氟沙星、丁胺卡那、四环素、庆大霉素、头孢氨苄、氨苄西林等15种兽医临床常用药物,参照杭州滨和微生物试剂有限公司药敏纸片说明书对分离菌株进行MIC测定。
2 结果
2.1 分离株形态学观察与染色结果
分离获得了1株菌株,该菌在营养琼脂平板上形成乳白色圆形菌落,边缘整齐光滑(图1A),挑取单菌落经革兰氏染色后观察到红色短杆状(图1B),为革兰氏阴性菌[5]。该菌在鲜血琼脂平板正常生长无溶血环生成(图1C),该菌在厌氧培养基上可正常生长,镜检显示为革兰氏阴性杆菌与鲜血平板上所生长菌相似,均与图1B结果一致。分离自脓肿病灶菌株与血液中分离所得菌株形态学观察结果高度一致,均为革兰氏阴性菌。

A.营养琼脂平板; B.革兰氏染色(1 000×); C.鲜血琼脂平板A.Nutrient agar plate; B.Gram staining; C.Fresh blood agar plate图1 分离菌株形态学观察结果Fig.1 The morphological observations of the isolate
2.2 生化鉴定结果
分离自血液与脓肿病灶的2株菌株其生化特性一致,为同种菌株。生化鉴定结果见表1,其结果符合黏质沙雷氏菌生物学特性。结合其形态学观察初步鉴定该分离株为黏质沙雷氏菌。
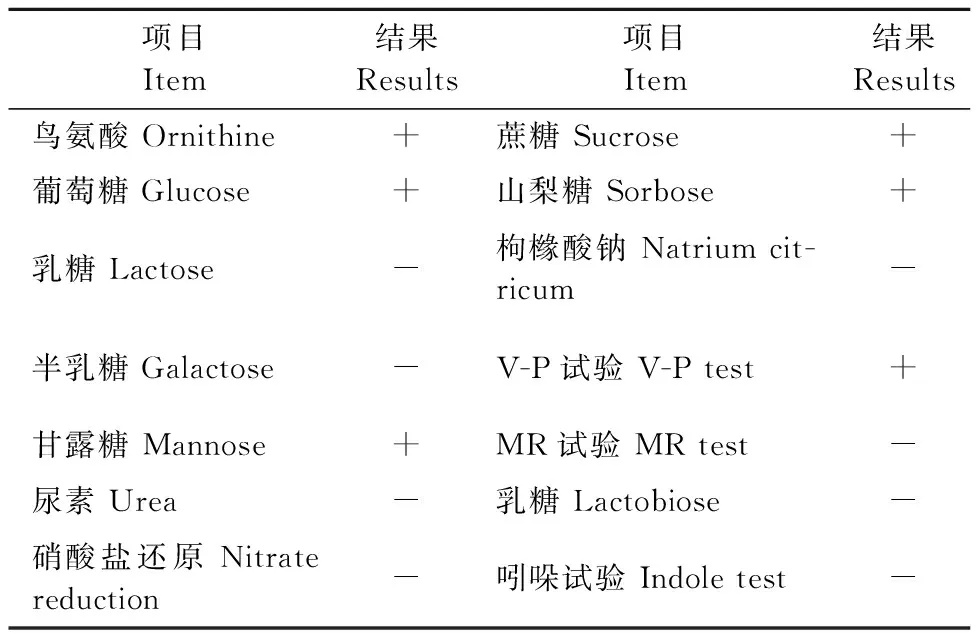
表1 分离株生化试验结果Table 1 Biochemical test results of isolate
2.3 小鼠致病性试验
试验组小鼠注射分离株纯化菌液24 h后,采食量明显下降,食欲不振、精神萎靡、呼吸加快,有腹水。3 d后试验组小鼠出现部分死亡,无菌剖检试验组死亡小鼠,发现小鼠大量腹水,肝脏病变明显,黄染且局部灰白样化脓灶;肾脏有针尖样出血点,肺部充血明显。分别无菌取血液、肝脏、肺脏及肾脏深层组织进行细菌分离培养及PCR鉴定,革兰氏染色后镜检发现为分离细菌为革兰氏阴性杆菌,其生理形态与黏质沙雷氏菌相似,对照组小鼠无异常。
2.4 16S rRNA基因序列测定结果
经PCR扩增,结果见图2,PCR产物由北京奥科生物科技公司进行测序,测序结果上传NCBI进行序列比对确定分离菌株(S-1)与黏质沙雷氏菌(MT039180.1)序列同源性高达98%。经NCBI进行Blast后,选取与分离菌株(S-1)同源性较高沙雷氏菌属序列及GenBank已收录的蜥蜴常见病原菌16S rRNA序列(MCIV01000014.1、MCIV01000014.1、NZ-CABWIH010000131.1、CP040938.1、CP050857、NZ-RAID01000018.1、NZ-SRIG01000330.1、MT039180.1、MT039221.1、NZ-MH569711、NZ-CP012686.1、NBWV01000004.1等)共同构建系统发育树,结果显示,分离菌株与黏质沙雷氏菌聚为一分支,亲缘关系最近(图3)。

M.DNA标准DL 5 000;1.分离株16S rRNA基因M.DNA Marker DL 5 000;1.Isolate 16S rRNA gene图2 菌株16S rRNA扩增结果Fig.2 Results of 16S rRNA amplification of isolate
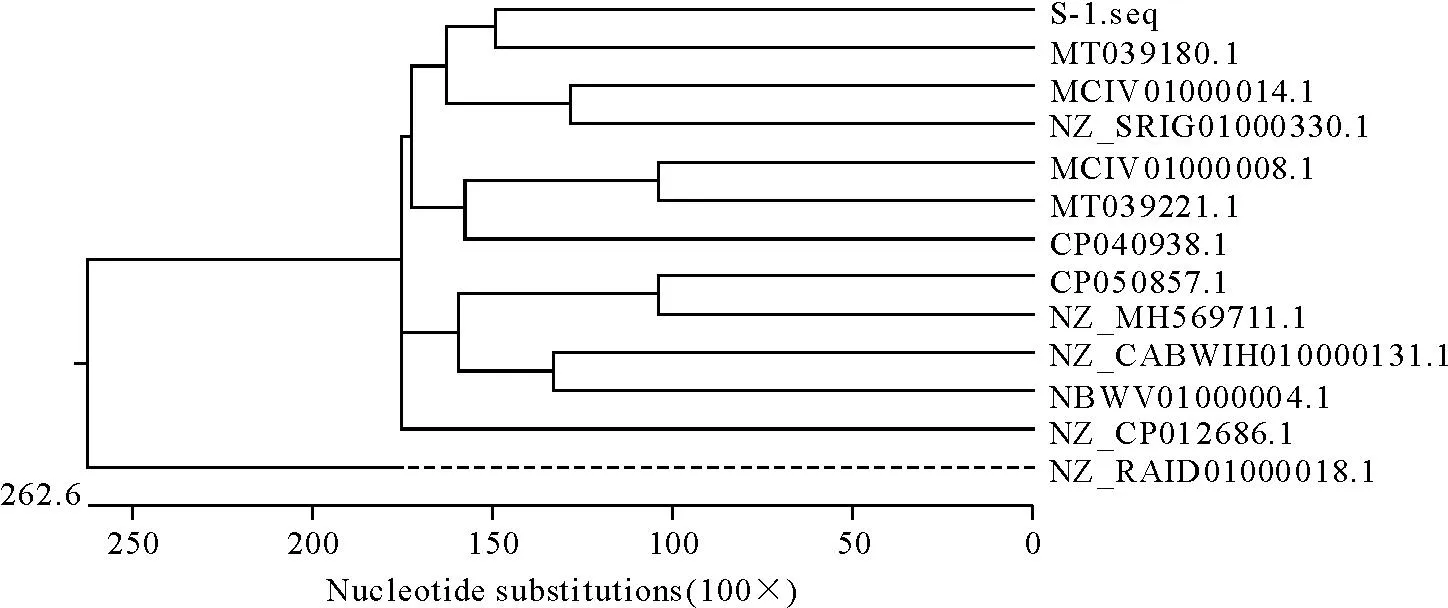
图3 分离菌株的系统发育树Fig.3 Phylogenetic tree of related isolate
结合形态学、生理生化鉴定和基于16SrRNA基因的分子鉴定结果综合判定,本次从患病蜥蜴分离到的菌株为黏质沙雷氏菌。
2.5 药敏试验
分离菌株对实验室常见15种抗菌药物的敏感度参照杭州滨和微生物试剂有限公司药敏纸片说明书对分离菌株进行药物敏感性判定,其结果如表2所示,分离菌株对诺氟沙星、丁胺卡那、头孢曲松、氧氟沙星、头孢噻肟等5种抗菌药物高度敏感,对复方新诺明中度敏感,对环丙沙星、头孢噻吩、庆大霉素、头孢氨苄、苯唑西林、多黏菌素B、林可霉素、四环素、氨苄西林9种抗菌药物耐药。

表2 分离菌株药敏试验结果Table 2 Results of drug sensitivity test of isolate
3 讨论
黏质沙雷氏菌最早被认为是无害菌,随着病例报道增多,现已成为重要的人畜共患条件性致病菌,在较多的医学临床报道中,临床标本分离最多的就是黏质沙雷氏菌。该菌广泛存在于自然界中各种动植物体内,对经济动物产生难以估量损失。本试验从西北农林科技大学博览园1只发病的观赏蜥蜴病料中分离到1株细菌,经细菌形态学、生化特性和分子生物学方法综合鉴定,最终确定分离菌株为黏质沙雷氏菌。为进一步达到治疗目的,筛选兽医临床常用15种药物进行药敏试验[6],其中分离株对氧氟沙星、诺氟沙星、头孢曲松、丁胺卡那、头孢噻肟等5种抗菌药物高度敏感,对复方新诺明中度敏感,对其他9种抗菌药物均耐药。结合爬行动物用药禁忌,建议氧氟沙星为治疗患病蜥蜴首选药物,此结果与其他黏质沙雷氏菌药敏试验研究结果[4,7-9]较为一致。本试验中黏质沙雷氏菌导致实验小鼠肝脏、脾脏、肾脏、心脏等均出现严重的病理改变,这与黏质沙雷氏菌在人类临床上表现出来的对各器官广泛感染性相一致[2]。患病蜥蜴所表现食欲不振、摇头晃脑、局部皮肤脓肿灶同样与实验小鼠前期病变较一致。
黏质沙雷氏菌作为病原菌感染中华鳖[8]、水貂[10]、牦牛[11]、山羊等在国内已有报道,但尚未报道蜥蜴感染的相关病例。本研究通过生理生化及16S rRNA序列比对,确定该分离菌株为黏质沙雷氏菌,证实了黏质沙雷氏菌作为蜥蜴的潜在致病菌,由该菌引起的蜥蜴菌血症,建议选用氧氟沙星对患病蜥蜴进行治疗。
