组氨酸通过抗氧化作用改善移植肝缺血再灌注损伤
2024-01-23张志刚高铭舒李佳颖许小君魏元元杜钰璐黄启超
张志刚,高铭舒,李佳颖,许小君,魏元元,杜钰璐,王 楠,黄启超
(1空军军医大学基础医学院生理与病理生理学教研室,陕西 西安 710032;2西北大学生命科学学院生物学教研室,陕西 西安 710069;3陕西中医药大学第二临床医学院,陕西 咸阳 712046;4延安大学基础医学院病理学教研室,陕西 延安 716000)
缺血再灌注损伤是一种广泛存在于肝脏手术(例如肝移植和切除术)中的病理生理过程,主要发生在出血性休克期间[1-2]。缺血再灌注损伤是导致器官移植失败和肝功能障碍风险增加的关键要素[3-4]。遗憾的是,目前尚缺乏治疗肝缺血再灌注损伤的有效药物,缺血预处理是有可能改善患者预后的治疗手段[5-6]。因此,迫切需要研发用于治疗缺血再灌注相关肝损伤的新型治疗策略。
肝脏缺血再灌注损伤的发生可能部分归因于缺血阶段的肝损伤,另一部分归因于血流恢复时引发的一系列损伤[7-9]。越来越多的证据表明,在再灌注期间,显著增加的线粒体活性氧(reactive oxygen species,ROS)诱发DNA损伤、脂质过氧化和细胞坏死是引发组织损伤的主要因素之一[10]。因此,ROS作为氧化应激和炎症反应的关键引发因素,一直被视为抗氧化疗法的潜在靶点[11-13]。例如,2014年英国剑桥大学CHOUCHANI等[14]的研究发现,琥珀酸在缺血组织中积累,被琥珀酸脱氢酶迅速氧化,通过线粒体复合物Ⅰ反向电子传递驱动,产生大量的ROS;而丙二酸可以抑制琥珀酸脱氢酶的活性,减少缺血期间琥珀酸的积累,从而改善心脏和中风小鼠模型的缺血再灌注损伤[15];铈纳米颗粒作为代表性的纳米抗氧化剂,2019年美国威斯康星大学蔡伟波教授研究团队[16]的研究结果表明,二氧化铈通过清除ROS有效缓解肝缺血再灌注损伤的临床症状。
组氨酸在抗氧化防御中起重要作用,其主要的保护机制是通过其咪唑环直接清除急性炎症反应期间细胞产生的ROS;另外,铁离子、铜离子、镍离子、铬离子和锌离子可以通过芬顿反应促进自由基的产生,对生物体产生毒性作用,而组氨酸可以通过螯合上述金属离子,从而减少ROS产生[17-19]。既往有文献报道,组氨酸-色氨酸-酮戊二酸溶液可提高移植器官抗氧化能力和对寒冷的耐受性,可用于肝、肾、胰腺、小肠、心脏和肺移植器官保存[20-21];谷氨酰胺、组氨酸、亮氨酸、蛋氨酸、脯氨酸、苯丙氨酸、色氨酸和丙氨酸联合使用具有对抗大鼠肝脏缺血再灌注损伤作用[22],上述研究表明多种代谢物联合使用对肝组织有保护作用,而单一组氨酸是否可以用于抗肝组织缺血再灌注损伤尚不清楚。此外,也有文献报道,50~100 mg/kg体质量组氨酸可以通过清除单线态氧和羟基自由基对大鼠短暂性前脑缺血和大鼠离体心脏缺血再灌注损伤有保护作用[23-24],但是高浓度组氨酸有多种不良反应,比如身体发育迟缓、智力差、情绪不稳定、震颤、共济失调和精神病等[25]。临床常用的复方氨基酸注射液中组氨酸以10~20 mg/kg体质量静脉注射给药,本实验通过10 mg/kg体质量小鼠腹腔注射给药,探究是否对于肝组织缺血再灌注损伤有保护作用,为临床治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 数据来源 数据来源于美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中加州大学洛杉矶分校REED教授团队的研究,移植前约2 h和再灌注后2 h对移植肝行活检针活检(n=40)[26]。所有样品均在Illumina HiSeq 3000平台上测序。
1.1.2 实验动物 购买8~10周龄雄性C57BL/6小鼠30只,体质量20~25 g。将小鼠饲养在标准的无特异性病原体环境(20~26 ℃,12 h光照和12 h黑暗循环)中,随意获取食物和水,饲养3 d。本研究经空军军医大学实验动物福利与伦理委员会的批准(许可证号:20220998)。
1.1.3 主要试剂 组氨酸(CAS:71-00-1)购自美国默克生物试剂公司。抗cleaved caspase-3抗体(ab32042)、抗Bcl-2抗体(ab182858)、抗Bax抗体(ab32503)购自上海艾博抗贸易有限公司。蛋白浓度测定试剂盒(P0012)、蛋白提取试剂盒(BC3710)、RIPA裂解液(R0010)购自北京索莱宝科技有限公司。流式细胞术凋亡检测试剂盒(BB-4101)购自上海贝博公司。细胞凋亡检测试剂盒(C1090)、细胞核染色液试剂盒(C1005)、ROS检测试剂盒(S0033M)采购自北京碧云天试剂有限公司,丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(476826)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒(476831)购自美国贝克曼库尔特有限公司。
1.1.4 主要实验仪器 FV3000激光共聚焦显微镜购自日本OLYMPUS公司;凝胶成像分析系和流式细胞仪购自美国贝克曼库尔特有限公司;全自动生化分析仪(7600)购自日本日立公司。
1.2 方法
1.2.1 动物分组和处理 将30只小鼠分为3组:假手术组、生理盐水治疗组、组氨酸治疗组。组氨酸治疗组分别在术前3、24、72 h注射1 mL组氨酸(浓度为200 μg/mL,10 mg/kg),生理盐水治疗组及假手术组注射同体积生理盐水,注射方式为腹腔注射。
1.2.2 小鼠肝缺血再灌注模型 参照文献[27-28],采用8~10周龄(体质量20~25 g)雄性小鼠构建非致死性节段性(70%)肝缺血再灌注损伤模型。在用戊巴比妥钠麻醉小鼠后,行中线剖腹术暴露肝脏。然后使用无创伤微血管钳(1.6 cm,黎泉医疗器械)夹闭住左叶和正中叶的血液供应。缺血性肝叶变白表明缺血手术成功。缺血1 h后,取出血管钳进行再灌注,再灌注肝叶较缺血肝叶变红。在再灌注6 h后,对小鼠实施麻醉安乐死以收集肝脏样本和血液样本以供随后检查。
1.2.3 肝功能检测 眼球取血液后,将全血4 ℃静置过夜,1 500g离心,15 min,收集血清,取20 μL加入180 μL生理盐水稀释10倍,血清ALT和AST试剂加入全自动生化分析仪检测ALT和AST活性。
1.2.4 Western blotting检测 取右叶肝组织后提取蛋白并测定浓度。配置电泳凝胶,上样孔中加入相应样本蛋白20 μg,进行电泳,转膜120~180 min,50 g/L脱脂奶粉室温封闭90 min;根据标记蛋白裁剪相应条带,将条带置于一抗(1∶1 000)抗体孵育盒,置于摇床过夜,然后进行二抗(1∶2 000)孵育(室温1 h)。将条带放于成像仪器中成像。
1.2.5 肝组织病理学检测 肝组织修块后浸泡于40 g/L多聚甲醛溶液,石蜡包埋后进行组织切片,厚度为5 μm,HE染色用显微镜观察5个视野进行统计,计算单个视野中肝细胞坏死区域面积。
1.2.6 肝组织TUNEL染色 使用细胞凋亡检测试剂盒检测肝细胞凋亡比例,细胞固定30 min后,加入PBS孵育5 min。使用内源性过氧化物酶封闭液室温孵育20 min。加生物素标记液避光孵育60 min,样品显色后封片,用显微镜观察5个视野进行统计,计算单个视野中凋亡肝细胞所占百分比。
1.2.7 缺血再灌注人肝永生化(T-antigen-immortalized human liver epithelial,THLE)细胞模型 THLE细胞培养在含有100 mL/L胎牛血清DMEM培养基中(含0.1 g/L青霉素-链霉素)。将THLE细胞分别以每孔3×105个细胞量种于6孔板中,培养24 h。将细胞分为阴性对照组、生理盐水处理组和组氨酸处理组,每组6个样本。除阴性对照组外,对快速生长期细胞分别在无糖、无血清添加生理盐水和添加组氨酸(200 μg/mL)的DMEM中行缺氧(940 mL/L N2,10 mL/L O2和50 mL/L CO2)培养6 h。然后在正常空气条件下用100 mL/L胎牛血清(950 mL/L空气,50 mL/L CO2)在37 ℃下培养6 h。
1.2.8 THLE细胞凋亡检测 使用细胞凋亡检测试剂盒检测缺氧/复氧THLE肝细胞凋亡改变,将贴壁细胞消化后1 000g离心5 min,加入195 μL膜联蛋白V-异硫氰酸荧光素(annexin V-fluorescein isothiocyanate,annexin V-FITC)结合液轻轻重悬细胞后加入5 μL annexin V-FITC和10 μL碘化丙啶染色液,轻轻混匀。用流式细胞仪检测凋亡细胞百分比。
1.2.9 THLE细胞ROS检测 使用ROS检测试剂盒检测缺氧/复氧THLE肝细胞ROS水平,用无血清培养液稀释2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorofluorescein diacetate,DCFH-DA)终浓度为10 μmol/L,细胞收集后悬浮于稀释好的DCFH-DA中,37 ℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,用无血清细胞培养液洗涤细胞3次。用共聚焦显微镜选取5个视野拍照,ImageJ软件统计单个视野细胞荧光总强度。
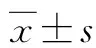
2 结果
2.1 组氨酸代谢通路在肝组织缺血再灌注后下调
通过分析NCBI人肝组织移植前后转录组学RNA测序(RNA sequencing,RNA-seq)数据结果,发现组氨酸代谢通路是移植肝缺血再灌注损伤后表达下调的基因集之一(图1A)。这表明组氨酸代谢被抑制可能是移植肝缺血再灌注损伤后共有特征。与移植前肝组织相比,组胺N-甲基转移酶、尿酸水合酶1、酰胺水解酶结构域1、酰胺水解酶结构域2、甲酰氨基转移酶环脱氨酶、肌肽合酶1,肝移植后6种主要的组氨酸分解代谢酶表达均下调(图1B~C)。以上结果提示,组氨酸浓度升高可能具有抗移植肝缺血再灌注损伤作用。

A:NCBI人肝组织移植前后转录组学RNA测序差异基因代谢富集通路图(n=40)。B:肝组织移植前后组氨酸分解代谢基因表达水平(n=40);aP<0.05。C:组氨酸分解代谢通路图。HNMT:组胺N-甲基转移酶;UROC1:尿酸水合酶1;AMDHD1:酰胺水解酶结构域1;AMDHD2:酰胺水解酶结构域2;FTCD:甲酰氨基转移酶环脱氨酶;CARNS1:肌肽合酶1。图1 组氨酸代谢通路在肝脏组织缺血再灌注后下调
2.2 补充组氨酸具有改善小鼠肝缺血再灌注损伤作用
为了明确组氨酸治疗组是否能够有效改善肝缺血再灌注损伤,我们通过观察缺血1 h再灌注6 h(图2A)C57小鼠肝脏组织缺血坏死面积大小、血清转氨酶活性高低和肝组织细胞凋亡所占比例,判断是否有治疗效果。肝组织大体照片显示组氨酸治疗组缺血再灌注后肝组织缺血损伤面积显著小于生理盐水治疗组(图2B)。ALT和AST是临床应用最广泛反映肝细胞损伤的生化指标[29]。与生理盐水治疗组相比,组氨酸治疗组血清ALT和AST活性明显降低(P<0.05,图2C~D)。此外,为了进一步明确组氨酸对于肝缺血再灌注损伤保护作用,我们观察肝组织病理结构改变。参考肝组织病理学观察标准[30],HE染色结果提示,生理盐水治疗组缺血再灌注损伤肝组织在光镜下可见被夹闭部分肝小叶结构紊乱,肝周边供血差区部分细胞变性,肝细胞弥漫肿大,以小叶中央周围细胞为主;肝细胞核深染,偶见核溶解;散在气球样变性及肝细胞坏死灶及明显炎症细胞浸润。组氨酸处理组小鼠肝组织的上述病理学改变明显减轻(P<0.05,图2E~F)。以上结果均表明,补充组氨酸可改善小鼠肝缺血再灌注损伤。

A:缺血再灌注小鼠模型方案;B:缺血再灌注小鼠肝脏大体照片(n=10);C~D:小鼠血清ALT、AST活性检测(n=10);E~F:小鼠肝脏HE染色肝细胞损伤坏死面积(n=5)。ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶。aP<0.05。图2 补充组氨酸具有改善小鼠肝缺血再灌注损伤作用
2.3 补充组氨酸具有减少缺血再灌注肝细胞凋亡作用
为明确组氨酸是否对缺血再灌注肝细胞有保护作用,我们建立缺氧/复氧细胞模型模拟细胞缺血再灌注损伤[31](图3A)。细胞凋亡实验结果显示,与生理盐水处理组相比,组氨酸处理组细胞总凋亡比例显著减少(P<0.05,图3B~C);此外,肝组织TUNEL染色检测结果表明,与生理盐水治疗组相比,组氨酸治疗组缺血再灌注损伤肝组织细胞凋亡比例显著减少(P<0.05,图3D~E)。因此,补充组氨酸可能对肝细胞具有抗缺血再灌注损伤作用。
2.4 补充组氨酸可减少ROS水平,提示具有抗肝脏缺血再灌注损伤作用
缺血再灌注后ROS水平升高可引起肝细胞损伤和细胞凋亡[32]。为了明确组氨酸改善肝缺血再灌注损伤机制,我们检测肝细胞ROS水平和凋亡相关指标。与阴性对照组细胞相比,缺氧/复氧THLE细胞ROS水平显著增加;而组氨酸处理后,细胞中ROS水平显著减少(P<0.05,图4A~B)。ROS增加可以激活细胞凋亡相关水平,通过蛋白检测发现,与假手术组相比,生理盐水治疗组肝组织Bax蛋白表达水平均显著上调,Bcl-2蛋白表达显著下调,Bax/Bcl-2比值显著升高;此外,cleaved caspase-3蛋白水平显著升高。组氨酸治疗后,与生理治疗组相比,上述促凋亡蛋白水平显著降低,抑制凋亡蛋白水平显著升高,Bax/Bcl-2比值显著降低(P<0.05,图4C~D)。综上所述,补充组氨酸通过减少细胞ROS水平进而抑制肝细胞凋亡,提示补充组氨酸可以改善肝组织缺血再灌注损伤。
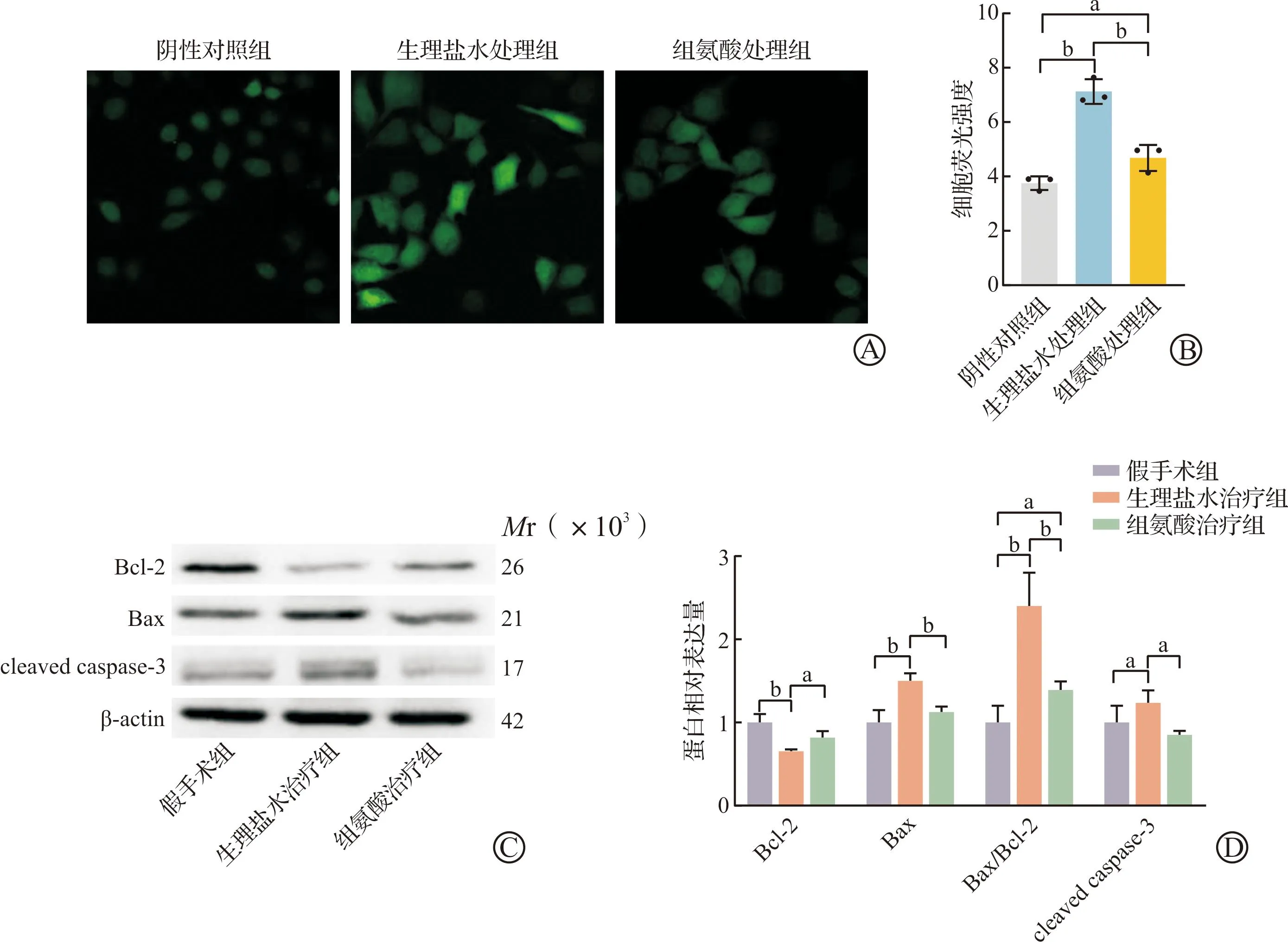
A~B:THLE细胞阴性对照组、生理盐水处理组和组氨酸处理组测定单个视野细胞ROS荧光总强度(×1 000,n=3),绿色代表细胞中ROS水平;C~D:假手术组、生理盐水治疗组和组氨酸治疗组肝脏组织缺血再灌注损伤凋亡相关蛋白Bcl-2、Bax和cleaved caspase-3蛋白水平(n=3)。THLE:缺血再灌注人肝永生化;ROS:活性氧。aP<0.05,bP<0.01。图4 补充组氨酸通过减少细胞ROS水平进而抑制肝细胞凋亡
3 讨论
肝脏缺血再灌注不仅直接破坏大量肝细胞,还会影响肝细胞的再生力,这是影响肝手术成功概率及导致患者术后肝功能衰退甚至死亡的关键因素[3-4]。2018年8月发表在国际顶尖学术期刊JHepatol上的研究结果表明,通过靶向代谢组学分析发现人同种异体肝移植后肝脏组织中组氨酸水平明显升高[33],本实验通过对NCBI人肝组织移植前后转录组学图谱RNA-seq数据分析以及肝移植前后肝脏代谢组学公共数据分析,试图找出能显著降低肝缺血再灌注损伤损伤期间ROS的代谢物。结果显示,组氨酸可能对肝脏具有抗缺血再灌注损伤作用。
补充组氨酸是增强组织抗氧化作用的一种安全、有效的方法[34]。组氨酸作为一种营养必需氨基酸,可被快速而广泛地吸收,口服剂量的生物利用度达到80%[35],这为各种条件下使用组氨酸作为营养补充剂创造了良好的理论依据。我们研究发现,与生理盐水治疗组相比,组氨酸治疗组小鼠肝缺血再灌注损伤肝功能明显改善,通过细胞实验也发现组氨酸处理组缺氧/复氧THLE细胞凋亡比例降低,说明补充组氨酸可以改善移植肝缺血再灌注损伤。此外,我们的研究提示补充组氨酸可减少肝细胞ROS水平,进而抑制细胞凋亡,改善肝脏缺血再灌注损伤。这为移植肝缺血再灌注损伤患者临床救治提供新的药物和方法,同时也为更多抗氧化代谢物应用于各种缺血损伤疾病提供临床救治思路。
