国际首例6-基因编辑猪-猴肝肾联合移植围术期治疗研究
2024-01-23韩士超马帅军戚若晨王国辉张小燕刘克普范效铮杨晓剑陶开山秦卫军窦科峰
韩士超,马帅军,戚若晨,王国辉,张小燕,刘克普,范效铮,魏 迪,张 玄,杨晓剑,陶开山,秦卫军,窦科峰
(空军军医大学西京医院:1泌尿外科,2肝胆外科,陕西 西安 710032)
肾移植是治疗慢性肾功能不全(尿毒症期)的有效手段之一,同种异体肾移植技术已成为一项常规技术,但器官供体严重短缺被认为是制约肾移植发展的瓶颈,目前临床上虽然开展了边缘供体肾移植、亲属活体供肾移植、ABO血型不相合肾移植等技术,但仍无法从根本上解决供肾短缺的难题[1-3]。异种器官移植被认为是从根本上解决器官短缺难题的有效途径,目前国际上基因编辑猪肾在非人灵长类动物体内最长存活记录已达758 d[4],这为我们进行异种肾脏移植的研究提供了巨大的信心,但国内相关研究只达到了中短期存活[5]。目前,异种肾脏移植面临最突出的问题依然是急性排斥反应。
2020年,在窦科峰院士的指导下,我们科室进行了13-基因编辑猪-恒河猴肾脏移植的研究[6],然而,由于血栓形成导致心律失常,受体猴仅存活1 d,但相关工作仍给我们积累了大量的经验。多项研究表明,肝肾联合移植术后移植肝可以对移植肾起到免疫保护作用,从而更容易维持机体的免疫耐受状态[7-8]。为了进一步减轻异种移植间的排斥反应,我们于2022年10月,创新性地实施了国际首例6-基因编辑猪-恒河猴腹腔异位肝脏移植+原位肾脏移植术,受体猴的生存时间较前显著延长。本研究通过创新术式,观察异种肾移植围术期变化,总结相关经验,完善移植术后用药方案,为异种肾脏移植向临床推进做出努力。
1 材料与方法
1.1 材料
供体为GTKO/β4GalNT2 KO/CMAH KO/hCD55/hCD46/hTBM 6-基因编辑巴马小型猪,雄性,3月龄,体质量7 kg,血型为O型,由成都中科奥格生物科技有限公司提供,供体猪敲除了主要的糖类抗原半乳糖α-1,3-半乳糖(α-1,3-galactosyltransferase,α-Gal)基因,以及另外两种主要异种抗原基因Neu5Gc和Sda。同时联合转入hCD46/hCD55和hTBM。供体猪术前经血型鉴定、基因表型鉴定均符合预期。受体为恒河猴,雄性,体质量10 kg,血型B型,由四川省医学科学院暨四川省人民医院实验动物研究所提供。术前行供受体抗原抗体结合实验和细胞毒试验,以筛选最适合的供受体。所有实验均通过空军军医大学实验动物福利与伦理委员会审核(许可证号:IACUC2022001)。
1.2 方法
1.2.1 手术过程及手术方式 手术于2022年10月16日进行,历时约14 h完成。术前3 d行供受体腹部大血管超声及CT血管造影检查,选取血管口径尽量匹配的供受体进行试验。供体猪供肾、供肝切取后立即于冰水混合物中进行修肾、修肝,修整工作完毕后置于冰水混合物中保存备用。受体猴麻醉准备工作完毕后,手术切除受体猴右侧肾脏,保留自体左侧肾脏,供肝劈肝后行腹腔异位肝移植术[9],肝移植结束后开放血流,检查无明显出血后行原位肾移植术。供肾放置于原右肾窝,切除受体自体右肾,将右肾动静脉阻断,移植肾动静脉与原右肾动静脉使用显微吻合技术进行端端吻合,开放血流后检查移植肾动静脉无明显出血,移植肾输尿管行皮肤造口术。相关手术示意图见图1。关腹前再次检查移植肾、移植肝血流灌注,无明显出血后关腹结束手术。
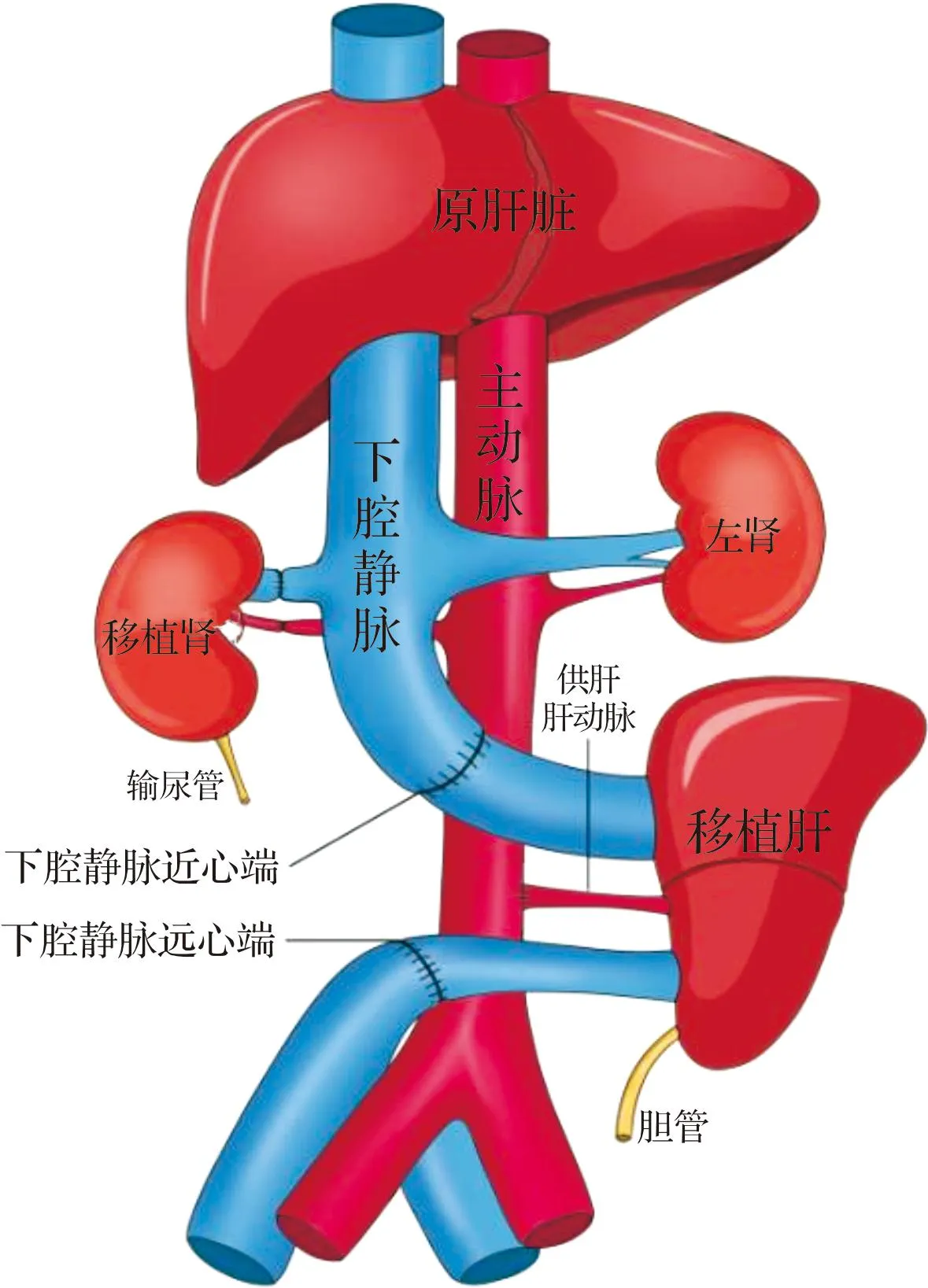
图1 肝肾联合移植示意图
1.2.2 免疫抑制方案 免疫诱导方案:抗CD20单克隆抗体19 mg/kg,术前2 d静脉给药;抗胸腺细胞球蛋白5 mg/kg,分别在术后0、1、2 d静脉给药;抗CD40单克隆抗体20 mg/kg,在术前1 d、术后0 d静脉给药。免疫维持方案:抗CD40单克隆抗体20 mg/kg,分别在术后4、7 d静脉给药;他克莫司0.05~0.10 mg/kg,静脉给药2次/d,血药浓度维持在15~20 ng/L;托珠单抗8 mg/kg,每周1次;甲泼尼龙在术后1、2、3 d给药剂量为10 mg/(kg·d),静脉给药,术后第4日减半,之后每日减半,至1 mg/kg维持。抗凝方案:阿司匹林(40 mg,口服1次/d)+那曲肝素钙(1 900 IU,皮下注射1次/d);其他用药:奥美拉唑20 mg/d静脉给药;头孢哌酮舒巴坦钠0.2 g,静脉给药2次/d;更昔洛韦5 mg/kg预防病毒感染。
1.2.3 观察内容 观察开放血流后移植肾、移植肝的功能状态,包括颜色、质地、血流灌注及器官功能恢复情况,并记录受体存活情况;采用彩色多普勒超声监测移植物的血流动力学情况;监测受体生理生化指标,如血压、心率、呼吸、氧饱和度、尿量、引流量等,以及血尿常规、肝肾功离子、心肌酶谱等;在观察终点,获取移植肾、移植肝组织样本,行组织病理学检查。经过多学科会诊,综合评估移植器官功能状态和异种肾脏移植的移植肾排斥反应发生情况。
2 结果
2.1 受体存活情况
受体猴术后移植肾功能、灌注均良好,术后受体猴维持镇静镇痛状态,术后整体生命体征平稳,术后第5日,移植肾考虑出现急性排斥反应,给予甲泼尼龙激素冲击、利妥昔单抗冲击,效果不佳,术后第6日给予连续性肾脏替代治疗辅助透析,术后第14日受体猴出现心脏骤停,经抢救无效死亡,实验终止。
2.2 术后移植肾状态
开放血流后受体猴血流动力学状态良好,移植肾、移植肝血流灌注良好,移植物颜色红润,质地良好,开放血流后即可见移植肾有尿液流出,移植肝有胆汁流出。术后移植肾尿量均良好,维持在较高水平,自体肾尿量逐渐减少,术后第5日移植肾尿量开始减少,移植肾体积增大,考虑出现急性排斥反应,自体肾尿液逐渐增多;术后第9日移植肾血流及灌注降低,术后第14日受体猴死亡,解剖可见移植肾明显充血肿大,剖面见多发微血栓形成,移植肾外观呈大红肾外观(图2)。
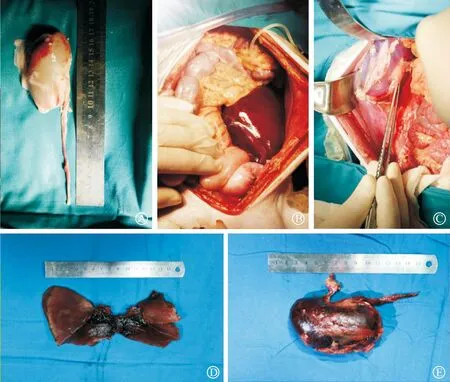
A:供体肾脏灌注后状态;B:移植肝开放血流后状态;C:供体肾开放血流后状态;D:尸检肝脏外观及剖面外观;E:尸检移植肾外观。图2 移植物状态变化
2.3 术后移植肾血流动力学情况
术后使用彩超监测移植肾的血流动力学情况。结果显示术后开放血流即刻至术后第5日,移植肾血流动力学良好,第5日后出现移植肾脏变大,血流阻力指数升高的表现,术后第9日,移植肾血流灌注显著降低,其动态过程见图3。
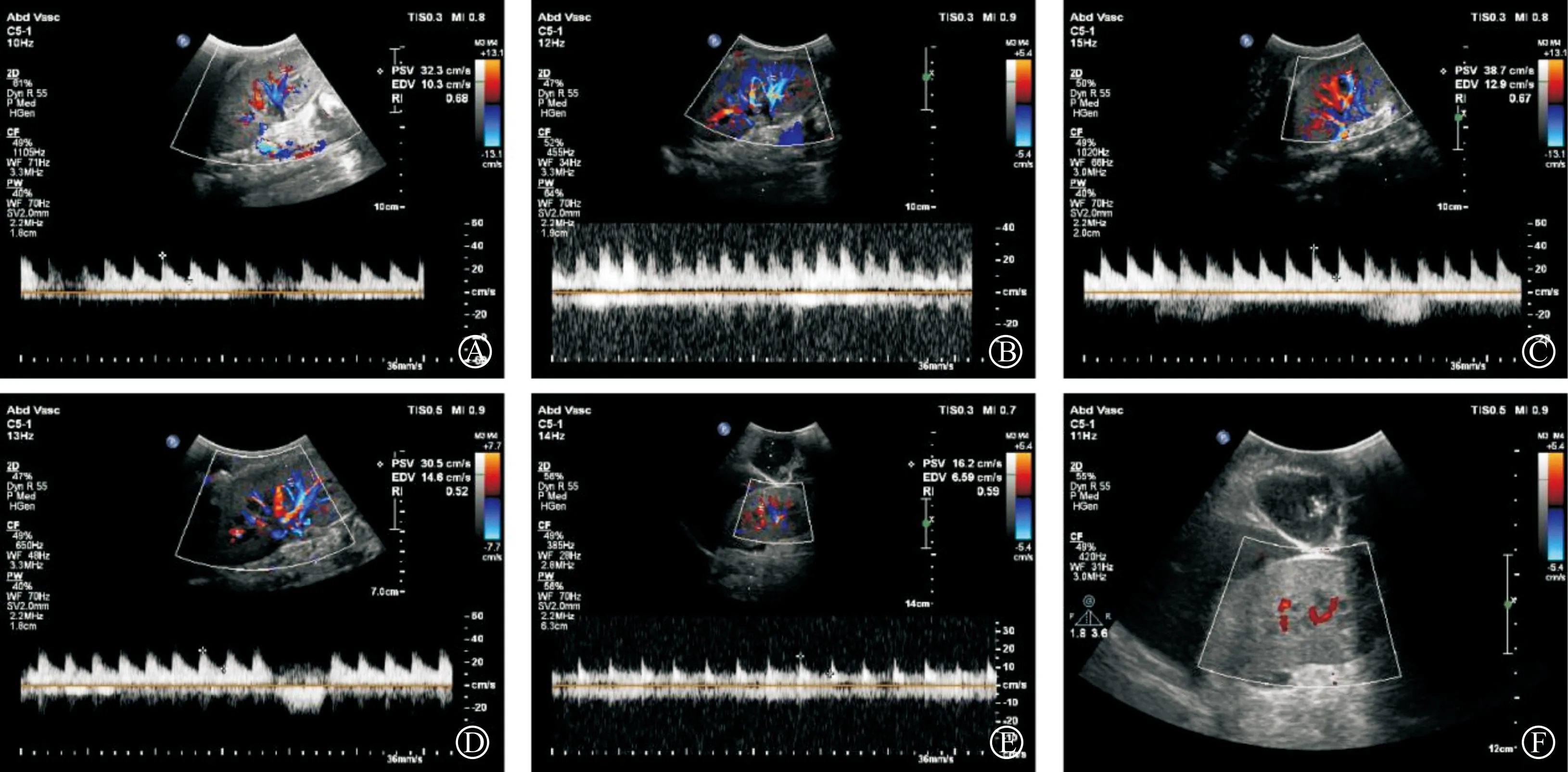
A:移植肾动静脉吻合完毕开放血流即刻超声图像;B:移植术后1 d超声图像;C:移植术后3 d移植肾超声图像;D:移植术后5 d移植肾超声图像;E:移植术后7 d移植肾超声图像;F:移植术后9 d移植肾超声图像。图3 移植肾血流动力学情况
2.4 术后受体猴生化指标情况
受体猴每日采集血液样本,进行生化指标检测。结果显示,受体猴血红蛋白、血小板、白细胞均呈进行性下降;肌酐在前5 d呈进行性升高,透析后肌酐水平平稳,钾离子水平变化不显著(图4)。
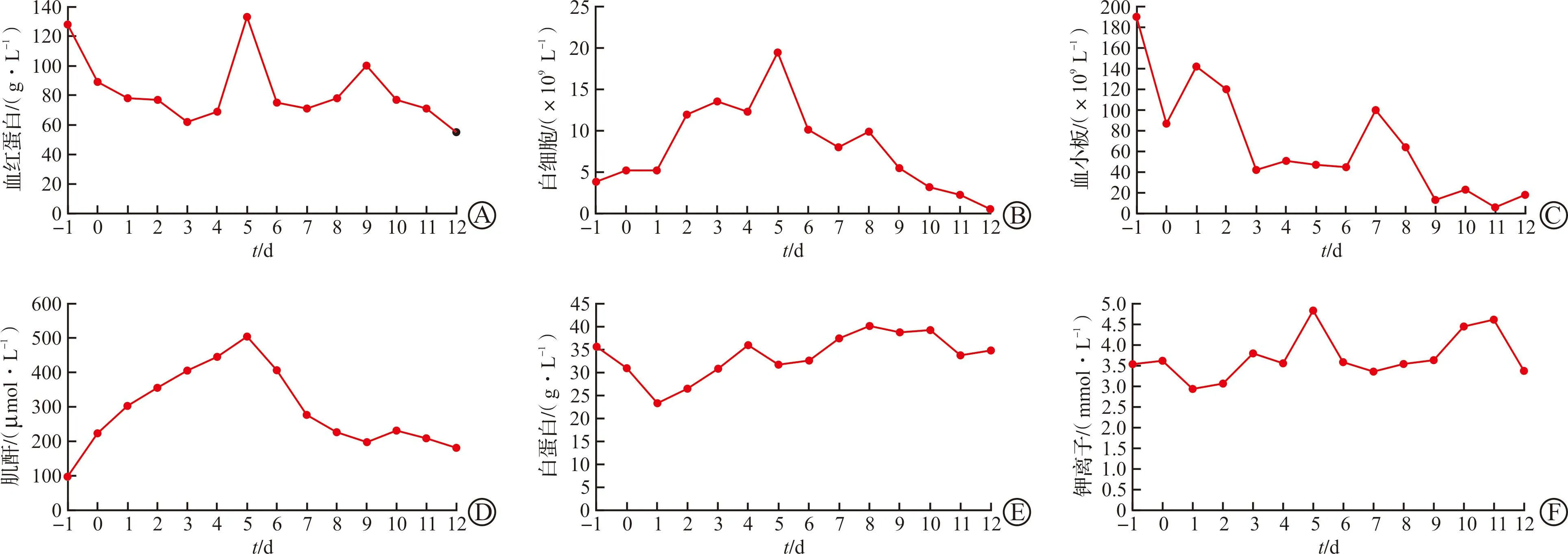
图4 受体猴围术期生化指标变化情况
2.5 术后受体猴尿液变化情况
每日监测受体猴尿量变化。在术后前5 d,移植肾尿量良好,维持在较高水平,尿液淡黄,5 d之后移植肾尿量迅速减少,且出现较多沉渣;与之相对,自体肾脏尿量在前5 d显著减少,5 d之后,自体肾脏尿液明显增加(图5)。
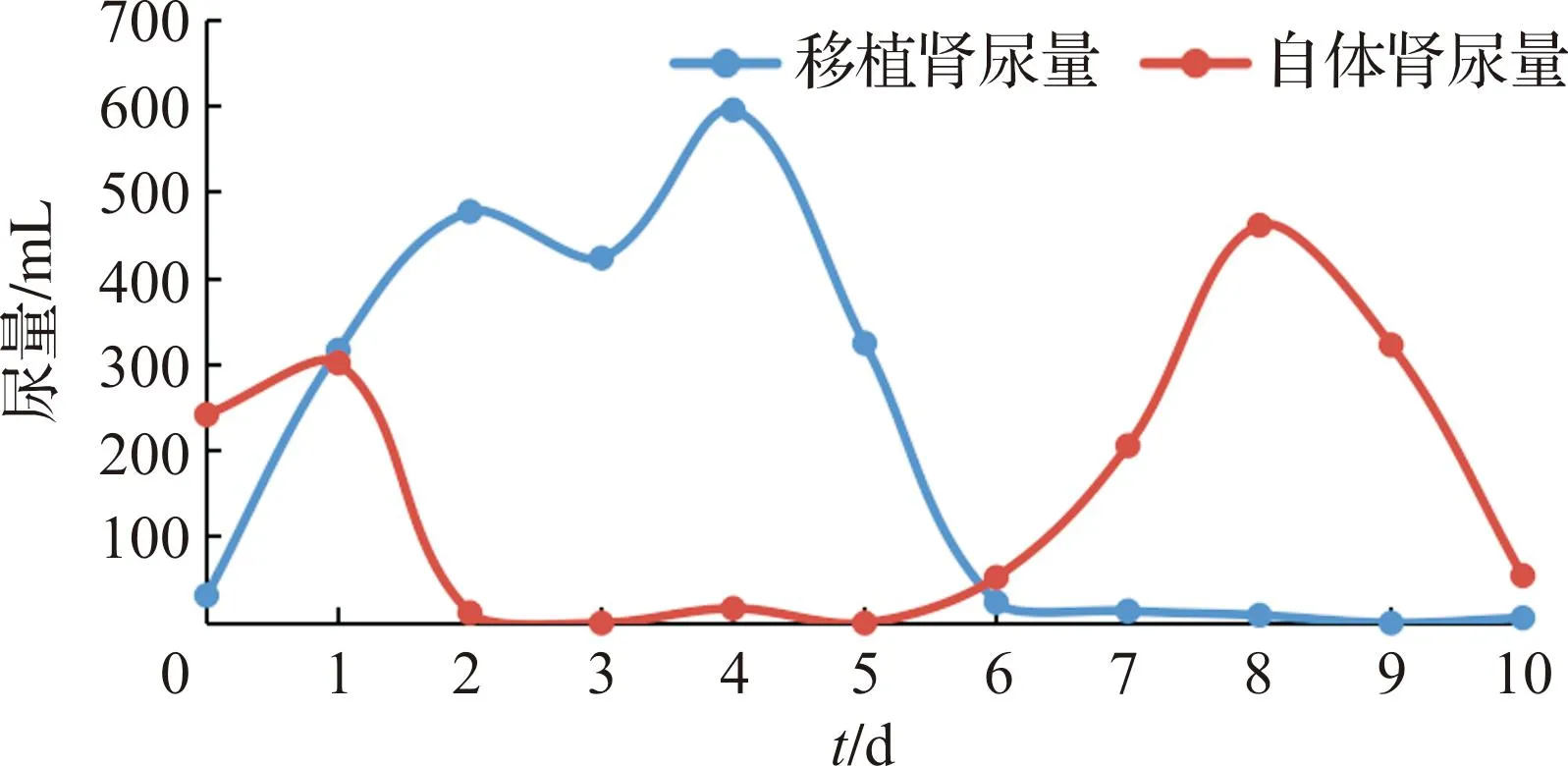
图5 受体猴术后尿液变化情况
3 讨论
异种肾脏移植是解决供肾短缺难题的最有前景的途径,然而目前其面临的最大瓶颈依然是急性排斥反应问题[10-11]。为了探索减缓异种肾脏移植排斥反应的方法,我们借鉴临床上较为成熟的肝肾联合移植的办法,实施了国际首例6-基因编辑猪-恒河猴腹腔异位肝脏移植+原位肾脏移植的研究。研究结果显示异种肝脏移植可以减缓异种肾脏移植排斥反应的发生,延长受体猴的生存时间,为异种肾脏移植向临床推进做出努力。
猪和非人灵长类之间的移植属于非协调性异种移植,当野生猪的器官进入人体后,人体内预存的抗猪抗体可与野生猪的移植物内皮细胞迅速结合并激活补体途径和凝血反应,从而发生超急性排斥反应[12]。目前通过基因编辑技术将猪α-Gal等抗原进行敲除可以基本避免异种移植之间超急性排斥反应的发生,部分受体甚至达到了长期存活[13-15]。随着基因编辑技术的进展,不同组合的基因编辑猪也相继诞生,但其总体基因编辑策略依然是敲除猪表达的针对人类的主要异种抗原以及转入人源性保护基因,除此之外,还有一些调控猪器官生长的基因以及猪源性病毒的基因也在基因编辑策略之中。2020年在窦科峰院士的带领下,我们首次使用基因改造程度最大的猪内源性逆转录病毒敲除猪,即“13-基因编辑”猪作为供体,分别进行了猪-猴异种心、肝、肾移植的临床前研究,对异种器官移植进行了初步的探索[6]。但考虑到较高的基因编辑数量会导致供体猪难以存活,且较高的基因编辑数量并不代表着更好的移植物的存活,因此在本次试验研究中我们使用了目前国际公认的最适宜进行异种移植的6-基因编辑猪,即GTKO/β4GalNT2 KO/CMAH KO/hCD55/hCD46/hTBM 6-基因编辑猪作为供体。
在异种移植中,使用常规的免疫抑制方案往往不能使受体达到长期存活,而加用阻断CD40/CD154共刺激途径的新型药物能大大延长受体的存活时间[16-17]。国内同样有其他异种移植团队尝试使用了CD40单抗或CD154单抗,但其效果并未达到国外异种移植团队的中长期存活。究其原因,可能为不同移植团队使用的CD40/CD154单抗针对的氨基酸表位不同所致,在本次试验中,我们也应用了抗CD40单克隆抗体,初步证实了其有效性,且在维持过程中,也尝试使用了托珠单抗、依那西普等药物,积累了一定的经验。但我们的试验亦未达到中长期存活,目前国外团队使用的CD40或CD154单抗国内已无法购买,因此加大国内CD154单抗的研发势在必行。
多项研究表明,肝肾联合移植术后移植肝可以对移植肾脏起到免疫保护作用,从而更容易使机体维持免疫耐受状态。其详细的机制可能包括以下几个方面:①移植肝内网状中的血管内皮细胞对受者淋巴细的吸附作用;②移植肝合成的MCH-1类分子可中和针对移植肾脏的特异性抗体;③移植肝合成的人类白细胞抗原(human leucocyte antigen,HLA)可中和抗HLA抗体,其还可以和CD8阳性细胞毒性淋巴细胞结合,导致淋巴细胞功能丧失,从而减轻对移植肾脏的免疫识别及攻击作用;④移植肝内的造血细胞移居迁移,可导致供者特异性低反应及微嵌合体的形成,这种嵌合体可以诱导免疫耐受[18]。我们团队在国内率先进行了肾移植联合脾窝辅助性肝移植治疗高致敏肾移植受者[19-20],取得了良好的效果。然而在异种移植中肝肾联合移植是否有同样的作用目前国际尚未开展相关研究。在本试验中,我们通过创新术式对这一问题进行了初步的探究。我们的实验表明,肝肾联合移植开放血流后,移植肾、移植肝血流灌注均良好,且移植肾脏在前5 d灌注良好,血流阻力指数正常,每日尿量达到200 mL以上,移植肾脏尿肌酐水平较高(在移植术后前3 d,每日的尿肌酐水平均在7 000 μmol/L以上),血肌酐水平维持在300 μmol/L左右,证实其未发生明显的排斥反应且发挥肾脏排泄功能,验证了6-基因编辑猪作为供体的可靠性以及以CD40单抗为基础的免疫抑制方案的初步可靠性,初步证实了异种肝肾联合移植试验的可行性。同时我们的实验发现,移植肝脏早于移植肾脏出现血流灌注的减少,提示移植肝脏对移植肾脏发挥了一定的保护作用。但我们的试验仍然无法完全避免排斥反应的发生,在移植术后第5日,移植肾脏出现肿胀,血流阻力指数虽未明显升高,但移植肾尿量开始减少,血肌酐水平也出现了升高,提示移植肾脏发生了排斥反应,因此我们进行了激素冲击和利妥昔单抗冲击,然而并未能逆转排斥反应。与此同时,受体猴血小板水平也一直下降,尤其是在术后第3日,血小板降低至42×109/L,提示虽然移植肾脏在第5日才表现出排斥反应,但可能在第3日,即已经开始出现排斥迹象,国内其他异种移植团队也报道有类似现象[20-22]。凝血功能的紊乱导致的多脏器微血栓形成,移植后期多发感染的出现,最终导致多脏器功能衰竭可能是受体猴死亡的主要原因。
在试验中,我们还观察到如下现象:①供体猪和受体猴肾脏血管口径差异较大,行原位移植具有一定的困难,因此行猪猴移植肾原位移植有必要借助显微缝合技术;②为了尽可能保证移植肾动静脉口径和受体猴肾动静脉口径的匹配,我们选择了体质量与受体接近的供体猪,但小体质量供体猪的移植肾脏术后即使恢复良好,仍不足以使受体猴肌酐保持在正常水平;③本次试验我们保留了受体猴自体肾脏,有意思的是进行了移植术后,移植肾脏尿量逐渐增加,而自体肾脏尿量显著减少,提示移植肾脏血流灌注优于自体肾脏,而在移植肾脏出现排斥反应之后,自体肾脏尿量开始逐渐恢复,因此单纯从观察移植肾脏排斥反应的角度,可以保留自体肾脏,但在移植肾脏出现灌注降低时应及时中止试验,进行移植肾脏的病理检查;④凝血功能障碍依旧是异种移植面临的另一个主要障碍,虽然我们在移植术后早期就进行了凝血的干预,但在排斥反应存在的前提下,这些努力并未取得显著成效,我们在试验终点进行解剖时发现了移植物有广泛微血栓的形成,提示在红细胞、血小板出现进行性下降时即可以进行排斥反应的干预,必要时可以尝试使用依库珠单抗进行血栓性微血管病的治疗。
综上,本次试验通过术式创新,实施了国际首例6-基因编辑猪-恒河猴腹腔异位肝脏移植+原位肾脏移植术,受体猴的生存时间明显延长,但死亡原因仍为排斥反应导致的凝血功能障碍和严重感染。肝肾联合移植在异种移植中具有一定的价值,移植肝脏有助于减轻移植肾脏发生排斥反应,有助于保护移植肾脏的功能。针对异种肾脏移植,排斥反应和凝血功能紊乱的处理依然是影响受体存活时间的关键。未来我们将进一步从减轻排斥反应、缓解凝血功能障碍和预防感染的方向深入研究,为异种肾脏移植向临床推进做出努力。
