心脏异种移植术后感染的研究进展
2024-01-23陈文龙
陈文龙,张 冰
(空军军医大学:1基础医学院学员六大队,2西京医院心血管外科,陕西 西安 710032)
目前,心脏移植是治疗终末期心力衰竭患者最有效的方法。国际心肺移植协会报告指出,大量终末期心力衰竭患者等待心脏移植,而实际接受心脏移植的患者不到4%[1]。既往研究显示我国35岁以上人群有1 370万是心力衰竭患者,但每年仅有数百例心脏移植手术。由于移植供体心脏严重短缺,因此目前正在积极探索将异种心脏移植到人体中。经过几十年的猪-非人灵长类心脏异种移植研究,2022年1月7日,马里兰大学的外科医生将基因编辑的猪心脏移植到一名心脏功能和预期生存时间非常有限的患有终末期心力衰竭的患者体内[2]。
对于缺乏可用供体心脏而漫长等待的终末期心力衰竭患者,异种移植被认为是一种有前途的替代方案,但其成功移植仍然存在许多障碍,包括免疫排斥[3]、凝血功能障碍[4]、异种移植物生长[5]、感染和炎症。由于供体猪基因编辑策略和抗免疫排斥策略的不断改进,延长了非人灵长类心脏移植受者动物的存活时间[6-7]。然而,使用多种类型和高剂量的免疫抑制剂会增加术后感染风险。术后感染常见于同种异体心脏移植和异种移植实验中,严重影响移植物的存活[8-9]。不同类型的病原微生物,包括细菌、病毒和真菌,都可能引起移植后感染,许多研究提出了针对不同病原微生物的预防、监测和治疗策略。近年来心脏异种移植涉及感染并发症的代表性报道见表1。本文结合自身的实践经验和文献调查,总结了异种移植后感染的预防策略,避免术后感染导致心脏异种移植失败(图1)。
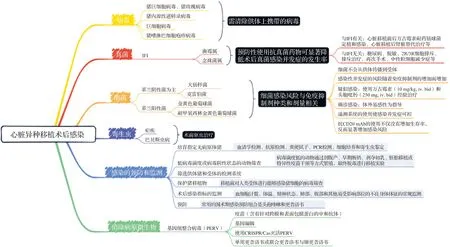
IFI:侵袭性真菌感染;PERV:猪内源性逆转录病毒。图1 心脏移植术后感染与预防策略

表1 心脏异种移植中感染病原体的类型和部位
1 心脏异种移植术后感染致病菌研究现状
1.1 病毒
虽然病毒可能不是同种异体心脏移植术后感染的主要原因,但跨物种病毒感染是目前器官异种移植后最大的障碍之一,也是最重要的微生物感染[21-22]。首次猪-人心脏移植后,在受者体内也发现了猪巨细胞病毒(porcine cytomegalovirus,PCMV)或猪玫瑰病毒(porcine roseolovirus,PRV),进一步证实了猪病毒向宿主的传播[23]。
已发现多种病毒在猪和人类中同时存在,其中猪内源性逆转录病毒(porcine endogenous retrovirus,PERV)最为引人注目。成功的异种移植是否需要PERV灭活仍然存在争议。然而,因为存在肿瘤、白血病和神经退行性变的风险,大多数研究仍然支持在异种移植过程中尽可能避免供体PERV存在的想法[24-25]。PERV-A和PERV-C之间的重组具有高复制率的特点,可导致人类细胞感染。最近的研究表明,这种向人类传播的重组PERV-A/C前病毒只能在极少数小型猪中发现,而未在其他猪中发现,并且将它们分离为能够在人类细胞上复制的传染性病毒极为罕见[26]。PERV对异种移植后受者预后和人类细胞感染的影响问题需要进一步研究。其次,PCMV在人类中是人畜共患病毒。将PCMV/PRV阳性的猪心脏原位移植到狒狒体内,在受体狒狒的所有器官中都检测出这种病毒,与之前的肾脏异种移植实验类似[27-28]。具有PCMV/PRV阳性猪心脏的狒狒受体寿命往往显著缩短,很大程度上是因为抗内皮细胞促进纤维蛋白溶解的促炎作用[28]。其他研究结果表明,巨细胞病毒感染可能导致心脏因心肌细胞纤维化而坏死[14]。许多其他猪源病毒可能对异种移植构成潜在威胁,例如猪嗜淋巴细胞疱疹病毒(porcine lymphotropic herpesviruses,PLHV)和猪圆环病毒(porcine circovirus,PCV)[29-30]。尽管在狒狒受体中没有检测到PLHV,但PLHV-1编码的几个基因对病毒重新激活和复制具有很强的反式激活作用,这些基因在γ疱疹病毒中是保守的,且证明PLHV-1反式激活子上调人类疱疹病毒-8和Epstein-Barr病毒启动子的表达,提示需要清除供体上携带的该病毒[31]。
1.2 细菌
在涉及的各种病原体中,细菌感染一直是同种异体心脏移植术后感染的重要危险因素[22]。细菌感染导致发病率、死亡率、住院时间和相关费用增加。由于术后细菌感染的复杂性、感染部位的多样性以及感染严重程度的个体差异,有必要在围术期预防和监测细菌感染的发生[32]。
已经有许多临床试验调查心脏移植后患者感染相关的并发症。由于免疫抑制和感染预防策略的发展,包括移植前传染病筛查和抗菌药物预防,心脏移植术后患者细菌感染的发生率显著下降[8]。以大肠杆菌、克雷伯氏菌等革兰阴性菌为主,其次为金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌等革兰阳性菌[22,33]。一般来说,异种移植后使用的免疫抑制剂的种类和剂量明显高于同种异体移植,宿主术后细菌感染的风险更大[3]。
与病毒不同,细菌感染不会从供体传播到受体。由于免疫抑制方案的不断更新,很少有心脏异种移植实验中细菌感染术后并发症的报道。1996年,DAVIS等[13]进行异位腹部猪对狒狒心脏异种移植,发现四只受体动物中有两只死于全身感染。其中一项血培养提示革兰阳性和革兰阴性菌血症,而另一项血培养则提示播散性巨细胞病毒伴严重巨细胞病毒肺炎。不久之后,一项研究报告称,环磷酰胺的副作用导致在一项试验中的10名心脏移植受者中有2名出现严重的术后感染并发症(肺炎和全血细胞减少症)并最终死亡[15]。2006年,BYRNE等[12]进行了异位腹部猪到狒狒心脏异种移植,发现感染性并发症的风险随着免疫抑制剂的增加而增加。在63只接受移植的狒狒中,有16只因败血症死亡,其中一半是由细菌引起的。对疑似感染进行经验性治疗,使用万古霉素(10 mg/kg,静脉注射,2次/d)和头孢吡肟(250 mg,静脉注射,2次/d)。已确诊感染的治疗以体外易感性为指导[12]。遥测系统的使用可以对免疫抑制方案进行有效的实时监测和更新,从而使术后细菌感染并发症变得越来越可控[34]。据报道,心脏异种移植受者可能由于免疫力低下而受到细菌感染,如克雷伯氏菌感染;但移植器官的功能并未受到明显影响,使用抗生素仍可有效控制感染[14]。近年来心脏异种移植后最明显、最严重的感染并发症出现在2015年的一项研究,其中4/7的移植受者出现感染相关并发症。其中包括肠道粪便菌群引起的菌血症、肺炎和传染性腹膜炎以及1例巨细胞病毒引起的肺炎。本研究未使用预防性抗生素,这可能是移植感染的一个因素。此外,研究表明抗CD20mAb的使用不仅没有增加生存率,反而显著增加了感染风险[16]。非系统性细菌感染也可能导致致命的结果。在一项研究中,异种心脏移植受者出现了由大肠杆菌引起的纵隔炎,导致狒狒的切口和胸骨被感染,最终只活了14 d[17]。
空军军医大学西京医院心血管外科于2022年10月进行了猪-恒河猴异位心脏异种移植实验,受体猴在存活的第20日死亡。此前痰液、腹水、胃液溶血葡萄球菌培养均为阳性,有明显感染并发症。根据感染的初步分析,这对移植受者动物的生活产生了严重的负面影响。综上所述,我们认为虽然目前异种移植感染是可控的,但由于细菌感染的种类不同、受者耐受程度不同等因素,感染可能会加重炎症、免疫排斥反应、凝血系统紊乱和其他损伤。术后细菌感染的监测和管理对于心脏异种移植的结局仍然至关重要。
1.3 真菌
在接受实体器官移植的患者中,侵袭性真菌感染(invasive fungal infections,IFI)是一种与不良预后相关的令人恐惧的事件。心脏移植后第一年内IFI的累积发生率为3.4%~8.6%[35]。最常见的感染是由曲霉属或念珠菌属引起的[36]。尽管IFI相对罕见,但它们具有显著的发病率和死亡率,需要及时采取多学科方法进行诊断和治疗[37-38]。既往研究证实,预防性使用抗真菌药物可显著降低术后真菌感染并发症的发生率[36]。一项为期7年的单中心研究表明,IFI与心脏移植前后万古霉素耐药肠球菌定植和感染、心脏移植后肾脏替代治疗、抗胸腺细胞球蛋白诱导和抗体介导的排斥反应有关,与糖尿病、脱敏、2R/3R细胞排斥、排斥治疗、再次手术、中性粒细胞减少症或巨细胞病毒感染没有关联[39]。
尽管在异种移植物实验中缺乏关注真菌感染的报道,我们认为实现有临床意义的异种移植存活所需的免疫抑制水平与细菌和真菌感染并发症的水平相关。ABICHT等[17]进行了心胸异位移植实验,21名移植受者中的1名出现了全身曲霉菌感染。
1.4 寄生虫
在心脏异种移植研究中,寄生虫并发症很少见,大多数移植供者都接受了术前驱虫治疗。先前的一项研究报告了1例心脏移植后狒狒感染巴贝斯虫病的病例,血涂片检查发现红细胞色素减少和多毛症,表明发生溶血性贫血,2 d后血涂片显示环状提示疟疾[20]。巴贝斯虫病是异种移植研究人员应该注意的众多疾病之一,不仅因为其人畜共患特征,还因为它能够在宿主体内保持潜伏状态,直到免疫系统被充分抑制而引起感染的迹象。
2 心脏异种移植术后感染的预防和监测
目前,已采取多种有效的方法来预防和监测感染。创新医学模型中心(德国慕尼黑)开发了一套监测工具来检测多种病原微生物的存在,包括血清学检测、抗原检测、粪便拭子、PCR检测、细胞培养和寄生虫鉴定[40]。为了培育指定的无病原体猪作为异种移植给临床患者的供体,美国明尼苏达州明尼阿波利斯市Spring Point项目的一个新设施饲养了剖腹产、剥夺初乳的仔猪。这些动物的多种微生物检测呈阴性,包括病毒、细菌、真菌、寄生虫和节肢动物[41]。然而,考虑到迄今为止的异种移植试验的结果,可能没有必要设计这种昂贵的无病原体猪。另一家机构对用于胰岛细胞移植的猪进行了类似的筛选,使用基于PCR的方法和免疫学方法、感染测定和透射电子显微镜对三十多种病毒进行了筛查。值得注意的是,针对一些猪病原微生物的有效疫苗已经问世并已得到使用[42]。通常使用上述方法对供体猪进行低病毒滴度或病毒阴性状态的动物筛查。病毒滴度低的动物通过剖腹产、早期断奶、剥夺初乳、胚胎移植或特异性疫苗干预等方式繁殖,最终脱毒进行移植实验[43]。一旦病毒被消除,动物应隔离,以避免新发感染或再次进入。应使用灵敏的检测方法,在消除病毒前、中和后对动物进行筛查。
然而,移植后病毒可能会再次激活,在移植的猪器官中复制不受限制,这可能会伤害受体。用于筛选供体猪和受体的检测系统包括基于PCR、细胞或免疫学方法,以及样品生成、样品制备、样品来源、采样时间、必要的阴性和阳性对照[43-44]。使用PCR可以轻松检测PCMV/PRV。在成年动物中,PCR无法检测到处于潜伏期的病毒。然而,抗体的检测是检测感染的间接方法[45]。基于这些方法,应选择一种策略来筛查年轻和年长动物的PCMV/PRV[45]。值得注意的是,PCMV/PRV在生产猪和野猪中广泛分布[46]。
尽管由于受体缺失或与猪细胞代谢不相容,人类微生物感染猪心脏移植物的风险可能较低,但仍有一些人类病毒可以感染猪细胞。人巨细胞病毒、人腺病毒、柯萨奇病毒-B5、丙型肝炎病毒和人流感病毒能够感染猪细胞[47]。目前,尚不清楚这些病毒是否可能损害异种移植物。在受体患者中,移植诱导的免疫反应和应用免疫抑制药物预防移植排斥可能会刺激病毒复制增强。为了保护猪移植物,可以在移植前对人类受体进行能够感染猪细胞的病毒筛查;然而,阳性检测的后果仍不清楚。如果可能的话,临床异种移植后可能需要对人类病毒感染进行筛查,以实现快速治疗。这种情况类似于人类同种异体移植受者的感染。西京医院心血管外科前期进行的异种移植实验中,选择了PCR试剂盒的方式对供体PCMV、PERV、PCV等高携带率的病毒进行了检验,同时在移植术后每2 d检测1次血液中病毒的感染情况以明确感染状态。
对于细菌、真菌和寄生虫,术后感染指标的监测至关重要。这些指标包括对血细胞计数、体温、精神状态、肺部、腹部和其他易受影响部位的不良身体体征的常规监测。如果上述检查有异常,还需进一步进行分泌物和血液培养检查,以确定是否存在病原微生物感染。这些方法通常可用于尽早检测和控制感染。在预防方面,最新的心脏异种移植研究通常采用抗生素和抗病毒药物进行预防性使用,最常用的围术期感染预防组合是头孢唑啉和更昔洛韦(表2)。必须对选定组织的微生物特异性进行阳性和阴性对照检测,包括:①对必须避免的微生物进行定性汇编,在检测呈阳性的情况下终止移植;②定量记录实际微生物负荷(生物负荷)和规格[48]。应严格设计异种细胞疗法的采购和加工,避免引入外部微生物和猪的特定病菌。或者可以使用抗生素减少生物负荷的方法。然而,在无菌测试过程中,消除不应通过抑制对照培养基中的生长而导致细菌被掩盖和假阴性结果。微生物控制应表明细菌已被识别,并且通过对供体动物的严格饲养和测试以及在允许异种移植物进行移植之前对采购的组织进行微生物控制检查来排除细菌。抗生素耐药微生物的存在,例如耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌、耐β-内酰胺酶以及产生毒素的微生物,如铜绿假单胞菌、A族链球菌、金黄色葡萄球菌、梭菌和芽孢杆菌,以及酵母和丝状真菌,导致测试组织被丢弃以保护受者[48]。
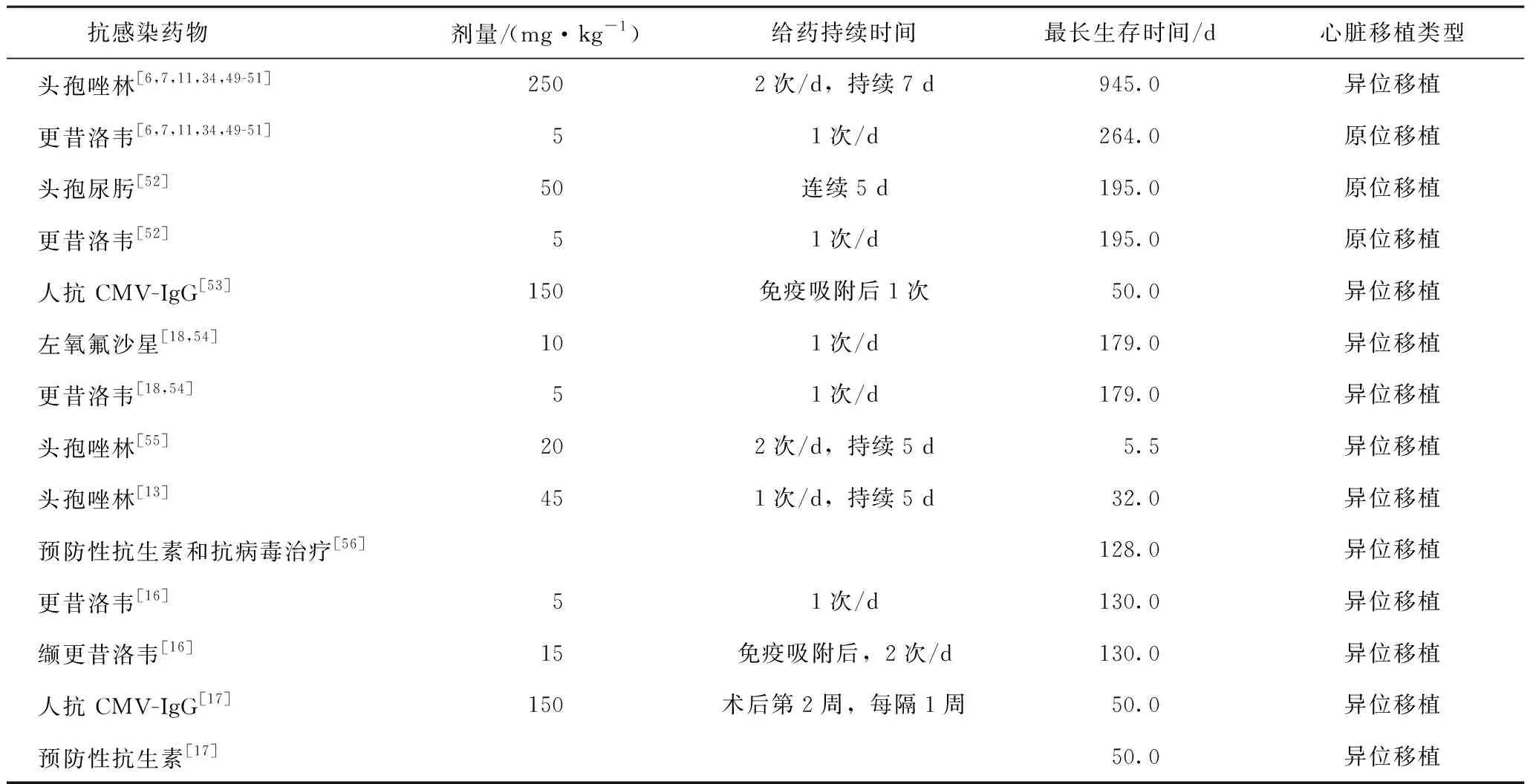
表2 预防围手术期感染的支持方案
3 消除病原微生物
虽然大多数猪病毒可以使用上述策略消除,但整合到猪基因组中的PERV却不能进行类似的处理。PERV-A和PERV-B是基因组整合的,而PERV-C可能存在于许多猪体内。因此,已经制定了抗传播策略来保护接受者。最广泛使用的疫苗含有针对跨膜和表面包膜蛋白(PERV的跨膜包膜蛋白p15E的重组胞外域和整个表面包膜蛋白gp70)的中和抗体[57-58]。然而,这些疫苗的有效性还需要进一步探索。基因编辑是灭活基因组中PERV的有效方法。然而,由于基因组整合的原病毒的数量可能达到六十多个,因此存在这些大量基因组插入可能破坏基因组并杀死细胞的风险,正如使用锌指核酸酶时观察到的那样[59]。使用CRISPR/Cas灭活PERV更为成功[60]。
事实上,已有几项关于猪对非人灵长类动物心脏异种移植的研究发表,受者生存期较长的研究随后在术后支持治疗阶段预防性使用抗病毒药物,其中大多数是单用更昔洛韦或联合更昔洛韦与缬更昔洛韦[7,16]。人类抗巨细胞病毒抗体也已用于多项研究,并取得了有希望的实验结果[53]。
细菌、真菌和寄生虫感染并发症的治疗步骤与同种移植的步骤基本相同。如果高度怀疑感染,应尽快改用高强度广谱抗生素并进行血液和分泌物培养。培养若呈阳性,应对特定病原体进行药敏试验,根据药敏试验结果选择敏感抗生素进行病因治疗,空军军医大学西京医院心血管外科在2022年6-基因猪-恒河猴心脏异种移植实验中,术后引流液、胃液、口腔分泌物中均培养出溶血葡萄球菌,根据药敏试验结果做出了针对性的治疗,效果良好,感染得到明确控制。
4 讨论
随着目前心力衰竭发病率和患病率显著上升,给社会和家庭造成巨大经济负担,我们应当积极开辟新的治疗靶点[61],但是我们仍然需要为已经进展为终末期心衰患者考虑逆转结局的可能。近十年来,实体器官异种移植研究迅速发展并应用于临床。然而,首例猪-人心脏移植受者仅存活2个月,显然异种移植仍有许多障碍需要克服。改进的免疫抑制方案、高效及时的监测方法、基因编辑技术的进步以及术前供体筛选方法的应用,使得心脏异种移植后感染并发症的发生率显著降低,并且大多数移植后感染是可控的。然而,感染会加剧炎症反应,破坏人体或移植器官,激活免疫排斥反应,使生命体征恶化,从而影响移植的存活时间。改善围手术期感染预防和术后感染治疗,同时平衡免疫抑制和感染是未来研究需要解决的挑战。当然,异种移植走向临床仍然面临其他挑战,包括伦理等因素的影响[62],但是我们仍然要首先攻克技术难关,保证更早地挽救终末期心力衰竭患者的生命。
