猪-恒河猴心脏异种移植的围术期受体感染预防及治疗策略总结与分析
2024-01-23周晔农杨秀玲吕向妮段维勋刘金成金振晓
周晔农,张 冰,陈 涛,杨秀玲,金 艳,吕向妮,郭 红,易 蔚,赵 荣,段维勋,刘金成,金振晓
(空军军医大学西京医院心血管外科,陕西 西安 710032)
心脏移植是目前治疗终末期心力衰竭最有效的方法。根据国际心肺移植学会的调查,尽管有许多心力衰竭患者需要接受心脏移植,但实际上只有极少数(仅4%)的患者最终能够获得这一手术机会[1],在中国,每年等待心脏移植手术的患者与成功接受移植手术患者的比例为30∶1[2]。心脏异种移植是解决供体短缺的重要手段[3]。2022年1月,马里兰大学团队成功进行了世界首例猪-人心脏异种器官移植手术,且受者在手术后存活了60 d[4]。2023年9月,他们又进行了第二例猪-人心脏异种移植手术,目前受者仍存活[5]。
尽管异种移植被认为是心脏移植的一种有效替代方法,但障碍重重,需要克服的困难包括免疫排斥[6]、凝血功能障碍[7]、异种移植物生长[8]、感染和炎症[9]等。随着基因编辑技术、免疫抑制方法以及术后管理策略的不断改进,心脏异种移植受体的存活时间显著延长[10-11]。然而在心脏同种异体移植和异种移植实验中,术后感染很常见,并且显著影响移植物存活率[12-13]。不同类型的病原微生物,包括细菌、病毒和真菌,都可能成为移植后感染的病原体。本研究围绕2022年空军军医大学西京医院开展的1例基因编辑猪-恒河猴异种心脏移植实验术后受体猴的临床表现、检查检验指标等数据,总结感染发生的情况、治疗措施及预后转归,为未来的异种移植研究提供经验。
1 材料与方法
1.1 材料
供体为GTKO/β4GalNT2 KO/CMAH KO/hCD55/hCD46/hTBM基因编辑的雄性小型巴马猪,基因编辑猪是通过体细胞核移植产生的[10]。将表达重组人蛋白的转基因载体转染到培养的猪胚胎成纤维细胞中,其中hCD55和hCD46调节补体途径,hTBM预防凝血功能障碍。供体猪敲除主要糖类抗原半乳糖α-1,3-半乳糖,另外两个异种抗原N-糖基神经氨酸和Sda被CRISPR/Cas9诱导的插入和/或缺失突变基因敲除,这些基因编码催化它们合成的酶,即CMAH和β4GalNT2。供体猪体质量7 kg,受体为雄性恒河猴,体质量10 kg。
1.2 方法
1.2.1 异种异位心脏移植 采用腹腔异位心脏移植的手术方法。术前1周实验动物驱虫处理,术前12 h禁食水并清洗全身。供体猪麻醉后从剑突到柄的中线切口打开其胸部。全身肝素化,结扎下腔静脉和上腔静脉,阻断静脉回流,切开下腔静脉、左上腔静脉和左心房。主动脉根部插入冷灌针,阻闭升主动脉并灌注4 ℃冷组氨酸-色氨酸-酮戊二酸停搏液,同时将碎盐水冰敷在心包上。将心脏腔静脉、左心房、肺动脉和主动脉分离,取出心脏,留下足够长的大血管进行吻合。心脏从胸腔取出后,左心房和腔静脉开口被封闭。受体猴麻醉后,通过中线切口打开其腹部,暴露并分离出肾动脉开口下方腹主动脉和下腔静脉。肝素化后,钳夹后,行腹主动脉切开和下腔静脉切开。供体主动脉与受体腹主动脉端侧吻合,供体肺动脉与受体下腔静脉端侧吻合。吻合后,大血管及吻合口排气并开放血流,静脉给予甲强龙20 mg/kg,同时给予碳酸氢钠、利多卡因、100 mL/L葡萄糖酸钙、硫酸镁注射液,直至心功能恢复和窦性节律恢复。
1.2.2 围术期免疫抑制方案 受体猴的免疫抑制方案包括抗胸腺细胞球蛋白、αCD20抗体(利妥昔单抗)用于T细胞和B细胞抑制;阿巴西普用于阻断CD28/B7共刺激信号通路;眼镜蛇毒因子用于抑制补体激活;托珠单抗和依那西普用于抑制炎性因子,他克莫司(维持5~25 μg/L的血药浓度)用于抑制淋巴细胞,甲泼尼龙用于抗炎和抗急性排斥反应。受体持续微量泵注射肝素,维持活化凝血时间在基线水平的2倍,持续至受体死亡。
1.2.3 围术期感染预防方案 给予更昔洛韦预防病毒感染,抗真菌感染选择注射用醋酸卡泊芬净。术前30 min给予头孢哌酮钠舒巴坦钠0.5 g,术后继续给予头孢哌酮舒巴坦钠持续6 d预防术后细菌感染。根据受体病情、药效、用药时长调整抗生素的使用,具体给药剂量及详细调整过程见结果部分。
1.2.4 术后重症监护 受体猴手术结束42 min后拔除气管插管,重症监护护士和医生在术后20 d提供重症监护级别的监测和管理。限制受体肢体活动,并持续监测呼吸、血压等生命体征。每日早晨抽血,测定全血细胞计数、炎症因子及每日进行引流液、胃液、口鼻腔分泌物、腹腔积液等液体的细菌培养,用于监测感染。受体猴从术后第4日开始每日进行胸部X射线片检查,用于监测是否出现肺部感染,并根据胸片情况对肺部护理进行调整,如加强翻身、拍背、雾化、吸痰等护理措施预防肺部炎症进展。
1.2.5 统计学分析 所有生成的数据,包括线形图,使用GraphPad Prism 9.0软件进行处理和分析。
2 结果
2.1 总体结果和结局
受体猴于术后当日拔除气管插管,存活并维持供体心脏功能持续20 d,期间受体猴一直处于束缚卧位,给予重症监护,最终因凝血功能紊乱死亡。
2.2 术后受体体征及临床表现
2022年10月16日完成手术后,平均每0.5 h记录一次体温,并在次日早8∶00记录前一日最高体温,将每日最高体温形成折线图(图1),受体没有出现过极低体温(低于36.0 ℃)或者极高体温(超过38.5 ℃),即使体温超过38.0 ℃也在一般物理降温后当日恢复正常,从体温来看未见受体出现明显感染症状。受体于术后第6~8日出现偏黄色痰液,经过加强肺部护理和吸痰护理后,症状有所改善。
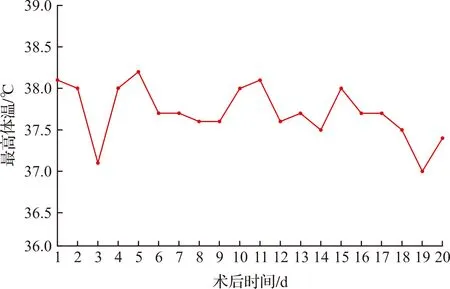
图1 术后受体体温随时间变化曲线图
2.3 术后受体血细胞分析和血清学指标
受体每日进行血细胞分析和血清炎性因子的浓度检查来初步评估是否存在感染。如图2所示,受体白细胞、中性粒细胞和单核细胞波动明显,但并未发生极度升高的情况,其中10月29日(术后第13日)全系升高最明显,可能由于前一日受体接受了异体猴全血输注的原因。同时,因为受体早期发生凝血功能紊乱,失血情况较为明显,通过血细胞分析可能无法准确判断感染的情况。因此进一步分析了受体每日血清炎性因子水平变化(图3),受体C-反应蛋白和降钙素原在术后均处于极低水平,未提示感染的发生。
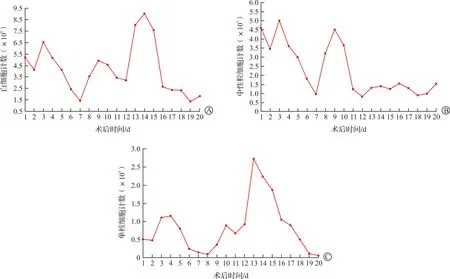
图2 术后受体白细胞计数(A)、中性粒细胞计数(B)和单核细胞计数(C)随时间变化曲线图

图3 术后受体C反应蛋白(A)和降钙素原(B)的血清浓度随时间变化曲线图
2.4 术后受体胸部X射线检查
受体从术后第4日开始每天进行一次床旁胸部X射线检查,结果如图4所示,10月25日(术后第9日)胸片显示右肺中下部斑片状高密度影,我们加强肺部护理,对受体进行雾化、祛痰、间歇吸痰等治疗。术后第10日胸片显示肺部高密度影减少。而术后第12日和第13日胸片显示右侧中部肺野大片斑片状高密度影,经加强肺部护理和治疗至术后第20日,受体的胸片未见明显的感染征象。
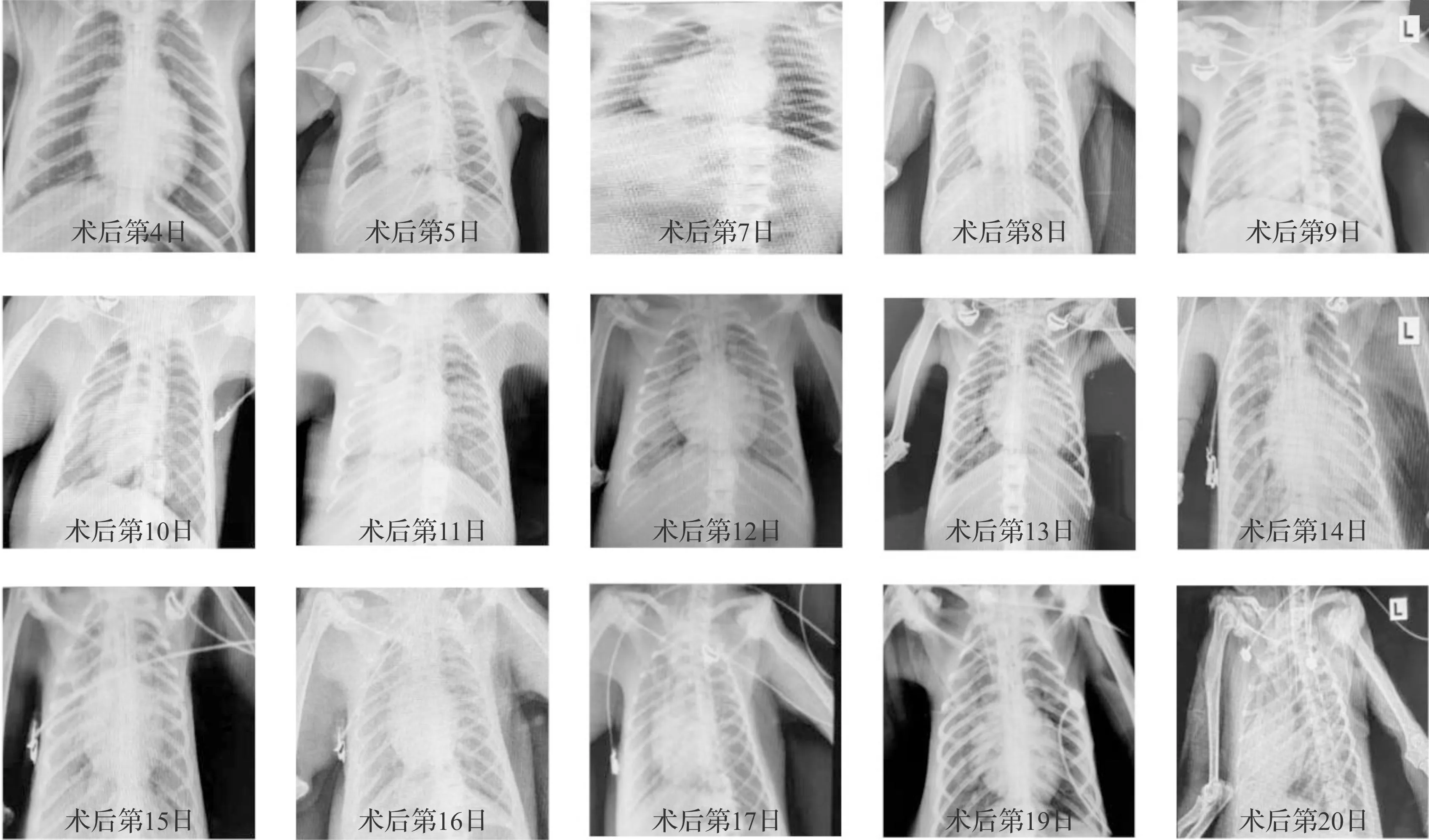
图4 术后受体胸部X射线图片汇总
2.5 术后受体血液及分泌物细菌培养
当出现可疑感染征象(肺部斑片状阴影、黄色痰液、体温超过38 ℃)时,医护人员会对受体的血液、痰液、口腔分泌物、腹水、引流液、胃液等进行细菌培养检查。在10月30日返回的化验结果中显示,10月28日(术后第12日)采集的腹腔引流液、10月29日(术后第13日)采集的胃液、10月30日(术后第14日)采集的口腔分泌物和腹水中均培养出了溶血葡萄球菌,提示存在细菌感染的证据,但感染原发灶未知。
2.6 术后受体抗感染药物调整过程
本次围术期预防用抗生素选择头孢哌酮钠舒巴坦钠,术前30 min给药。术后抗病毒药物选择更昔洛韦,每2 d给药1次,每次给药12.5 mg。抗生素依然使用头孢哌酮钠舒巴坦钠,术后每8 h给药1次,每次给药0.5 g静脉滴注。术后第6日出现黄色痰液后,由于未出现细菌培养阳性结果且头孢哌酮钠舒巴坦钠使用时间较长,根据经验更换为哌拉西林他唑巴坦,每8 h给药1次,每次给药1.5 g静脉滴注。由于术后第9日和第11日肺部X射线检查发现斑片状阴影,为对抗可能出现的肺部感染和及时控制病情进展,术后第11日将抗生素升级为注射用美罗培南,每8 h给药1次,每次给药0.1 g微量泵注射(3 h注射完毕),并加用抗真菌药物卡泊芬净,每日1次,每次给药25 mg微量泵注射(2 h注射完毕)。10月30日根据腹腔引流液细菌培养药敏实验结果,本次受体感染的溶血葡萄球菌对利奈唑胺敏感,因此抗生素更换为利奈唑胺葡萄糖注射液,每12 h给药1次,每次给药0.1 g静脉滴注,直至受体死亡。
3 讨论
在异种移植实验和临床应用中,医生们往往关注的是受体术后感染情况,特别是跨物种病毒感染。首次进行猪-人心脏移植后,在受者体内检测到猪巨细胞病毒的存在,证实了猪源病毒向宿主传播的可能性[14]。在本研究中,我们主要关注大量使用免疫抑制剂相关的术后受体病原体感染情况。在可能感染的病原体种类中,细菌感染一直是同种异体心脏移植后的一个重要危险因素[15],有必要采取措施预防和监测围手术期细菌感染的发生[16]。
由于免疫抑制和感染预防策略的不断进步,包括在移植前进行传染病筛查和采用抗菌素预防,心脏移植后患者细菌感染的发生率显著下降[12]。革兰阴性菌,如克雷伯氏菌和大肠杆菌,是最常见的感染病原体;其次是革兰阳性菌,如耐甲氧西林金黄色葡萄球菌和金黄色葡萄球菌[15-17]。一般来说,异种移植后使用的免疫抑制剂的种类和剂量明显高于同种异体移植,受体术后细菌感染的风险更大[6]。1996年,DAVIS等[18]进行了异位猪-食蟹猴心脏异种移植,在4只受体动物中,有2只因全身感染而死亡。具体而言,一只食蟹猴的血液培养结果显示革兰阳性和革兰阴性菌血症,而另一只食蟹猴的血液培养结果提示存在播散性巨细胞病毒感染,并伴有严重的巨细胞病毒肺炎。随后不久,有研究团队将转基因猪的心脏原位移植到狒狒受体中,结果显示,10只狒狒中有2只出现严重的术后感染并发症(肺炎和全血细胞减少症),最终导致死亡[19]。2006年,BYRNE等[20]进行了转基因猪-狒狒的腹部异位心脏移植研究。他们发现,随着免疫抑制剂种类和剂量的增加,感染并发症的风险也增加。在接受移植的63只狒狒中,有16只因败血症死亡,其中一半的败血症是由细菌引起的。后来,随着术后监测手段的改进以及抗生素研发的进步,术后感染变得更加可控[21]。在本研究中,我们对术后感染相关指标进行了监测,发现在术后第14日,受体的引流液、胃液、口腔分泌物和腹腔积液中都培养出了相同的细菌——溶血葡萄球菌,这表明受体发生了系统性感染。
溶血葡萄球菌发生侵袭性感染主要引起化脓性炎症。葡萄球菌可通过多种途径侵入机体,导致皮肤或器官的多种感染,甚至感染败血症[22]。但是在本研究中,受体血液中并没有培养出溶血葡萄球菌,而且直到受体死亡也没有出现明显的感染症状。因此我们认为,虽然移植术后明确发生了细菌感染,但细菌感染并不是主要致死原因,但其是否推动了受体整体情况恶化需要进一步研究。近年来异种心脏移植术后最明显、最严重的感染并发症是2015年的一项研究,7只狒狒中有4只出现感染相关并发症,其中包括由肠道粪便菌群引起的菌血症、肺炎和感染性腹膜炎,以及1例巨细胞病毒引起的肺炎。此外,研究表明使用抗CD20单抗不仅不能提高生存率,还会显著增加感染风险[23],但是为了抑制免疫排斥反应,目前抗CD20单抗几乎是在异种移植过程中必须使用的药物。非全身性细菌感染也可能导致致命的结果。在一项研究中,心脏异种移植受体发生由大肠杆菌引起的纵隔炎,严重影响受体寿命[24]。这些结果提示我们,无论术后细菌感染病情是否可控,我们仍要积极预防并遏制其发生。
本研究中,我们从多方面对受体感染进行监测,如胸部放射检查、血细胞分析、血清炎性因子等,但是都存在特异性不足的问题。胸片检查的确出现了肺部炎症的征象,但是也可能是因为心脏功能差或者长时间卧床出现的肺水肿或渗出;血细胞分析容易受到失血、输血的影响;血清炎症因子在一定程度上能够反映感染的发生,多项研究已经证实C-反应蛋白和降钙素原在一定程度上可以用来诊断感染的发生,并且与感染的预后存在极大的相关性[25-26]。然而需要注意的是,手术或异种移植本身所引起的全身性应激可能也是导致炎症因子升高的原因之一。在本研究中,我们观察到移植术后受体的白细胞、中性粒细胞和炎性因子没有明显升高的情况。此外肺部不良征象也通过加强肺部护理、实时的监测和积极的治疗策略调整得到控制和逆转。
本中心从研究结果中总结了宝贵的经验,并制定了下一步实验的感控规划:首先,与专业生物检测机构合作,对供体猪和受体猴进行术前病毒、细菌检测及围术期动态监测;其次,制定参与基因编辑猪-猴异种移植的工作人员防护标准和应对暴露事件后的紧急处理预案,以及建立科学且周密的围术期感染控制标准和可执行性强的感染控制管理措施,包括抗生素的使用;最后,定时对受体猴的血液、体液、分泌物及各种管道、物体表面、工作人员手、空气进行监测和培养。异种心脏移植围术期积极预防和控制感染是器官移植手术的重要环节之一,通过制定科学、周密的感染控制标准,实施集束化规范化感控管理措施,制定参与异种移植工作人员防护标准与发生暴露后的紧急处置预案,为今后开展异种心脏移植临床试验提供依据和借鉴。
