Pink1通过调控Drp1参与高氨诱导线粒体异常分裂的机制研究
2024-01-23拜云虎王全晖吴菲菲王亚云杨雁灵张春旭
拜云虎,王全晖,岳 玮,谢 峻,吴菲菲,王亚云,杨雁灵,张春旭
(1解放军联勤保障部队第九八八医院普外科,河南 郑州 450007;2空军军医大学西京医院肝胆胰脾外科,陕西 西安 710032;解放军联勤保障部队第九八八医院:3全科医学科,4检验输血科,河南 郑州 450007;5空军军医大学基础医学院教学实验中心,陕西 西安 710032)
肝性脑病(hepatic encephalopathy,HE)是由急性或慢性肝病或门体分流引起的脑功能障碍[1]。在全球范围内,慢性肝病约影响8.44亿人,每年造成约200万人死亡,其中100万人与肝硬化及其并发症有关,而HE发生率占肝硬化患者的30%~40%[2]。血液循环中氨含量的升高被认为是肝硬化患者HE的一个关键致病因素[3-4]。因此,降低血氨水平是改善HE的重要措施,也是当前治疗HE的主要手段之一。目前对于高氨损伤中枢神经的具体机制仍然不清楚,因此,进一步研究其相关机制为临床提供潜在的药物靶点具有重要意义。
氨是在氨基酸分解代谢、嘌呤分解和肠道微生物代谢等生物过程中产生的一种细胞毒性代谢物。既往大量研究表明高氨导致线粒体氧化功能障碍、ATP合成减少、自由基生成增加等[5-6]。但目前鲜有关于高氨状态时线粒体形态的变化与自噬之间关系的报道。由于脑组织对能量需求较高,脑内富含线粒体,且线粒体参与调节各种重要的细胞过程,包括代谢、ATP生成和炎症激活。线粒体形态的变化会随着细胞环境的变化而发生分裂或融合,线粒体分裂和融合的平衡对脑内稳态至关重要[7]。线粒体通过不断的分裂和融合,改变自身的形状、大小和数量,以满足细胞的代谢需求[8]。尽管线粒体分裂对脑内神经元和非神经元细胞的功能性吞噬很重要,但过度的线粒体分裂会导致各种神经系统相关疾病,包括缺血-再灌注损伤、神经退行性疾病帕金森病和阿尔茨海默病。线粒体自噬蛋白Pink1是清除受损线粒体的重要蛋白之一,而过度的自噬也会损伤线粒体,导致线粒体功能形态的异常。本课题组前期研究发现在肝损伤诱导的HE中,脑组织内线粒体分裂相关蛋白Drp1以及自噬蛋白Pink1表达增多[9-10],但是体外高氨状态与线粒体形态之间的关系及机制仍然不清楚。本研究旨在探讨高氨诱导线粒体异常分裂和功能障碍的分子机制以及Pink1对线粒体裂变的调节作用。假设高氨诱导线粒体自噬Pink1以及分裂蛋白Drp1表达增多,线粒体出现碎片化和功能障碍,而减少Pink1表达可减缓高氨诱导的线粒体功能障碍的进展。本研究为高氨诱导神经细胞损伤提供了可能的分子机制,为治疗高氨血症或HE提供理论依据和潜在治疗靶点。
1 材料与方法
1.1 材料
SHSY5Y细胞购自和元生物技术(上海)股份有限公司。CCK-8试剂盒(CA1210)购自北京索莱宝生物科技有限公司;增强型ATP检测试剂盒(50027)购自上海碧云天生物技术有限公司;Pink1的慢病毒购自和元生物技术(上海)股份有限公司。抗体:Pink1(ab23707,Abcam,英国),Parkin(PA5-13399,Invitrogen,美国),Drp1(9570S,CST,英国),β-actin(Abclonal,中国);免疫荧光以及Western blotting二抗均购自Abbkine生物有限公司(中国)。NH4Cl(213330,Sigma,美国)。F-12培养基(C11765500BT,Gibco,美国),MEM培养基(C11095500BT,Gibco,美国),FBS(10099-141,Gibco,美国)。慢病毒pCLenti-U6-shRNA(Pink1)-CMV-Puro-WPRE购自和元生物技术(上海)股份有限公司。
1.2 方法
1.2.1 SHSY5Y细胞培养 将SHSY5Y细胞培养基配置为:420 mL/L MEM+420 mL/L F-12+150 mL/L胎牛血清+10 mL/L双抗,在37 ℃,50 mL/L CO2培养箱中培养,待细胞融合度达到80%时传至6孔板或96孔板中用于后续实验。
1.2.2 NH4Cl处理 高氨模型的制备方法:SH-SY5Y细胞配成1×108/L细胞悬液,接种于96孔板,待贴壁后,给予以培养基为溶液配置后的不同浓度(1.0、2.5、5.0、10.0 mmol/L)的NH4Cl(紫外消毒,过滤),Sham组内加入不含NH4Cl的培养基,余均相同,之后分别在培养箱中进行培养24、48 h,待做后续处理。
1.2.3 细胞凋亡检测 细胞凋亡-Hoechst检测试剂盒购自碧云天(C0003,中国),SH-SY5Y细胞接种于12孔板,待贴壁后,给予以培养基为溶液配置后的不同浓度(0、1.0、2.5、5.0、10.0 mmol/L)的NH4Cl,Sham组内加入不含NH4Cl的培养基,余均相同,之后分别在培养箱中培养24 h后弃培养基,加入0.25 mL固定液,固定10 min,使用PBS清洗3次,加入0.25 mL Hoechst染色液,染色5 min,随后使用PBS清洗3次,加入荧光封片剂于荧光显微镜下观察。
1.2.4 感染慢病毒 将SH-SY5Y细胞配成2×108/L细胞悬液,细胞按30%汇合度接种到12孔板。每孔铺1 mL,12 h细胞贴壁后感染慢病毒。感染12~20 h后换培养基,每孔加入1 mL新鲜的培养基。72 h后共聚焦显微镜下拍照。
1.2.5 CCK-8检测 在96孔板中配置100 μL的细胞悬液(细胞量为1×108/L)。将培养板在培养箱预培养24 h(在37 ℃,50 mL/L CO2的条件下);细胞贴壁后更换培养液为不同浓度的NH4Cl培养基,浓度分别为0、1.0、2.5、5.0、10.0 mmol/L;分别孵育24、48 h后更换培养基,用新鲜培养基洗涤2次,然后向每孔加入10 μL CCK-8溶液;加入CCK-8后将培养板在培养箱内分别孵育2 h,用酶标仪测定A450 nm值。
1.2.6 蛋白水平检测 提取细胞蛋白,采用BCA法蛋白定量、SDS-PAGE电泳后,孵育多克隆兔抗Drp1(1∶1 000),兔抗Pink1(1∶1 000),兔抗Parkin(1∶1 000),鼠抗β-actin(1∶5 000),4 ℃过夜孵育;第2日孵育相应二抗(1∶5 000),加入ECL液发光检测并拍照保存数据。以β-actin为内参进行半定量分析。
1.2.7 免疫荧光染色 固定细胞,进行封闭后,孵育多克隆兔抗Drp1(1∶200),兔抗Pink1(1∶250),4 ℃过夜孵育;孵育相对应的种属二抗(1∶500),加染DAPI后封片,在共聚焦显微镜下拍照。
1.2.8 透射电镜分析 细胞病毒转染后,进行固定电镜制样,在JEM-1200EX型透射电镜80 kV下观察。观察指标:①单位面积线粒体分布密度;②单位面积线粒体数量;③单位面积线粒体平均面积。
1.2.9 线粒体ATP指标检测 按照生厂商说明书,将细胞裂解匀浆,检测ATP的含量。详见碧云天操作试剂盒说明书。
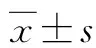
2 结果
2.1 高氨导致细胞存活率降低
我们将SHSY5Y细胞分别用0、1.0、2.5、5.0、10.0 mmol/L NH4Cl处理24~48 h后进行观察。首先,显微镜观察细胞形态,结果显示随着NH4Cl浓度的升高细胞出现破碎,相同浓度下NH4Cl处理时间越长细胞破碎则越明显(图1A)。用CCK-8进行细胞活性检测,在NH4Cl作用24 h时,同Sham组(0 mmol/L NH4Cl)进行比较,细胞凋亡检测结果显示,5.0 mmol/L NH4Cl处理细胞已经出现核致密浓染的凋亡现象,在10.0 mmol/L时凋亡程度进一步增加(图1B)。在10.0 mmol/L NH4Cl处理24 h状态下细胞活性显著降低(P<0.05,图1C),而在48 h时则显示在较低浓度1 mmol/L的NH4Cl状态下细胞活性同样显著降低(P<0.01,图1C)。以上结果表明细胞活性与氨的浓度以及作用时间明显相关。为了进一步观察氨在未诱导细胞活性降低以前是否对线粒体功能和形态产生影响,因此本研究根据实验结果选择氨浓度5.0 mmol/L的NH4Cl处理细胞24 h作为处理条件。
A:不同浓度NH4Cl处理24、48 h对细胞形态的作用(标尺为100 μm);B:不同浓度NH4Cl处理24 h对细胞凋亡的影响(Hoechst染色,标尺为25 μm);C:不同浓度NH4Cl处理24、48 h对细胞增殖能力的影响。Sham:0 mmol/L NH4Cl。aP<0.05,bP<0.01 vs Sham。图1 不同浓度和时间的高氨处理对细胞的影响
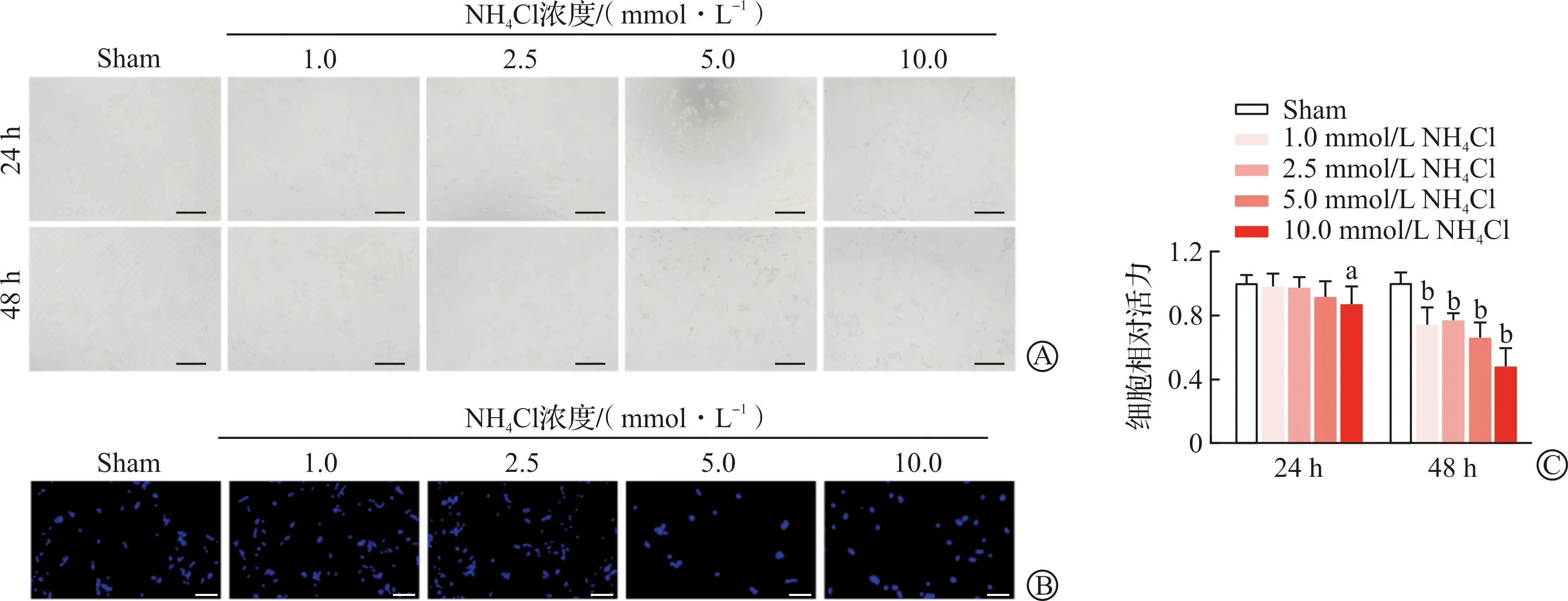
2.2 氨诱导线粒体相关自噬表达增多
为了观察高氨对细胞线粒体自噬的影响,我们观察了高氨诱导后的线粒体自噬相关蛋白Pink1/Parkin蛋白表达变化。实验分Sham组(0 mmol/L NH4Cl组)和NH4Cl组(经5.0 mmol/L NH4Cl处理组)。5.0 mmol/L的NH4Cl处理24 h后提取细胞蛋白进行Western blotting和免疫荧光观察表达变化。Western blotting结果显示,高氨诱导细胞内线粒体自噬相关蛋白Pink1/Parkin表达增加,与Sham组相比具有显著的统计学差异(P<0.05,P<0.01,图2A~B)。进一步使用免疫荧光染色显示,NH4Cl组Pink1表达水平明显高于Sham组(P<0.01,图2C)。以上结果显示NH4Cl显著增加细胞内线粒体自噬蛋白Pink1/Parkin的表达。
A:蛋白印迹显示5.0 mmol/L NH4Cl处理24 h诱导自噬蛋白Pink1-Parkin表达;B:Western blotting分析高氨诱导自噬蛋白Pink1-Parkin结果;C:免疫荧光观察高氨诱导Pink1表达(标尺为25 μm);Sham:0 mmol/L NH4Cl;NH4Cl:5.0 mmol/L NH4Cl。aP<0.05,bP<0.01 vs Sham。图2 氨诱导线粒体自噬相关蛋白Pink1的结果
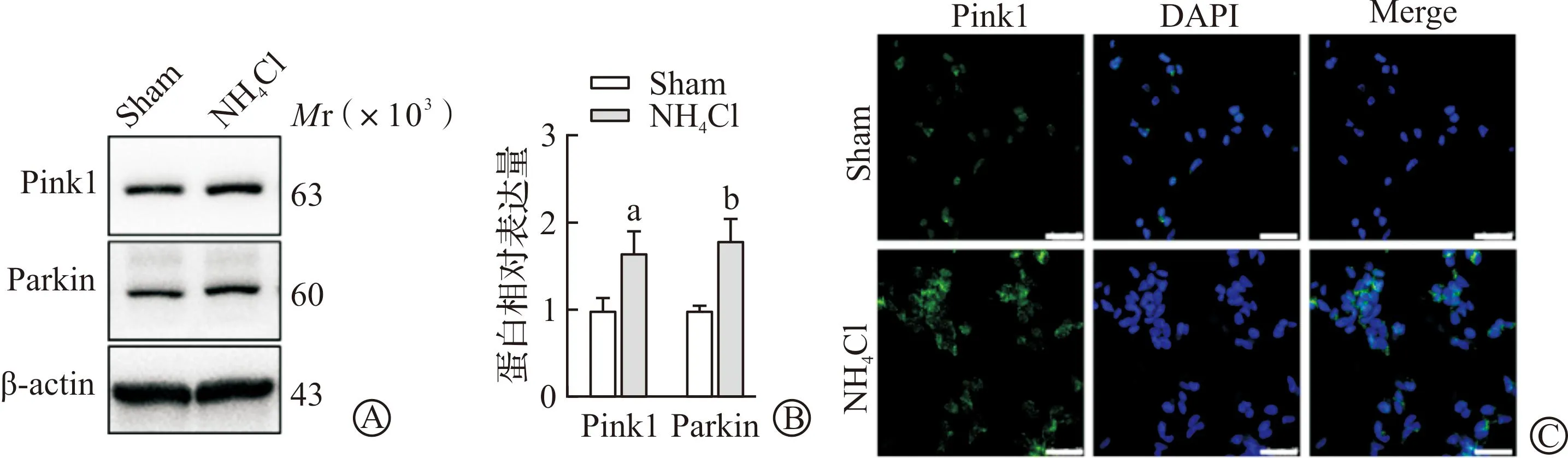
2.3 敲除Pink1可减少氨诱导的Drp1增多
为了阐明Pink1对线粒体裂变是否有影响,我们进一步构建慢病毒pCLenti-U6-shRNA(Pink1)-CMV-Puro-WPRE转染氨诱导的SH-SY5Y细胞,观察其对线粒体动力学蛋白Drp1的影响。实验分为3组:Sham+Pink1NC组(0 mmol/L NH4Cl组给予Pink1空病毒处理)、NH4Cl+Pink1NC组(5.0 mmol/L NH4Cl处理后给予Pink1空病毒组)、NH4Cl+Pink1KD组(5.0 mmol/L NH4Cl处理后给予Pink1干扰组)。首先通过免疫荧光染色验证病毒表达效果良好(图3A)。用免疫荧光染色观察Drp1在高氨时表达增加,而敲除Pink1后荧光表达减弱(图3B)。进一步行Western blotting的结果显示,与Sham+Pink1NC组相比,高氨诱导线粒体Drp1表达增加(P<0.01),而敲除Pink1后则Drp1表达减少(P<0.05,图3C)。以上结果显示高氨显著增加细胞内Drp1表达,敲除Pink1后则会减少Drp1。
A:敲除Pink1(Pink1KD)的免疫荧光染色(标尺为25 μm);B:免疫荧光观察Pink1KD对Drp1的影响(标尺为25 μm);C:Western blotting及分析结果观察Pink1KD对Drp1的影响。Sham+Pink1NC:0 mmol/L NH4Cl组给予Pink1空病毒处理;NH4Cl+Pink1NC:5 mmol/L NH4Cl处理后给予Pink1空病毒;NH4Cl+Pink1KD:5 mmol/L NH4Cl处理后给予Pink1干扰。aP<0.05 vs NH4Cl+Pink1NC,bP<0.01 vs Sham+Pink1NC。图3 敲除Pink1对线粒体动力相关蛋白Drp1的影响
2.4 敲除Pink1改善高氨诱导线粒体碎片化样变
线粒体动力相关蛋白Drp1增加往往表示线粒体分裂能力增强,提示线粒体可能碎片化样变。那么,高氨诱导后线粒体是否存在碎片化样变以及敲除Pink1之后是否对线粒体碎片化具有缓解作用,为了阐明此问题,本研究分别取Sham+Pink1NC组、NH4Cl+Pink1NC组、NH4Cl+Pink1KD组进行电镜观察线粒体数目以及分布情况。结果显示,与Sham+Pink1NC组相比,NH4Cl+Pink1NC组细胞内线粒体数目明显增加,且线粒体内膜中的空泡样变明显增多,而敲除Pink1后线粒体碎片化样变被缓解(图4A)。进一步对单位面积内的线粒体数量进行分析,显示减少线粒体内Pink1诱导的自噬可缓解高氨相关的线粒体数目增加(P<0.05,图4B);对线粒体的平均面积分析提示高氨诱导线粒体平均面积减少(P<0.01),而对线粒体覆盖率无明显影响,敲除Pink1减少线粒体平均密度(P<0.05),但对线粒体平均面积和线粒体覆盖率均无明显影响(图4B)。结果提示Pink1介导并参与高氨诱导的Drp1增加所导致的线粒体分裂。
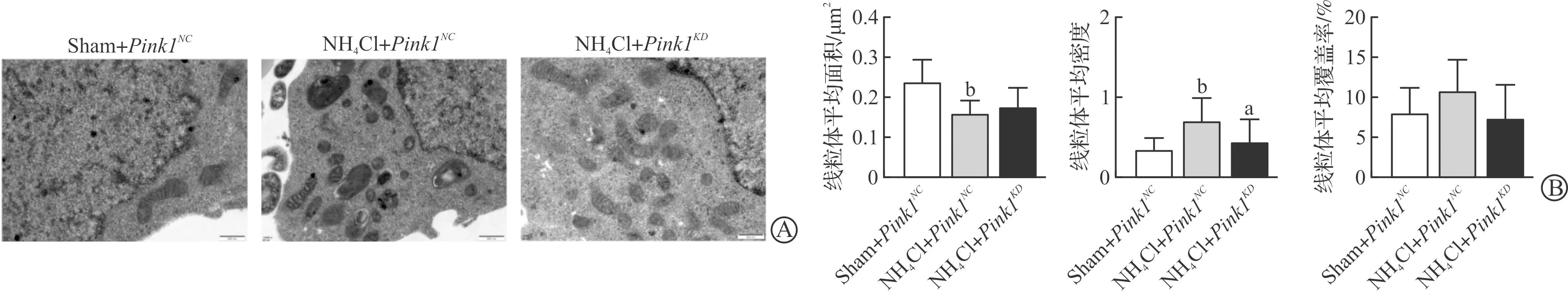
A:电镜下SHSY-5Y细胞中线粒体的形态(标尺为500 nm);B:Sham+Pink1NC、NH4Cl+Pink1NC和NH4Cl +Pink1KD诱导的SHSY-5Y细胞中线粒体平均面积、线粒体平均密度、线粒体平均覆盖率。Sham+Pink1NC:0 mmol/L NH4Cl组给予Pink1空病毒处理;NH4Cl+Pink1NC:5 mmol/L NH4Cl处理后给予Pink1空病毒;NH4Cl+Pink1KD:5 mmol/L NH4Cl处理后给予Pink1干扰。aP<0.05 vs NH4Cl+Pink1NC,bP<0.01 vs Sham+Pink1NC。图4 减少Pink1可改善氨诱导线粒体碎片化
2.5 敲除Pink1可改善高氨诱导线粒体ATP合成功能障碍
为了阐明Pink1调控线粒体分裂后是否对线粒体合成ATP功能有影响,我们分别在Sham+Pink1NC组、NH4Cl+Pink1NC组、NH4Cl+Pink1KD组中检测了线粒体合成ATP的功能。检测结果显示:高氨导致细胞ATP合成功能减退,与NH4Cl+Pink1NC相比显著降低(P<0.01),而给予Pink1KD后则可以明显恢复线粒体的ATP合成功能,与高氨诱导组(NH4Cl+Pink1NC)相比显著增加(P<0.01,图5)。该结果提示高氨状态下线粒体合成功能受损,减少高氨诱导的线粒体过度自噬可部分恢复线粒体合成ATP的功能。
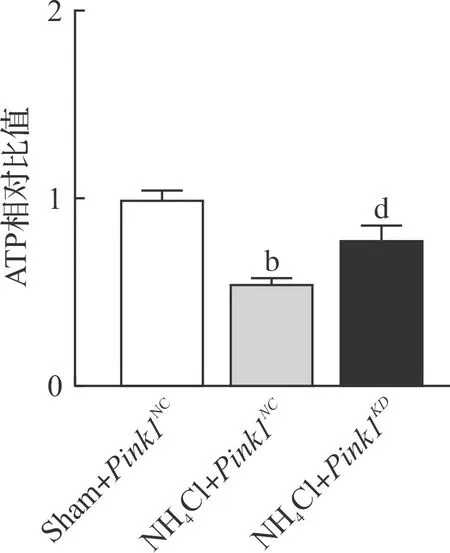
Sham+Pink1NC:0 mmol/L NH4Cl组给予Pink1空病毒处理;NH4Cl+Pink1NC:5 mmol/L NH4Cl处理后给予Pink1空病毒组;NH4Cl+Pink1KD:5 mmol/L NH4Cl处理后给予Pink1干扰组。bP<0.01 vs Sham+Pink1NC组,dP<0.01 vs NH4Cl +Pink1NC组。图5 Pink1KD对氨诱导线粒体ATP合成功能的影响
3 讨论
HE是严重肝功能不全时常见的并发症,而目前认为氨中毒学说为其主要病因之一[11]。尽管人们普遍认为高氨血症诱导的星形胶质细胞和神经元损伤在介导神经系统紊乱中起着主要作用[12],但其潜在的分子机制尚不清楚,其中具有争议的是高氨血症引起的大脑能量代谢改变的作用。本研究探讨了与Pink1调节作用相关的高氨诱导的线粒体功能障碍相关的分子机制,研究结果如下:①高氨诱导的细胞损伤,导致线粒体分裂和自噬异常升高,进而损害线粒体功能;②在SHSY5Y神经母细胞瘤细胞中,Pink1敲除降低Drp1水平,减少线粒体过度分裂,恢复了线粒体合成ATP的功能[13]。在高氨诱导细胞损伤之前已经导致细胞内线粒体自噬和分裂异常增加,线粒体合成ATP功能减退,这代表了HE发病早期氨即已对线粒体功能造成损伤。
研究表明,氨中毒会引起脑能量代谢的明显降低[14-15]。据报道,氨会抑制三羧酸循环酶,氨对线粒体电子呼吸链复合物的抑制可促进活性氧(reactive oxygen species,ROS)形成和氧化应激[16]。脑组织对ATP的高度持续依赖使细胞内线粒体成为HE治疗中至关重要,且有望成为治疗HE的重要方向。研究最初表明线粒体分裂增加与凋亡激活之间存在联系,但现在很清楚线粒体形态也与生物能量学密切相关,并受代谢需求变化的影响,线粒体分裂通过将受损的细胞器从健康网络中分离出来,通过线粒体自噬降解,从而有助于质量控制[17]。线粒体通过质量控制维持自身稳态,其主要通过线粒体自噬、线粒体动力学、线粒体生物合成等方式来维持线粒体完整性和功能。KLEELE等[7]通过体外细胞研究发现线粒体Pink1/Parkin介导的自噬与线粒体周边分裂伴随发生,并且过度的线粒体自噬导致线粒体碎片化样改变和自噬稳态失衡将进一步加重损伤线粒体功能。本研究为了揭示高氨状态下线粒体自噬对线粒体分裂的影响,因此研究调控线粒体自噬蛋白Pink1,观察线粒体分裂状态的表达变化。线粒体融合和裂变对调控线粒体功能具有重要的意义。线粒体不断进行融合和裂变以维持细胞器的保真度[18]。线粒体的形态变化受大量蛋白质的控制,其中Drp1通过介导哺乳动物的线粒体裂变过程有效地影响细胞存活和凋亡[19-20]。用siRNA或线粒体分裂抑制剂-1抑制Drp1的活性,可大大提高线粒体的稳定性并部分抑制细胞凋亡,这表明细胞凋亡的进展至少部分取决于Drp1介导的线粒体片段化[19,21]。以上研究结果与本文中发现高氨前期发生线粒体损伤结论一致。
线粒体形态受Drp1介导的裂变过程调控,Drp1可促进线粒体裂变影响神经元功能[22]。线粒体过度的分裂提示线粒体碎片化、线粒体功能障碍、合成ATP能力减退。DREWS等[23]在人星形胶质瘤细胞中给予5 mmol/L NH4Cl高氨诱导6 h即表现出线粒体碎片化,24 h最为严重,但延长时间并未增加碎片化程度。线粒体碎片化与线粒体自噬关系密切。线粒体自噬自2005年首次提出后已被证明与多种系统疾病有关,目前研究已阐明线粒体自噬主要由两种分子途径介导,一条通路通过缺氧诱导因子1亚单位α激活,另一条由Pink1/Parkin通路参与介导[24-26]。而本文研究发现,高氨通过诱导损伤导致Pink1高表达,并伴随着Drp1诱导的线粒体过度分裂,电镜结果进一步得到证实。最近一项在帕金森病模型中的研究表明,Pink1的过表达促进神经元内线粒体分裂,而Pink1敲除失活导致过度融合,同时减少线粒体的碎片化,该研究与本文研究结果一致[27]。2021年,KLEELE等[7]通过对线粒体生理学的精细时空分析,发现大多数线粒体膜电位和质子泵动力降低,ROS和Ca2+水平增加导致线粒体Pink1/Parkin介导的自噬发生,且该现象发生在Drp1由胞浆转移到线粒体外膜分裂位点之前。以上成果与本文研究结果表明Drp1诱导的线粒体分裂依赖于Pink1对线粒体自噬的调控,通过调控Pink1可改善线粒体功能以及形态,有望成为治疗HE高氨诱导的神经元损伤的新靶点。线粒体分裂根据细胞环境的不同分为进行生物发生的分裂(即中央分裂)以及自我保护的损伤排除性的分裂(即边缘分裂),而在高氨不同程度处理状态下线粒体分裂模式可能存在差异,需要进一步确认,这也将是下一步的研究方向。
总之,本研究揭示在体外高氨模型中敲除Pink1表达,可减少Drp1诱导的线粒体过度分裂,并显著恢复线粒体ATP合成功能,从而缓解高氨诱导的能量代谢障碍。因此,Pink1介导的线粒体自噬对于了解高氨诱导的线粒体形态异常和功能障碍具有重要意义,有望成为治疗HE的潜在靶点。当然,Pink1与高氨之间的具体机制仍需要进一步大量体内和体外实验的验证和阐明。
