泽泻醇A保护血脑屏障改善脑缺血/再灌注损伤的作用和机制研究
2024-01-22邓云飞李惠红周阳杰薛偕华
邓云飞,李惠红,魏 伟,周阳杰,薛偕华,3,4
(1.福建中医药大学康复医学院, 福建 福州 350122; 2.福建中医药大学附属康复医院, 福建 福州 350003; 3. 福建省康复技术重点实验室, 福建 福州 350122; 4. 福建省认知功能康复重点实验室, 福建 福州 350003)
脑缺血/再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)是缺血性脑卒中再灌注治疗后缺血脑区血流再通和复氧引发的脑组织继发性损伤,其机制与炎症、氧化应激和蛋白水解等相关[1-2],且难以完全避免,其改善对缺血性脑卒中的治疗具有重要意义。
CIRI主要由血脑屏障(blood brain barrier, BBB)破坏介导,脑缺血/再灌注(cerebral ischemia-reperfusion , CI/R)时BBB破坏导致外源性免疫细胞和炎症因子等进入脑组织,加重CIRI[3-4]。BBB由脑毛细血管的基膜、内皮细胞、周细胞和星形胶质细胞终足构成,是脑组织和血液之间的物理屏障,阻挡了神经毒性物质、血细胞和病原体等进入脑组织,同时调控脑组织的代谢,对维持中枢神经系统的稳态具有重要意义[4]。基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)是CI/R过程中破坏BBB的重要病理因素,其属于基质金属蛋白酶家族,为一种Zn2+依赖的蛋白水解酶,可降解和重塑细胞外基质。通过酶解IV型胶原蛋白、层黏连蛋白和纤维连接蛋白等,可破坏脑血管基底膜导致BBB损伤[5]。研究发现在CIRI过程中MMP-9生成增多,而抑制MMP-9水平可有效改善CIRI[6]。
目前临床上主要采用消炎和抗氧化应激药物治疗CIRI[7],但其具有疗效单一、用药条件严格和副作用明显等局限。近年来,天然药物的研究引起人们越来越多的关注,使用具有抗炎、抗氧化作用的中药改善CIRI被广泛研究[8]。泽泻具有抗炎[9]、抗氧化[10]和保护内皮细胞[11]的功能,其主要成分泽泻醇A(Alisol A, AA)属于生物碱四环三萜类化合物,可减少小鼠动脉MMP-9水平[12]。同时,分子对接结果发现AA可与MMP-9结合,其可能具有抑制脑组织MMP-9的功能。
故本研究拟探讨AA干预是否可抑制CI/R过程中的MMP-9升高,从而保护BBB、减轻CIRI。
1 材料与方法
1.1 实验动物C57BL/6小鼠,雄性,33只,体质量25~30 g,购于广东药康生物科技有限公司,许可证编号:SCXK(粤)2020-0054。饲养于福建中医药大学动物实验中心SPF级实验室,许可证编号:SYXK(闽)2020-0002,自由进食、进水,12 h昼夜交替饲养。本研究已通过福建中医药大学动物实验伦理委员会批准(审批号:FJTCMIACUC2020091)。
1.2 主要仪器与试剂旷场、Y迷宫实验设备(上海欣软信息科技有限公司);9.4T小动物磁共振系统(Bruker Bio-Spec70/20 USR);HT7800高反差型透射电子显微镜(日本Hitachi公司); YGQ-3126D型切片机、YT-7FB型生物组织摊烤片机(亚光医用电子技术有限公司); ChemiDoc XRS+型化学发光成像系统(美国Bio-Rad公司);PowerPac HC蛋白质电泳及转印装置(美国Bio-Rad公司)。AA(纯度>98%,上海源叶生物科技有限公司); MMP-9抗体(10375-2-AP)、β-actin抗体(60004-1-lg)(武汉三鹰生物技术有限公司);KIT-9720型免疫显色试剂(福州迈新生物技术开发有限公司)。
1.3 实验方法
1.3.1实验动物分组、造模与干预
1.3.1.1 实验动物分组 33只小鼠随机分为假手术组(Sham)、GCI/R组和AA干预组(GCI/R+AA),每组11只,造模后死亡4只,每组剩余9只用于后续实验。
1.3.1.2 模型构建 GCI/R是一种研究CIRI的公认有效造模方式,操作简单且不局限于单一脑区[13]。小鼠术前禁食12 h,根据体质量用1%戊巴比妥钠(3 mL·kg-1)麻醉后置于仰卧位,固定四肢和牙齿使其充分暴露颈部,脱毛、消毒后沿正中线纵向剪开一小口,用显微镊分离颈部筋膜和肌肉,在气管和胸锁乳突肌之间的深部可见颈总动脉和其外侧的迷走神经,分离出颈总动脉并用手术缝合线打活结结扎并计时20 min。计时结束后解开活结,确保血流恢复供应后用可吸收手术缝合线缝合伤口。Sham组小鼠仅分离颈总动脉而不结扎。
1.3.1.3 AA干预 术后第1天开始,GCI/R+AA组小鼠根据体重进行30 mg·kg-1的AA灌胃干预,Sham组和GCI/R组给予等量生理盐水灌胃,每日1次,连续7 d。
1.3.2神经功能评定
1.3.2.1 改良神经功能缺损评分(modified neurological severity score,mNSS) mNSS评分是一项量化实验动物运动、感觉、平衡和反射功能的评分方法,被广泛应用于CIRI模型的神经功能缺损评价[14]。采用盲法在术后的第1、3、5、7天进行评估,当小鼠不能完成某项任务时记1分,总分 0~18分,分数越高表明神经功能损伤越严重。
1.3.2.2 旷场实验 造模后第8天,采用旷场实验评价小鼠的自主运动能力和探索行为,反映运动能力和焦虑程度[15]。将小鼠从中心点放入旷场(50 cm×50 cm×45 cm),让其自由探索10 min。实验过程录像并使用相应的计算机软件捕捉小鼠运动路径,后期运用 Supermaze 软件计算小鼠的运动总路程和中心区域路程。
1.3.2.3 Y迷宫实验 造模后第8天采用Y迷宫实验检测小鼠工作记忆和探索活动。其由3条长35 cm、宽5 cm、高15 cm,相互呈120°夹角的臂组成。小鼠被放置于三条臂的交叉区域,自由探索8 min,使用视频成像系统捕捉小鼠进入各条臂的顺序。统计正确交替的次数,连续进入 3个不同的臂为 1次交替。使用交替率评价小鼠的工作记忆,交替率=正确交替次数/(进入臂的总数-2)×100%[16]。
1.3.3磁共振波谱(magnetic resonance spectroscopy, MRS)检测大脑皮层相关神经代谢物水平 采用9.4T小动物磁共振波谱扫描仪检测3组小鼠大脑皮层肌酸(creatine, Cr)、N-乙酰天门冬氨酸(N-acetylaspartate, NAA)、胆碱(choline, Cho)、肌醇(myo-inositol, mI)、牛磺酸(taurine,Tau)和γ-氨基丁酸(γ-aminobutyric acid, GABA)的代谢水平。小鼠经 2%~3% 异氟烷麻醉后,俯卧位置于扫描床上。选取皮层作为感兴趣区域,大小为1 mm×1 mm×1 mm。采用PRESS序列获取MRS, MRS参数为TR=1 500 ms, TE=144 ms,平均次数为256次,体素=5 mm×4 mm×4 mm。每种代谢物的参考值如下: Cr:3.05 ppm; NAA:2.02 ppm; Cho:3.22 ppm; mI:3.56 ppm; Tau和GABA:3.02 ppm。Cr作为内参用于计算其他代谢物的相对水平。使用TOPSPIN (V3.1, Bruker Biospin, Germany)对相关图像和数据进行分析,计算Cho、NAA、mI、Tau、GABA的相对代谢水平。
1.3.4透射电镜(transmission electron microscope,TEM)检测皮层BBB超微结构 用4%多聚甲醛灌注后取出小鼠脑组织,去除嗅球后向后切取1.5 mm~2.5 mm薄片,沿正中线向左、右各切取1~2 mm区域,取皮层1 mm范围得到1 mm×1 mm×1 mm的立方块, 于4 ℃、4%多聚甲醛和2.5%戊二醛中浸泡固定。用0.1 mol·L-1磷酸盐缓冲液洗涤3次后在1%四氧化锇中固定2 h。漂洗后脱水、包埋、切片、3%柠檬酸铅染色后,透射电镜下观察各组小鼠皮层BBB超微结构。
1.3.5免疫组织化学法检测皮层MMP-9表达水平 4%多聚甲醛灌注后取材,将脑组织脱水、石蜡包埋并切片。二甲苯和梯度乙醇脱蜡入水, 100 ℃ Tris-EDTA抗原修复后依次破膜、内源性过氧化物酶阻断、封闭和一抗孵育(MMP-9 1 ∶200, 4 ℃过夜),PBS清洗后二抗37 ℃孵育1 h。链霉菌抗生物素过氧化物酶37 ℃孵育1 h后进行DAB显色、苏木精染核、分化、脱水透明和封片。显微镜下观察并于相同倍数和参数下拍照。使用ImageJ图像分析软件检测阳性细胞,使用平均阳性染色面积百分比法(Area %)分析MMP-9表达量。
1.3.6蛋白免疫印迹法检测皮层MMP-9表达水平 小鼠麻醉后取大脑皮层低温保存。向样本加入适量裂解液后研磨并静置30 min,4 ℃高速离心后取上清液BCA定量。SDS-PAGE凝胶电泳、转膜、封闭、一抗(MMP-9 1 ∶2 500、β-actin 1 ∶3 000)4 ℃过夜, TBST清洗后二抗(1 ∶5 000)室温孵育40 min,TBST清洗后显影,使用Image LabTMSoftware 软件分析条带灰度值并进行统计分析。
1.3.7分子对接预测AA与MMP-9结合 从RCSB PDB网站下载MMP-9蛋白结构(选取“Homo sapiens”且“REFINEMENT RESOLUTION”最小的结构),用Py MOL软件去水、去配体;从PubChem数据库下载AA的3D结构。使用Auto Dock Tools软件对AA结构进行加氢、计算电荷数和确定原子刚性处理,对活性成分进行“Torsion tree”处理后将AA与MMP-9进行对接得到结合能和结合位点。最后用Py MOL软件进行可视化。
2 结果
2.1 各组小鼠神经功能比较
2.1.1mNSS评分比较 在造模后的第3、5、7天,与Sham组相比GCI/R组小鼠神经功能评分明显升高(P<0.01),GCI/R+AA组较GCI/R组评分明显降低(P<0.01)(Fig 1 A)。
2.1.2旷场和Y迷宫结果比较 旷场轨迹图显示GCI/R组小鼠运动轨迹明显减少而GCI/R+AA组小鼠增加(Fig 1 B)。在旷场实验的总路程、中心区域路程占总路程比值和Y迷宫的交替率方面,GCI/R组小鼠相比于Sham组明显降低(P<0.01),GCI/R+AA组与GCI/R组相比则明显升高(P<0.01)(Fig 1 C-E)。
2.2 小鼠皮层Cho、NAA、mI、Tau和GABA的相对代谢水平MRS检测结果显示,与Sham组相比,GCI/R组小鼠脑内Cho/Cr、mI/Cr和Tau/Cr明显上升,NAA/Cr和GABA/Cr水平明显下降(P<0.01)。与GCI/R组相比,GCI/R+AA组小鼠脑内Cho/Cr、mI/Cr和Tau/Cr明显下降,NAA/Cr和GABA/Cr水平明显上升(P<0.01)(Tab 1)。
2.3 大脑皮层BBB超微结构改变TEM观察发现,Sham组小鼠大脑皮层BBB形态和结构完好。GCI/R组小鼠大脑皮层微血管基膜塌陷、管腔变窄;内皮细胞间隙变大、紧密连接破坏,内皮细胞处于激活状态、质膜褶皱;星形胶质细胞终足肿胀。GCI/R+AA组小鼠大脑皮层微血管管腔充盈;内皮细胞质膜平整、紧密连接完好;星形胶质细胞终足相对正常(Fig 2)。
2.4 大脑皮层MMP-9免疫组化检测结果免疫组织化学检测结果发现,Sham组小鼠大脑皮层MMP9表达量较低,GCI/R组表达量明显增多(P<0.01);GCI/R+AA组表达量明显下降(P<0.01)(Fig 3)。
Tab 1 Comparison of ratios of Cho/Cr, NAA/Cr, mI/Cr, Tau/Cr and GABA/Cr in n=5)

Fig 1 Comparison of neurologic function in each group of n=6)
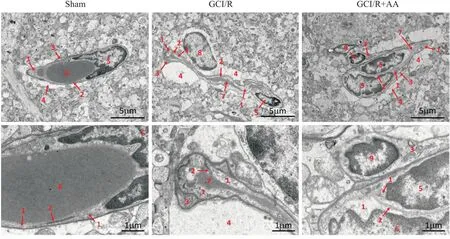
Fig 2 Electron microscope observation of BBB in cortex
2.5 大脑皮层MMP-9 蛋白免疫印迹检测结果蛋白免疫印迹结果显示,GCI/R组小鼠皮层MMP-9水平相较于Sham组明显增高(P<0.01);GCI/R+AA组相较于GCI/R组明显降低(P<0.05)(Fig 4)。
2.6 AA与MMP-9分子对接结果分子对接结果显示,AA可与MMP-9的TYR-50和ARG-106两个基团结合,结合能为-6.24 kcal·mol-1(Fig 5)。
3 讨论
CIRI是缺血性脑卒中再灌注治疗引起的一种常见继发性损伤。目前临床上常采用丁苯酞和依达拉奉等药物进行抗炎、抗氧化治疗[7]。但其副作用大等一系列弊端让人们越来越多地将眼光放到了具有副作用小和多靶点、多通路起作用等优点的中药身上。研究发现,福建道地药材泽泻具有抗炎[9]、抗氧化[10]和保护内皮细胞[11]等作用,这与CIRI的病理机制相契合。故本研究选取泽泻的主要成分AA进行研究,并首次发现了其对于CIRI的保护作用。我们通过检测大脑神经功能和神经代谢物质发现AA治疗可改善小鼠CIRI。CIRI之后,小鼠的运动和认知功能受损、出现焦虑,且脑组织相关神经代谢改变。在本研究中,GCI/R后小鼠mNSS评分明显升高,经AA治疗后逐渐降低。同时,GCI/R小鼠在旷场实验中的自主运动和探索行为明显减少,提示其运动功能受损、焦虑程度增加[15],Y迷宫结果显示其工作记忆减退, AA治疗后以上表现均明显改善。本研究使用MRS检测了各组小鼠大脑皮层的CIRI相关神经代谢指标。其中,GABA是一种抑制性氨基酸,在CIRI时明显升高[17]。 NAA为神经元代谢标志物,CIRI时其水平降低[18]。Tau也是抑制性氨基酸,在CIRI时表达增多以应对脑组织中的兴奋性毒作用[19]。Cho的值代表可溶性胆碱复合物的水平,因主要存在于细胞膜上,其峰值变化反映了细胞膜代谢和细胞更新水平;CIRI时介导 Cho水平的升高[20]。mI主要存在于胶质细胞中,是胶质细胞的标志物,当CIRI发生时,胶质细胞过度激活,引起mI水平升高[20]。MRS结果显示,GABA、NAA水平在GCI/R小鼠皮层表达明显降低,而Cho、mI和Tau明显升高;经AA治疗后GABA、NAA表达升高,Cho、mI和Tau表达下降。综上可知,AA治疗可有效改善小鼠CIRI。

Fig 3 Comparison of IHC-staining of MMP-9 in cortex in each group of n=3)
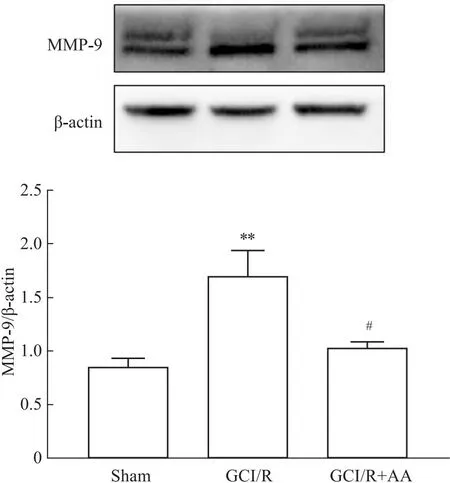
Fig 4 Expression of MMP-9 protein in cortex in each group
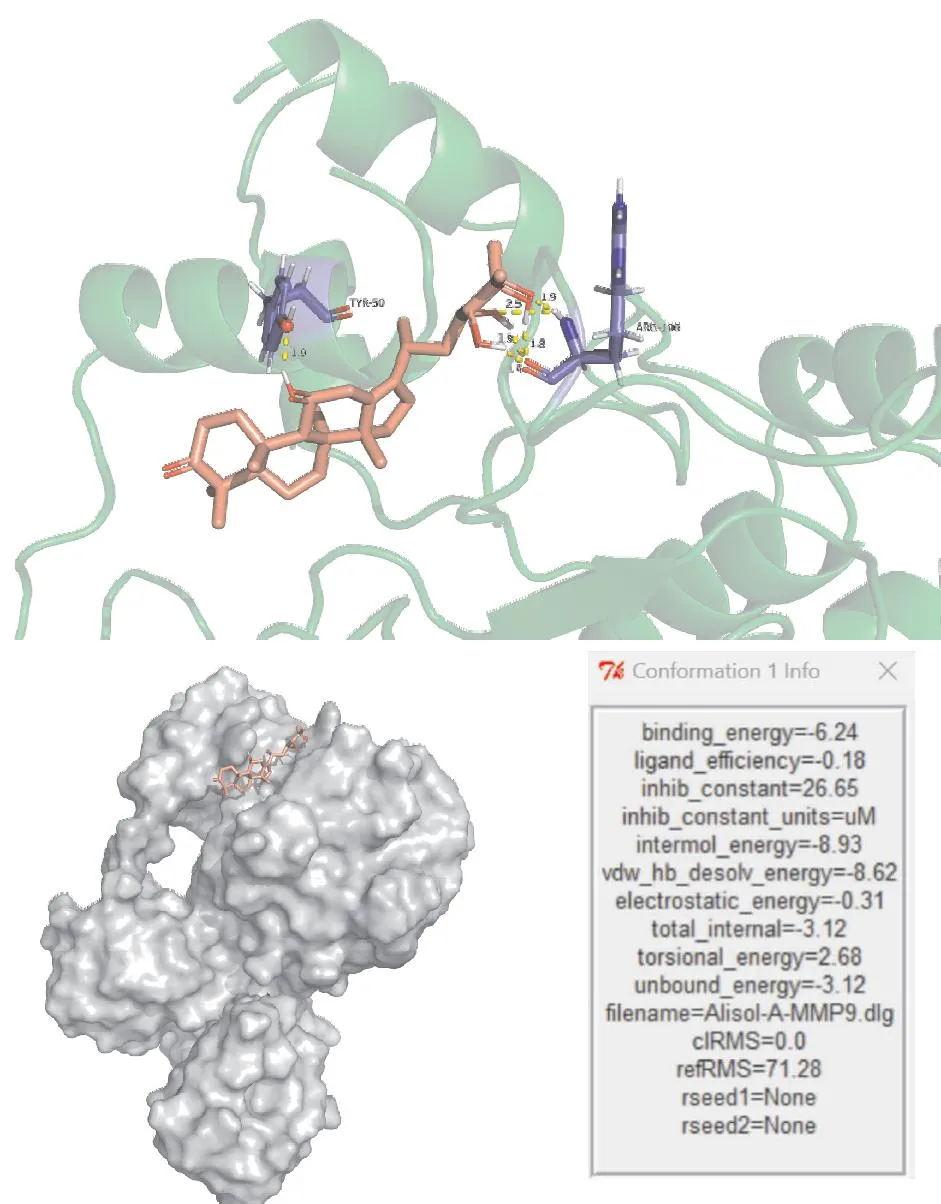
Fig 5 The visualization and binding energy of molecular docking
BBB具有隔离有害物质、调节CNS代谢的功能,对于维持 CNS 内环境稳态和脑细胞正常功能具有重要作用[21]。其破坏是CIRI的中心环节和明显病理学特征[22]。CI/R过程中,氧化应激、炎症和酶解等因素引起BBB破坏,促使外周血液中的活性氧、炎症因子和血源性免疫细胞等进入脑组织造成CIRI[3-4]。本研究通过TEM观察评估BBB的破坏,发现GCI/R小鼠大脑皮层BBB受损严重,脑微血管基膜塌陷、管腔变窄,内皮细胞质膜褶皱,紧密连接破坏和星形胶质细胞终足肿胀;经AA治疗后血管管腔充盈,内皮细胞质膜平整,紧密连接完好,星形胶质细胞终足肿胀减轻。此结果表明AA减轻了BBB破坏,这可能是其改善CIRI的途径之一。
MMP-9是一种可降解细胞外基质的蛋白酶,在正常脑组织中水平较低,在某些病理条件下分泌增多从而参与组织的损伤和修复。在CI/R过程中,MMP-9分泌增加,酶解血管基膜和细胞连接,导致BBB破坏[23]。研究发现抑制MMP-9可有效保护BBB、改善CIRI[6]。而AA被证明可降低高脂小鼠血管的MMP-9水平[12]。在本研究中, 蛋白免疫印迹和免疫组化检测结果显示,GCI/R小鼠大脑皮层MMP-9表达显著升高,经AA治疗后明显降低,提示AA可能抑制CIRI后脑组织内增多的MMP-9表达。经分子对接技术分析发现AA可与MMP-9通过TYR-50和ARG-106两个基团结合,且结合能较低。蛋白位点对于蛋白质结构和功能的维持具有重要意义,其结合将改变蛋白质分子结构和相关生物化学功能。研究发现蛋白质的Tyr-50位点对于抗原抗体的结合和维持起着重要作用[24],AA结合Tyr-50可能是导致MMP-9免疫化学检测表达量降低的原因;而ARG-106对于MMP-9发挥蛋白酶切作用非常关键[25],其结合可抑制MMP-9的酶解作用。由此推测AA可能结合MMP-9并抑制其活性,从而减轻CI/R过程中的BBB损伤。
综上所述,本研究发现AA可改善小鼠皮层CIRI,这一作用可能是通过抑制CI/R过程中增多的MMP-9对于BBB的损伤作用实现的。其更多机制仍待进一步研究。
