COPD细胞微环境体外模型建立的思路与方法
2024-01-22秦燕勤李建生
秦燕勤,刘 含,李建生
(1.河南中医药大学 河南省中医药防治呼吸病重点实验室 呼吸疾病中医药防治省部共建协同创新中心,河南 郑州 450046 2. 河南中医药大学中医药科学院,河南 郑州 450046;3. 河南中医药大学第一附属医院呼吸科,河南 郑州 450003)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续性呼吸道症状和不完全可逆性气流受限为主要特征的疾病,其病理机制复杂,包括炎症反应、氧化应激、蛋白酶/抗蛋白酶失衡、黏液高分泌、血管损伤等,涉及多种细胞及介质。细胞微环境改变是COPD病理生理的重要组成部分。模拟细胞病理微环境是COPD机制研究及药效药理评价的重要方法。单层细胞培养无法模拟细胞间的相互作用,在应用方面有一定的局限性。细胞共培养技术可较大限度模拟COPD多细胞相互的微环境,为COPD的病理机制及药效研究提供模型工具。鉴于上述,本文基于近年来研究背景,总结现有模拟COPD病理微环境的细胞模型,分析模型的适用性,提出COPD细胞微环境病理模型建立的思路与方法,旨在为COPD的病理及药物作用机制研究提供参考。
1 肺内细胞微环境的构成
肺内细胞微环境由细胞、细胞外基质、可溶性分子及物理因子构成,以维持肺的正常生理功能。细胞主要包括肺实质细胞、间质细胞、免疫细胞。细胞外基质是分布于细胞外空间、由细胞分泌的蛋白和多糖所构成的网络结构,如胶原蛋白、弹性纤维、糖蛋白、纤维连接蛋白等,对细胞形态、生长、分化起调控作用。可溶性分子由营养物质和可溶性信号分子组成,如细胞因子、生物活性物质等。物理因子主要包括细胞外基质物理结构、微环境力学特性和其他物理特性等。
肺实质细胞主要有上皮细胞、血管内皮细胞等。支气管上皮细胞是保护气道-肺组织免受外源性物质侵袭的第一道生理屏障。肺泡上皮细胞主要包括Ⅰ型和Ⅱ型细胞,Ⅰ型上皮细胞与基底膜、血管内皮细胞组成气血屏障,维持气体交换和屏障功能。Ⅱ型上皮细胞内含丰富的板层小体,主要合成、分泌和储存肺泡表面活性物质,维持肺泡张力。血管内皮细胞是肺血管稳态的主要调节剂,调节血管张力、凝血和血管生成。肺间质细胞主要包括间充质干细胞、成纤维细胞、脂质成纤维细胞、肌成纤维细胞,主要产生细胞外基质,以维持肺的结构和功能。免疫细胞主要包括巨噬细胞、中性粒细胞、自然杀伤细胞、肥大细胞等固有免疫细胞,适应性免疫细胞T淋巴细胞、B淋巴细胞,共同发挥免疫调节功能。
不同细胞之间通过直接、间接连接、分泌细胞因子、细胞外囊泡等相互作用维持细胞微环境稳态。免疫细胞和肺实质细胞的交互作用对维持细胞微环境稳态至关重要。微环境影响肺泡巨噬细胞的表型分化和功能,其转录组的变化完全归因于微环境[1]。支气管上皮细胞和巨噬细胞协同作用维持气道屏障功能,巨噬细胞释放的介质作用于损伤的气道上皮细胞,促进气道上皮修复[2]。巨噬细胞分泌的细胞外囊泡可被上皮细胞内化并抑制炎症通路的激活[3]。上皮细胞和血管内皮细胞主要参与构成气-血屏障,维持气-血交换和屏障功能。血管内皮生长因子参与维持肺泡上皮细胞完整性,阻断其受体诱导肺泡细胞凋亡和气肿样疾病[4]。巨噬细胞也参与调节气血屏障功能,发挥屏障免疫和异物清除作用,维持肺内环境稳态[5]。上皮细胞和间质细胞的相互作用对细胞增殖、分化和细胞外基质的产生至关重要,成纤维细胞通过释放炎症介质和生长因子调控上皮细胞表型[6]。
2 细胞微环境变化是COPD病理生理的重要组成部分
COPD病理机制复杂,其特征性病理变化是气道、肺实质及肺血管的慢性炎症反应,由多种细胞及介质参与。由香烟烟雾(cigarette smoke,CS)、细菌、病毒等微生物、PM2.5等颗粒物及缺氧等激活的巨噬细胞、中性粒细胞等炎症细胞及上皮细胞等肺实质细胞,释放炎症介质,引发炎症反应,损伤肺实质。激活的巨噬细胞、上皮细胞等不仅释放炎症介质,还可促进中性粒细胞的募集和活化,增强炎症信号,产生瀑布样炎症反应,促进COPD病理进展[7-8]。
COPD炎症反应可作为始动因子,启动其他一系列病理进程。氧化应激和炎症反应在COPD病理进程中相互作用,相互促进[7]。巨噬细胞等免疫细胞释放的炎症因子刺激气道上皮细胞向杯状上皮细胞化生,促进气道黏液分泌,造成黏液积聚,诱导COPD患者咳嗽、咯痰,加重呼吸道症状[9]。炎症刺激可直接损伤血管内皮细胞,使其结构和功能发生改变,并抑制内皮修复,促进微血管形成,导致血管重构,诱发肺动脉高压的发生,增加COPD患者死亡风险[10]。炎症因子的刺激破坏细胞外基质,导致蛋白酶/抗蛋白酶失衡,引起胶原沉积,降解的基质又会加剧炎症反应,加快气道重塑的进程[6]。由于气流受限,COPD患者长期处于缺氧状态,血管内皮细胞对缺氧十分敏感,持续缺氧刺激可损伤内皮细胞,导致气血屏障结构改变和功能障碍,影响机体气血交换,加重气流受限,加速COPD病理进展[11]。COPD发生发展中,细胞微环境变化复杂,涉及方面较多,每一方面并不是独立的,而是相互作用,共同促进COPD病理进程。见Fig 1。
3 COPD细胞微环境病理模型建立的思考
肺内细胞微环境受多种因素影响,COPD疾病进展是多细胞相互作用的结果。目前,体外多以细胞为载体,模拟COPD病理微环境,探讨COPD发病机制及药物作用机制。采用外源性刺激物,如CS、脂多糖(lipopolysaccharide,LPS)、细胞因子、颗粒物、缺氧等诱导肺实质或免疫细胞,模拟COPD炎症反应、黏液高分泌、肺实质损伤等病理过程,以探讨COPD的病理及药物作用机制,见Tab 1。
然而,任何病理环节都不是单一的细胞起作用,而是多细胞相互作用的结果,借助现有的细胞培养支持物进行多细胞共培养可建立接近肺内细胞微环境的模型。肺是空腔器官,气道上皮细胞、肺泡上皮细胞一面是朝向气管腔或肺泡腔的游离面,一面是朝向深部组织的基底面,呈现出明显的极性,必须模拟细胞的生理极性,才能建立符合机体生理状态的体外模型。目前关于气道黏液高分泌的模型,多将气道上皮细胞培养于液体培养基液面以下,分泌型粘蛋白生成量不理想,通过检测黏蛋白基因表达评价模型[16,23]。这可能是由于该培养方法无法模拟气道上皮细胞的生理极性,杯状细胞化生受限导致的。可以采用气-液面培养模拟气道上皮细胞的生理极性建立病理模型。气血屏障是肺进行气体交换的结构,是阻止肺泡中外源性物质入侵机体的一道物理屏障,体外可模拟这种肺微环境特殊生理结构。类器官可再现肺空间结构和肺内环境与细胞间的相互作用,在肺发育、生理功能、疾病病理和药物作用机制研究中应用较多。
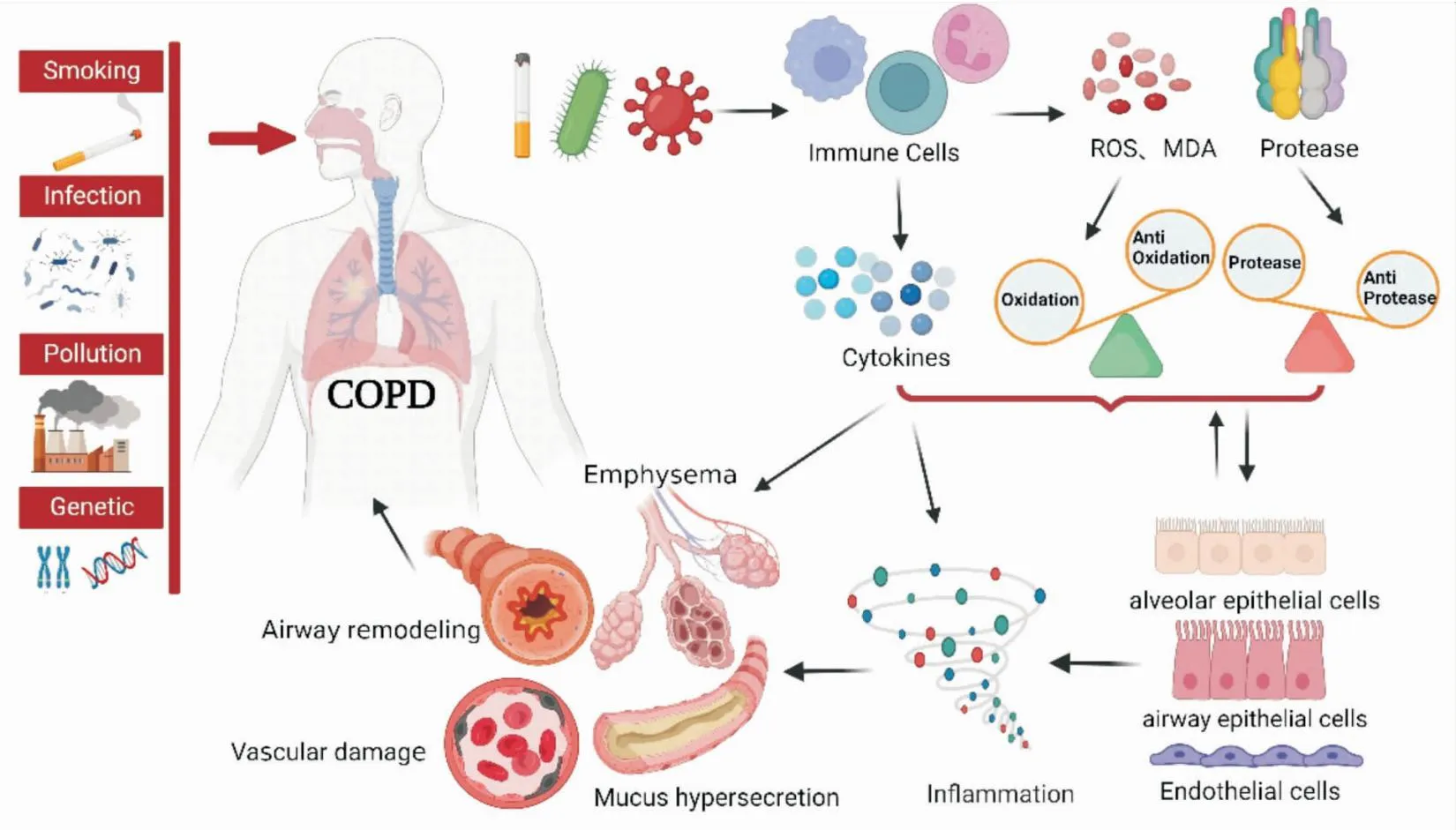
Fig 1 Changes of cellular microenvironment promote COPD disease progression

Tab 1 Application of different inducers to induce different cells in COPD study
因此,结合COPD细胞微环境的变化,建立细胞微环境的病理模型可为COPD病理机制研究及药理药效评价提供工具,对COPD的防治研究极为重要。基于目前常用的研究方法,提出以下模型建立方法。
3.1 模拟COPD多细胞相互作用微环境的细胞共培养COPD细胞微环境涉及多种细胞及介质,单层细胞培养无法模拟多细胞相互作用的微环境。将两种或两种以上细胞共培养构建体外模型,有利于探讨细胞间相互作用关系,模拟COPD多细胞相互作用的微环境。以往的研究多集中在两种细胞类型共培养。Wang等[18]将肺泡上皮细胞、巨噬细胞共培养,研究环境PM2.5的潜在毒性。脂多糖诱导共培养的上皮细胞、巨噬细胞模拟COPD炎症反应微环境,结果表明与单层细胞培养比较,共培养可放大脂多糖诱导的炎症反应[19]。Li等[20]用CS诱导共培养的A549细胞和THP-1细胞,发现CS诱导下,巨噬细胞可促进肺泡上皮细胞发生EMT。3种及以上细胞类型共培养更适宜模拟COPD多细胞相互作用的微环境。上皮细胞、巨噬细胞、内皮细胞、肥大细胞四种细胞共培养模拟PM10刺激时,肺细胞间交互作用,发现四种细胞共培养可释放更多的炎症因子,且肥大细胞起重要作用,该模型可为研究不同细胞类型对颗粒物的效应机制提供工具[24]。为模拟COPD病理状态下多细胞相互作用的微环境,可以将3种或3种以上细胞类型共培养,根据研究目的,选用CS、LPS、PM、细胞因子或缺氧为刺激因素,模拟气道黏液分泌、炎症反应、实质细胞损伤、巨噬细胞分化等不同的病理环节,为疾病发病机制研究提供工具。具体实施可采用直接接触共培养法,也可借助Transwell将不同类型细胞接种在培养板和Transwell多孔膜两面进行细胞共培养。见Fig 2。
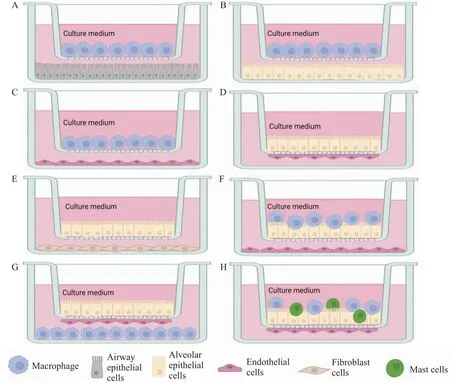
Fig 2 Cell co-culture that mimic multicellular interaction
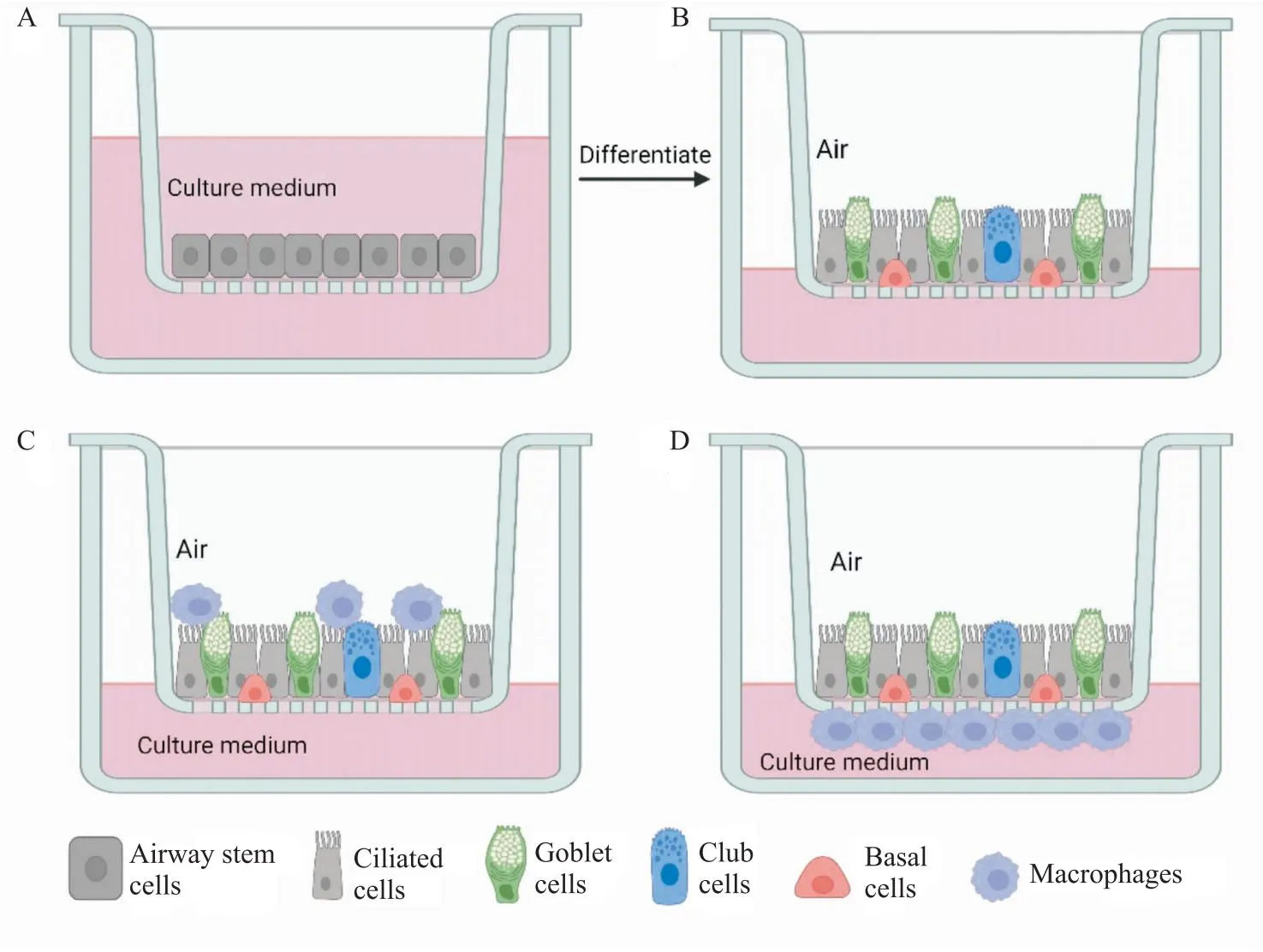
Fig 3 Air-liquid surface cell culture that mimic cell polarity
3.2 模拟上皮细胞极性的气-液面细胞培养气道上皮细胞、肺泡上皮细胞存在明显的极性,模拟这种生理状态,可建立接近细胞微环境的体外模型。气道上皮细胞多被用于模拟黏液高分泌微环境探讨COPD黏液高分泌机制及药物作用机制。传统的气道上皮细胞培养,细胞被接种于培养基液面以下,这不能完全模拟气道生理环境,气道上皮细胞向杯状细胞分化受到限制,黏蛋白分泌量较低[16,23]。气-液面培养的主要特征是细胞的基底面与液体培养基接触,其顶端表面暴露于空气中,模拟细胞的生长极性,模拟人呼吸道生理环境,诱导细胞向黏膜纤毛表型分化。由于气道上皮细胞生长于多孔膜的上表面,下表面还可以选择性的接种巨噬细胞等免疫细胞,模拟气道黏液高分泌的多细胞相互作用微环境。Schwab等[25]建立了支气管上皮细胞与巨噬细胞共培养体系,通过检测黏液和炎症因子分泌探讨上皮细胞与巨噬细胞的相互作用。建立该培养系统可采用Transwell小室,将气道上皮细胞接种于Transwell小室多孔膜上,细胞上表面暴露于空气中,通过多孔膜接触培养基,诱导其分化为杯状细胞。该模型可用于研究COPD发病机制及药物作用机制,特别是黏液高分泌机制及药物抑制黏液高分泌的作用机制与靶点。见Fig 3。
3.3 模拟肺气-血屏障的上皮细胞与内皮细胞共培养气血屏障位于呼吸系统肺泡与循环系统连接处,是机体进行气体交换的场所。因频繁接触随呼吸而来的外源性物质,气血屏障还是外源性物质入侵循环系统的门户。COPD病理进程中,气血屏障结构和功能受损,建立模拟肺气血屏障的肺泡上皮细胞与内皮细胞共培养模型,可为研究气血屏障损伤机制及药物作用机制提供工具。Lan等[26]采用Transwell建立了气血屏障,探讨气血屏障对PM2.5的屏障作用及细胞相互作用在细颗粒物刺激时的作用。Benam等[27]将内皮细胞和COPD患者肺分离的肺泡上皮细胞和共培养,模拟气血屏障,以检测肺内皮细胞和上皮细胞对细胞因子分泌的协同作用。模拟气血屏障的生理结构,可借助Transwell小室膜模拟基底膜,将内皮细胞与上皮细胞分别接种在膜的两面,也可在下层培养基中接种巨噬细胞等,以模拟气血屏障结构。见Fig 4。
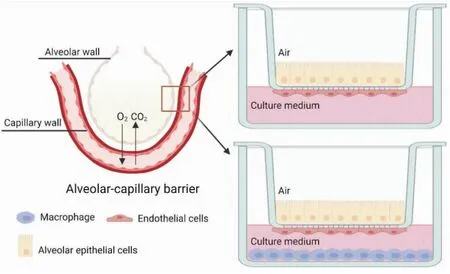
Fig 4 Cell co-culture mimicking alveolar-capillary barrier
3.4 模拟肺组织结构的肺类器官培养多细胞共培养虽易操作,可较大限度模拟COPD细胞微环境,但不能准确再现肺空间结构和肺内环境与细胞间的相互作用。类器官具有与原生器官相似的空间组织和部分功能,是目前最接近人体组织系统的模型,用于模拟器官发育和疾病病理。
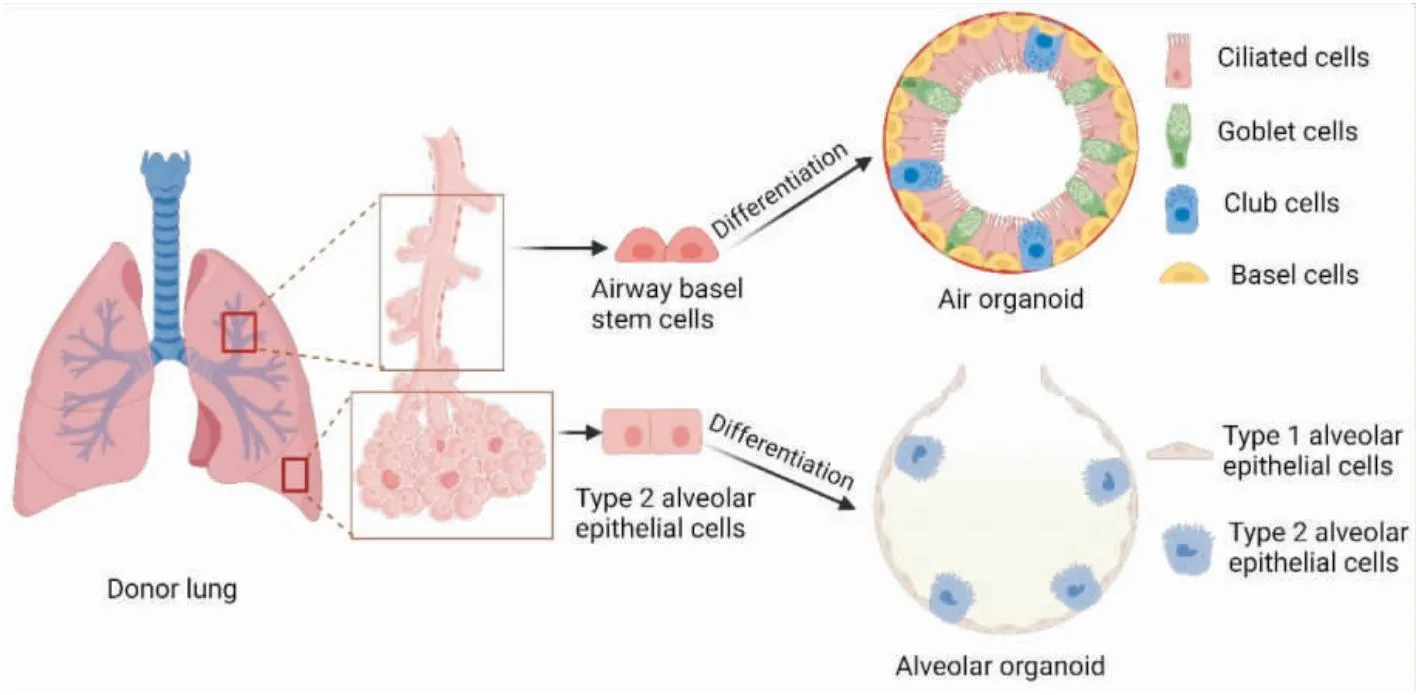
Fig 5 Differentiation of lung organoid
肺类器官用于研究肺发育、生理功能、疾病病理和药物作用机制。肺类器官可主要来源于成熟肺组织的上皮祖细胞(包括基底细胞、气道分泌细胞、肺泡II型上皮细胞)和多能干细胞,根据研究目的选择肺不同区域的细胞在细胞外基质中进行分化,以更准确地模拟肺疾病病理生理。肺基底细胞可产生气道的主要管腔上皮谱系,其分化的类器官可用于研究肺部疾病的气道病变病理机制,如气道黏液分泌、气道屏障功能、气道炎症和损伤及其潜在治疗。肺泡II型上皮细胞功能障碍是多种肺部疾病发病机制的主要原因,以此为来源的类器官应用更广泛,可用于研究多种疾病发病机制及药物筛选。Tan等[28]研究发现原代支气管上皮细胞分化的气道类器官管腔MUC5AC分泌增加,且随时间推移,MUC5AC分泌持续增加,这与气道类器官中杯状细胞和气道分泌细胞分化一致。Barkauskas等[29]基于气道类器官研究基底细胞中固有免疫通路的持续激活促进杯状细胞化生和气道重塑,该模型可作为研究COPD黏液高分泌和纤毛损伤及其药物作用通路的工具。Ⅱ型肺泡细胞分化的肺泡类器官多用于研究肺实质病理损伤机制。Ng-Blichfeldt等[30]采用原代小鼠和人肺泡上皮细胞分化的肺类器官探讨视黄酸信号通路在COPD上皮损伤修复中的作用,发现抑制该通路可促进来自小鼠和COPD患者肺组织的肺类器官的增殖。见Fig 5。
4 讨论
COPD病理机制复杂,涉及多种细胞类型,细胞微环境变化是COPD病理生理的重要组成部分,在COPD病程进展中扮演重要角色。细胞微环境体外模型建立是研究细胞间通讯和宿主-病原体相互作用的一种新病理模型,也是研究疾病病理、药物作用机制及毒性分析的有力工具。肺泡上皮细胞、气道上皮细胞、内皮细胞、巨噬细胞等单层细胞培养简单、易操作,被广泛应用于COPD的病理机制及药物作用机制研究。但是,单层细胞培养无法模拟COPD发生时,多细胞相互作用的微环境。两种或两种以上细胞共培养代替单层细胞培养建立多细胞相互作用的COPD病理微环境模型。特定细胞的共培养还可以模拟肺的特殊结构,如肺泡上皮细胞与内皮细胞共培养模拟气-血屏障等。这些细胞共培养模型为COPD的发病机制及药理药效研究提供了工具。
多细胞共培养可较大限度模拟COPD细胞微环境,但不能准确再现肺空间结构。肺类器官能模拟组织的关键结构和功能,很大程度上推进了COPD的研究,但也有一定的局限性,肺类器官缺乏血管系统、结缔组织、免疫细胞等微环境。未来的研究可将不同细胞来源的类器官进行共培养以克服这些局限。
综上所述,COPD细胞微环境的体外模型建立可为COPD的病理机制及药理药效研究提供工具,是推动COPD防治研究的重要组成部分,可为COPD的治疗提供新思路。然而,如何建立更接近人体肺生理环境的模型,如何建立模拟肺生理功能的模型等是需要进一步研究的问题。
