靶向血小板的抗肿瘤药物研究进展
2024-01-22周玥珂韦忠红王爱云
周玥珂,钱 程,唐 彧,韦忠红,陆 茵,2,王爱云,2
(南京中医药大学 1.药学院,江苏省中药药效与安全性评价重点实验室、2.江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
王爱云(1974-),女,博士,教授,研究方向:活血化瘀中药对肿瘤转移的影响,通信作者,E-mail:way9815@163.com
在肿瘤进展过程中,少量癌细胞从原发病灶侵入周围组织,并进入循环系统。这些循环肿瘤细胞(CTC)与癌症转移或预后之间的关系已在很多类型的癌症中确定,包括肺癌、乳腺癌、结肠癌等。CTC直接与红细胞、血小板、巨噬细胞和许多其他免疫细胞相互作用。血小板是血栓形成的关键调节因子,其主要功能是在血管损伤的情况下防止出血并减少失血。与正常人相比,癌症患者的血栓形成和血栓栓塞发生率增加了5倍以上[1]。越来越多的证据表明,血小板可以通过与癌细胞之间的多种相互作用促进肿瘤的发生和转移。例如,癌症通过直接诱导肿瘤-血小板聚集体、触发血小板颗粒和细胞外囊泡释放、改变血小板表型以及增加血小板产生来改变血小板行为。而血小板通过增殖信号,抗凋亡作用和血管生成因子来增强肿瘤生长,通过诱导肿瘤细胞的侵袭性上皮 -间充质过渡表型来激活肿瘤侵袭并维持转移[2]。已有研究表明,肿瘤细胞能够激活血小板,同时可以诱导血小板分泌多种物质,并且这些物质参与肿瘤的发生和发展,在肿瘤血行转移过程中发挥着关键性的作用[3]。因此,癌细胞和血小板维持着复杂的双向通讯。
多年来,抗血小板治疗的抗癌潜力一直被广泛研究。用于预防癌症发展和转移的靶向血小板的药理学方法主要是一些目前用于心血管疾病的抗血小板药物的应用以及其他新的药理学策略。尽管在临床前模型中,其中一些方法已经获得了令人惊喜的结果,但除了阿司匹林,抗血小板药物在癌症中有益作用的临床证据仍然在很大程度上缺失。如何使癌症患者从抗血小板治疗中获得最大益处,仍然存在重大挑战。
1 血小板支持肿瘤生长和转移
1.1 血小板促进肿瘤生长,并诱导肿瘤血管生成证据表明,血小板对肿瘤细胞增殖有直接影响。血小板有着丰富的颗粒和复杂的内部膜系统,其主要功能是分泌。血小板胞质内含有3种颗粒:α颗粒、致密颗粒、溶酶体颗粒。血小板α-颗粒膜蛋白是血小板活化释放的特异标志之一。肿瘤细胞诱导的血小板活化促进血小板α颗粒分泌转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)和血小板衍生生长因子(PDGF),这些因素不仅能诱导肿瘤生长,还能促进肿瘤新生血管[4]。
蛋白酶激活受体(PAR)是一类独特的G蛋白偶联跨膜受体,影响多种生化反应,如止血、血管生物学和各种炎症表型。凝血酶是血小板PAR最有效的激活剂。人血小板表达PAR1和PAR4。PAR1是人血小板上的“高亲和力”凝血酶受体[5]。除了触发血小板聚集外,凝血酶介导的血小板PAR-1和PAR-4裂解诱导血小板PDGF、VEGF的选择性释放,可促进肿瘤生长[6]。
P2Y12受体是一种G蛋白偶联受体(GPCR),二磷酸腺苷(ADP)是P2Y12受体的天然激动剂。血小板致密颗粒中储存着大量二磷酸腺苷(ADP),在其他激动剂诱导血小板活化后,ADP被释放,然后激动P2Y12受体,维持血小板聚集,放大血小板反应。有研究表明,血小板上的P2Y12介导血小板对卵巢癌的促生长作用,敲除P2Y12及P2Y12拮抗剂在体内和体外都能够减少卵巢癌细胞的增殖和增加细胞凋亡[7]。
1.2 血小板促进肿瘤转移转移是癌症相关死亡的主要原因,也是患者护理中的主要挑战。尽管已经开发出许多抗癌疗法,但一旦发生转移性扩散,预后仍然较差。肿瘤转移按顺序发展:肿瘤细胞从原发肿瘤中脱离并侵入血液或淋巴循环,血流内运输,远端部位的外渗和定植以及继发性肿瘤的生长。虽然一些机制反映了肿瘤细胞自主转移过程,但大多数需要肿瘤细胞与血细胞(包括骨髓细胞和血小板)相互作用,再发生转移[8]。肿瘤细胞通过刺激各种介质,如组织蛋白酶G或凝血酶,以及通过在血小板表面持续表达组织因子来激活血小板,被激活的血小板很快就会与癌细胞表面结合,通过复杂的信号机制传递给肿瘤细胞,以增加其转移能力,有助于促进转移环境的形成[9]。
血小板糖蛋白(GP)受体介导血小板黏附、活化和聚集。重要的血小板膜受体包括糖蛋白Ib-IX-V(GPIb-IX-V)、糖蛋白VI(GPVI)和糖蛋白Ⅱb/Ⅲa(GPⅡb-Ⅲa,也称为整合素αⅡbβ3)。这些GP受体协调血小板-肿瘤细胞的相互作用,促进肿瘤转移,阻断它们可能是一种有效的抗癌策略。GPVI是一种胶原蛋白和纤维蛋白的血小板特异性受体,可通过免疫受体酪氨酸激活基序(ITAM)信号激活血小板,进而调控血小板黏附、聚集和促凝活性,小鼠血小板GPVI的遗传缺陷有效地削弱了血小板-肿瘤细胞相互作用,减少了结肠癌细胞和乳腺癌细胞转移[8]。
选择素是参与白细胞,血小板和内皮之间相互作用的血管细胞粘附分子。P-选择素(P-Selectin)是参与血小板和内皮细胞相互作用的血管细胞黏附分子,储存在血小板α颗粒中,并在活化的血小板和内皮上表达。活化后,P-选择素通过胞吐作用迅速转移到细胞膜上[10]。与健康动物相比,患有乳腺癌的小鼠血小板上P-选择素的表达升高,而P-选择素表达,是乳腺癌肺转移变异程度的重要因素之一[11]。
2 靶向血小板的抗肿瘤药物
抑制血小板或阻断血小板与肿瘤细胞的相互作用已成为抑制肿瘤进展的一种策略。目前已开发出许多靶向血小板受体、干扰血小板颗粒释放或抑制血小板特异性酶的药物。由于这些药物对止血功能的干扰,以及当下对血小板与其他细胞(包括癌细胞)的相互作用认识有限,因此,癌症患者使用靶向血小板的药物存在明显的局限性。
2.1 整合素糖蛋白受体抑制剂
2.1.1GPⅡb/Ⅲa抑制剂 在临床上,GPⅡb/Ⅲa拮抗剂是具有广泛临床应用的注册药物。目前,FDA批准了3种GPⅡb/Ⅲa抑制剂,包括阿昔单抗(Reopro)、替罗非班(Aggrastat)和依替巴肽 (Integrilin)。替罗非班和依替巴肽是GP-Ⅱb/Ⅲa受体的可逆竞争性抑制剂,对GP-Ⅱb/Ⅲa具有高度特异性[10]。阿昔单抗(Reopro)是FDA于1994年批准的第一个GPⅡb/Ⅲa抑制剂。它是一种人-鼠嵌合单克隆抗体Fab片段,可阻断血小板和巨核细胞上的GP Ⅱb/Ⅲa受体。阿昔单抗与血小板GPⅡb/Ⅲa受体的结合阻止了纤维蛋白原、血管性血友病因子(vWF)等粘附蛋白分子与GP Ⅱb/Ⅲa受体的粘附作用,从而干扰血小板聚集和血栓形成[12]。
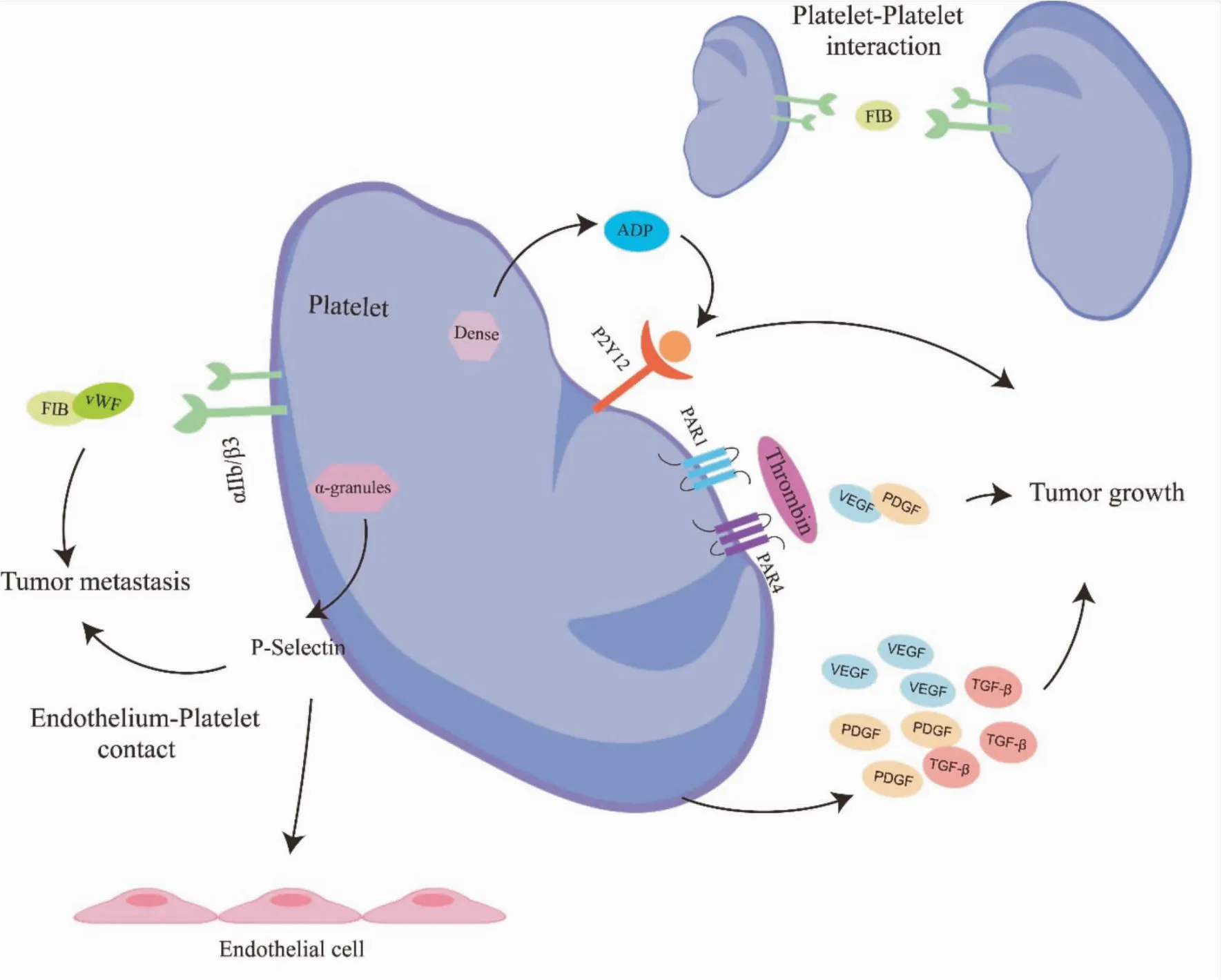
Fig 1 Role of platelets in tumor growth and metastasis
2.1.2GPVI抑制剂 临床开发中的其他新型抗血小板药物包括Revacept,一种可溶性二聚糖蛋白VI-Fc融合蛋白,它可以干扰胶原诱导的血小板激活。其已被证明能与血管损伤部位的胶原特异性结合,从而抑制血小板的粘附和聚集。与其他抗血小板药物不同的是,Revacept被认为可以阻止胶原介导的血小板与动脉粥样硬化内皮细胞的相互作用,而不会影响出血时间[13]。
2.2 P选择素拮抗剂在癌症治疗中靶向选择素的新化合物开始出现。Rivipansel(GMI-1070)是一种人工合成的小分子拟糖物,作为泛选择素拮抗剂发挥作用,可在体外和体内抑制选择素结合和选择素介导的效应。Rivipansel对P-选择素、L-选择素和E-选择素均有抑制作用。这种药剂已经被证明能够减少多发性骨髓瘤(MM)恶性浆细胞向骨髓归巢并增加它们对硼替佐米的敏感性[14]。Crizanlizumab是一种人源化单克隆抗体,可结合并抑制P-选择素,从而阻断P-选择素与其配体PSGL-1的相互作用。2019年11月FDA批准Crizanlizumab用于治疗镰状细胞病(SCD)的并发症,以减少16年以上镰状细胞疾病患者的疼痛频率[15]。这种新药在治疗癌症方面的作用还不清楚。
2.3 蛋白酶激活的凝血酶受体抑制剂PAR1已被证明是一种癌基因,是一种新兴的抗癌药物靶点。PAR1与实体瘤的进展相关,包括原发性生长、侵袭、转移和血管生成。沃拉帕沙(Vorapaxar)、PZ-128和阿托帕沙(Atopaxar)是3种PAR1抗血小板药物。Vorapaxar是美国食品和药物管理局(美国和欧洲)于2014年5月批准的第一种PAR1拮抗剂,用于降低心肌梗塞、中风和心血管死亡的风险,并用于既往心肌梗塞或外周血管疾病患者的血管重建。PZ-128(P1pal-7)是一种很有前途的抗血小板药物,它在15 min时表现出快速的血小板PAR1抑制,比P2Y12口服药物氯吡格雷起效更快[16]。PZ-128在乳腺癌小鼠模型中可抑制肿瘤生长和转移[17]。Atopaxar是一种PAR1小分子抑制剂,以前称为E5555,是一种双环脒衍生物,被证明可以抑制凝血酶诱导的人血小板聚集[4]。
2.4 阿司匹林阿司匹林是一种抗血小板药物,其抗癌活性已经在体外、动物模型和临床试验中得到了彻底的研究,已被公认为是一种很有前途的抗癌药物,但其在化学预防中的确切作用机制尚不十分清楚。阿司匹林是一种不可逆的环氧合酶(COX)抑制剂,通过乙酰化丝氨酸残基,减少花生四烯酸合成前列腺素E2(PGE2)和血栓素A2(TXA2)。COX-1 在血小板和胃上皮细胞中表达,负责血小板中 TXA2 的产生和胃黏膜中细胞保护性前列腺素的基础产生[2];COX-2基因是一个具有许多调节位点的主要反应基因。COX-2通常情况下在大多数细胞中都不表达,而在病理条件下,COX-2在癌细胞中过度表达[13]。小剂量阿司匹林通过选择性乙酰化COX-1的COX活性位点内529位(Ser529)的一个丝氨酸残基的羟基,引起血小板COX-1活性的不可逆抑制。
2016年,美国预防服务小组建议使用小剂量阿司匹林预防结直肠癌。这是使用抗血小板药物预防癌症转移的一个里程碑事件。阿司匹林的实验证据也证明了血小板相关的机制。有研究证明,血小板显著增强卵巢癌细胞的转移活性,而阿司匹林和P2Y12抑制剂2MeSAMP联用可抑制血小板功能,破坏转移性卵巢癌级联反应中的关键外渗步骤,减少肿瘤转移[18]。阿司匹林在抑制COX-1活性和血栓形成的剂量下减少了B16F10黑色素瘤、MC-38-GFP、4T1和MDA-MB-231-CFP小鼠模型的转移性肺结节的数量,表明阿司匹林对转移有广泛的抑制作用[19]。这些发现强调了阿司匹林在癌症预防中的血小板依赖性作用。
2.5 ADP P2Y12受体拮抗剂氯吡格雷(Plavix)是血管疾病治疗中应用最广泛的P2Y12受体拮抗剂[1]。有研究表明,氯吡格雷能够抑制小鼠胰腺癌晚期自发性血栓形成,并且减少胰腺癌小鼠的肿瘤生长、转移发展并增加其存活率[20]。
替格瑞洛(Ticagrelor)是一种可逆性口服P2Y12受体拮抗剂。在血小板-肿瘤细胞相互作用的体外模型中,替格瑞洛减少了结直肠癌细胞(HT-29)诱导的血小板聚集和活化,并显著降低了HT-29在血小板存在下的粘附,同样在转移性癌症患者中,替格瑞洛可以显著减少自发性血小板聚集。这些发现支持进一步研究替格瑞洛单药治疗在有血栓并发症(例如静脉血栓栓塞)风险的癌症患者群体中的潜在作用[21]。
P2Y12拮抗剂和癌症风险之间的关系仍有争议。双重抗血小板治疗(DAPT)通常是阿司匹林和P2Y12拮抗剂的组合,通常用于预防和治疗心脑血管和周围血管疾病。因此延长DAPT持续时间是否能为治疗心血管疾病带来更大的益处呢?有研究比较了ACS患者药物洗脱支架置入后使用噻吩吡啶延长DAPT 30个月与12个月的疗效和安全性,结果发现,在死亡病例中,延长DAPT组的新实体瘤发病率较高,与癌症相关的死亡病例显著增加。FDA对这项研究的评估发现,癌症诊断相对增加了约60%,癌症相关死亡率也相应增加[22]。之后,FDA报告了两项试验级荟萃分析的高水平汇总统计数据,探讨了氯吡格雷与癌症的相互作用。一项荟萃分析侧重于癌症相关的不良事件,包括四项试验(37 835名患者),而第二项荟萃分析评估了五项试验(40 855名患者)的癌症相关死亡。这两项荟萃分析均否定了DAPT与氯吡格雷患者癌症相关性的假设。因此,FDA得出结论,氯吡格雷对癌症没有影响[23]。考虑到现有证据,可以谨慎地假设P2Y12拮抗剂治疗在癌症风险方面是安全的。
2.6 磷酸二酯酶抑制剂磷酸二酯酶(PDE)催化细胞内cAMP和cGMP水解为失活的5‘AMP和5’GMP。血小板表达PDE2、PDE3和PDE5,它们被抑制会提高cAMP,cGMP在血小板内的水平,从而抑制血小板的激活。在作为抗血小板药物开发的选择性PDE抑制剂中,西洛他唑(Cilostazol)和双嘧达莫(Dipyridamole)已被探索为可能的癌症辅助治疗。西洛他唑已广泛应用于外周血管疾病患者,它通过激活环磷酸腺苷(CAMP)来抑制PDE3的产生。是血小板和平滑肌细胞中PDE3的特异性和强效抑制剂[5]。西洛他唑通过选择性地抑制PDE3,减少人乳腺癌细胞MDA-MB-231细胞侵袭和迁移能力,同样在小鼠MDA-MB-231乳腺癌模型中,给予西洛他唑可显著抑制肿瘤生长和转移[24]。双嘧达莫是一种冠脉扩张剂,目前正作为抗血栓药物与阿司匹林联合用于卒中的二级预防。双嘧达莫不仅通过作为PDE5和PDE3的抑制剂来抑制血小板功能,而且还通过抑制红细胞对腺苷的再摄取来抑制血小板功能[5]。双嘧达莫作为甲磺酸伊马替尼的佐剂所提供的有益作用可以改善甲磺酸伊马替尼的化疗作用并减轻其严重的肝毒性。此外,二者联用可以增加肿瘤内甲磺酸伊马替尼浓度、增强凋亡途径、抑制癌细胞增殖和血管生成,有着优越的抗癌活性[25]。

Tab 1 Platelet receptors that affect tumors and drug candidates targeting these receptors
3 其他治疗策略
3.1 靶向与癌细胞上的血小板相互作用的相应受体预防血小板与癌症相互作用的一种方法是靶向血小板。可以合理地推测,靶向与癌细胞上的血小板相互作用的相应受体也可以抑制癌症转移。有研究描述了一个限制原位肿瘤细胞与肿瘤微环境(TME)之间直接接触的自组装策略。通过涂有透明质酸(HA)的脂质体靶向肿瘤的Lys-Leu-Val-Phe-Phe(KLVFF)肽基序 ,并自发地组装形成网状结构的纳米纤维,包裹在肿瘤细胞周围。纤维纳米结构掩盖了膜的突起,从而阻碍肿瘤细胞的迁移和侵袭。肿瘤细胞上的纳米纤维涂层显著阻断肿瘤细胞诱导的血小板聚集,在体外诱导血小板聚集,防止血小板在体内循环肿瘤细胞(CTC)周围粘附,从而限制了血小板的促转移作用,防止了早期转移。此外,纳米网在原发肿瘤部位稳定保留72 h以上,有效防止肿瘤内血小板活化,抑制肿瘤进展和4T1乳腺癌小鼠模型中自发性肺转移[26]。
3.2 血小板膜包覆的纳米颗粒膜包覆的纳米颗粒具有生物相容性,血液循环时间增强,并且对肿瘤细胞具有天然靶向性,因此被广泛研究。使用不同形式的细胞膜装饰各种纳米颗粒,包括红细胞、白细胞、血小板、干细胞、癌细胞,甚至细菌或它们的杂交种。来自血小板的细胞膜在保护纳米颗粒免受免疫系统和血液清除方面显示出了较好的效果[27]。Hu等[28]首次报道了包裹在人血小板质膜中的聚合物纳米颗粒的制备,他们通过反复冻融法制备了血小板膜,并通过简单的超声实现了膜包被。在这项开创性的工作之后,许多血小板膜包被的纳米颗粒被设计成将抗癌药物递送到CTC或TME。聂广军等通过将血小板膜与功能化合成脂质体相结合来构建纳米载体。由于其基于血小板膜的伪装,它具有增强的肿瘤亲和力,可以通过酸性TME(pH 6.8)和溶酶体微环境(~pH 5)的触发释放化疗药物。在小鼠结肠癌细胞系CT26,小鼠乳腺癌细胞系4T1癌症模型中,它显示出比不具有pH反应性的纳米制剂或基于传统pH敏感脂质体的纳米制剂更好的抗肿瘤效果[29]。
使用血小板膜包覆纳米颗粒进行治疗药物递送是一种有效策略,但同样面临着一些问题,比如大规模生产的局限性,安全性等。如果纳米颗粒没有被血小板膜完全覆盖或膜在储存过程中脱落,随着内部材料的暴露,有很大的可能在循环和器官中引起副作用。因此,必须仔细研究其在体外和体内的长期稳定性。癌症相关血小板靶向纳米药物的设计应足够仔细,以防止可能的风险[27]。
4 靶向血小板治疗癌症的挑战
目前的抗血小板药物永久性地抑制血小板聚集的靶点,但是出血风险仍然难以避免。在开发干预血小板-癌细胞相互作用的治疗药物时,需要思考的问题是如何在维持正常的血小板止血功能的同时,又能抑制血小板中起促癌作用的靶点。深入了解血小板和肿瘤细胞之间相互作用的信号通路将有助于确定靶向治疗策略,从而阻断血小板-肿瘤细胞相互作用。已有的抗血小板药物不能完全满足临床需求,目前所有可用的抗血小板药物都存在限制其临床疗效的缺点。例如,阿司匹林的使用与严重的胃肠道副作用有关,患者大出血风险增加[30];替格瑞洛最常见的副作用是呼吸困难和轻微出血[21]。鉴于该现状,人们致力于寻找更加安全有效的抗血小板药物,寻找抗血小板的新作用靶点。由于人们生活方式的改变,出现了新的挑战,比如人们患肥胖、糖尿病等代谢性疾病的人数增加,而这些疾病会影响到抗血小板药物的治疗,使问题更复杂,所以个性化治疗显得尤为重要。
如今已开发了一些新的抗血小板药物,但还未上市。抗血小板药物的研发存在着许多挑战和阻碍,因此更应该高度关注,以便充分揭示其复杂的作用及机制。设想一下,未来抗血小板药物的设计也许还可能对抗肿瘤血管生成或肿瘤血管正常化具有选择性作用。