LncRNA p21调控Hippo-YAP信号通路对小鼠腹主动脉瘤形成的影响及机制
2024-01-22王晋军张林林郭莲莲张中旺张娟子
陈 啸,王晋军,张林林,郭莲莲,张中旺,张娟子
(青岛大学附属青岛市海慈医院血管外科, 山东 青岛 266023)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是一种常见的主动脉退行性疾病[1],伴随人口老龄化以及新技术的快速发展,目前我国AAA发病率和检出率呈逐年上升趋势。既往研究已证实,AAA是一种慢性血管并发症,其机制与血管壁炎症反应、细胞外基质降解以及平滑肌细胞消耗等病理过程密切相关[2]。平滑肌细胞作为血管壁的重要组成部分,凋亡和增殖抑制是AAA疾病发生发展的关键因素[3]。因此,通过调控平滑肌细胞功能可能是治疗AAA的关键所在。
长链非编码RNA(long non-coding RNA,LncRNA)是一种长度大于200 nt的非编码RNA,具有位置的表达特异性,从而参与特定组织/细胞功能调节[4]。新近研究发现,LncRNA同样参与AAA疾病的发生发展。研究表明[5],LncRNA p21能够通过促进血管平滑肌细胞衰老,从而加重AAA形成。另外,亦有研究证实,LncRNA p21能够通过促进血管平滑肌细胞合成以及炎症反应,从而介导AAA形成[6]。以上研究表明,LncRNA p21可能是临床治疗AAA的潜在新靶点。但是目前有关LncRNA p21是用过何种分子机制介导血管平滑肌细胞功能变化,特别是平滑肌细胞凋亡和增殖过程,从而促进AAA形成机制尚不清楚。为此,本研究拟通过构建血管紧张素Ⅱ(angiotensin II,AngⅡ)诱导小鼠AAA模型,探究LncRNA p21对AAA小鼠血管平滑肌细胞凋亡和增殖的影响及其调控机制,以期为AAA的临床治疗提供新的靶点和实验依据。
1 材料与方法
1.1 材料
1.1.1动物 SPF级,雄性,C57BL/6 载脂蛋白E基因敲除(ApoE-/-)小鼠40只,体质量100~120 g,购自北京维通利华实验动物技术公司,生产许可证:SCXK(京)2018-0017。动物适应性喂养1周,期间自由饮水,昼夜交替光照,温度维持在20~25 ℃,相对湿度60%~70%。动物实验符合3R原则,且通过我院动物医学伦理委员会审查批准(SYL-2021-10-003)。
1.1.2主要试剂 Ang Ⅱ(华北制药厂,批号:S10950163);二辛可酸(bicinchonininc acid,BCA)蛋白浓度测定试剂盒、牛血清白蛋白(bovine serum albumin,BSA)、苏木精-伊红(hematoxylin and eosin staining,HE)染色试剂盒、原位末端标记(TUNEL)染色检测试剂盒、显影液、β-actin抗体(上海碧云天生物技术公司,批号分别:P0012S、ST023、C0105S、C1091、AF5001、P0019);免疫组化试剂盒(北京中杉金桥生物技术有限公司,批号:SP-9001);基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)抗体、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)抗体、组织金属蛋白酶抑制因子1(tissue inhibitors of metalloproteinase-1 ,TIMP-1)抗体、YAP抗体(美国Cell Signaling Technology公司,批号:40994、13667、8946、14074、72804);TRIzol裂解液(美国Invitrogen公司,批号:AM7001);RNA提取试剂盒(广州锐博生物公司,批号:C11027-2);
1.1.3主要仪器 AngⅡ痕量缓释泵(美国Corning公司,型号:34DB);多功能酶标仪(长春乐镤科技有限公司,型号:LP-5117);荧光倒置显微镜(日本Olympus,型号:CKX53);高速冷冻离心机(湖南可成仪器设备有限公司,型号:H3-18KR);凝胶成像系统(美国Bio-Rad伯乐公司,型号:Gel Doc XR+);qRT-PCR仪(瑞士巴塞尔罗氏诊断,型号:LightCycler480 II);-80 ℃冷冻冰箱(日本SANYO公司,型号:MDF-C8V(N))。
1.2 方法
1.2.1AAA模型构建及分组 选取40只C57BL/6 ApoE-/-小鼠随机分为4组:假手术组(sham)、模型组(model)、LncRNA p21阴性对照组(sh-NC)、LncRNA p21敲低组(sh-LncRNA p21)。每组各10只。利用1%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉小鼠。sham组小鼠皮下植入生理盐水微量缓释泵。model组小鼠行皮下植入AngⅡ渗透性微量泵(15 mg·kg-1·d-1),连续28 d,构建腹主动脉瘤小鼠模型[7]。Sh-NC组小鼠于造模前尾静脉注射由广州锐博公司合成的LncRNA p21阴性对照shRNA(50 n),并经腺病毒转染至体内,注射后30 d进行AAA小鼠模型造模,造模方式同model组。sh-LncRNA p21组小鼠于造模前尾静脉注射LncRNA p21(50 nmol·L-1,合成片段由上海生工生物工程股份有限公司提供)干扰shRNA,并经腺病毒转染至体内,注射后30 d行AAA小鼠模型造模,造模方式同model组。通过提取sh-NC和sh-LncRNA p21组小鼠腹主动脉组织RNA进行PCR检测转染效率。
1.2.2各组小鼠相关指标检测 各组小鼠分别饲养28 d后,断头法处死。打开胸腔,解剖显微镜下观察腹主动脉形态变化并拍照。实验以腹主动脉肾上段最大外侧宽度大于正常组小鼠腹主动脉肾上段最大外侧宽度约50%定为腹主动脉瘤。留取各组小鼠腹主动脉精准测量最大外径,并利用ImageJ进行图像分析,获得各组小鼠的腹主动脉血管最大直径。
1.2.3HE染色观察腹主动脉血管形态变化 28 d实验结束后,腹腔注射1%戊巴比妥钠麻醉小鼠,快速打开胸腔及腹腔,暴露腹主动脉。前开左心耳,行心脏灌流,分离心脏、主动脉、腹主动脉及髂动脉、双肾动脉。剪取合适大小腹主动脉组织(正常组织及腹主动脉瘤组织),将其采用10%多聚甲醛固定2 h、脱蜡、切片、制作厚度为3~5 μm切片,行HE染色,观察各组小鼠血管壁以及炎症细胞浸润等情况。
1.2.4血管弹力纤维染色 腹主动脉切片同“1.2.3”,之后按照Verhoeff-Van Gieson(VVG)试剂盒说明进行染色。弹性蛋白降解评分:1、2、3、4级。分级越高表明弹性蛋白断裂或丢失越严重,腹主动脉受损程度越高。
1.2.5TUNEL染色检测细胞凋亡 组织片切片同“1.2.3”,与50 μL TUNEL 工作溶液在37 ℃的恒温箱中孵育1 h。 之后,将切片用50 μL converter-POD溶液在37 ℃下保持30 min,然后用50 μL 二氨基联苯胺(diaminobenzidine,DAB)溶液在室温下孵育10 min。 最后用苏木精标记细胞核,随机选取6个视野并在400×荧光显微镜下对凋亡细胞进行分析。
产业的发展离不开职业教育的发展。高质量的职业教育是地方经济蓬勃发展的重要源泉,能为地方产业的创新和转型注入活力。但是,伴随着知识型社会对人才发展的要求不断提升,职业教育在教育模式和专业水平等方面存在的矛盾日益突出,职业教育改革和升级迫在眉睫。
1.2.6免疫组化检测血管组织YAP、TAZ表达 按照“1.2.3”取各组小鼠腹主动脉组织切片,经3% H2O2溶液孵育10 min,85 ℃抗原修复,加10% BSA溶液封闭20 min;加YAP和TAZ兔单克隆抗体(工作液体积稀释比例为1 ∶200),4 ℃孵育过夜;加对应山羊抗兔二抗,室温孵育30 min;滴加DAB显色液,于200倍视野下随机选取6个视野进行拍照,利用Image Pro Plus软件进行图像分析。通过图像分析软件和系统测定各组小鼠乳腹主动脉组织YAP、TAZ蛋白阳性表达面积以及积分光密度值(optical density,OD),以单位面积平均IOD(IOD/unit area)作为组织蛋白表达定量标准。
1.2.7Western blot检测血管组织相关蛋白表达 28 d实验结束后,立即将小鼠处死,剪取适量小鼠腹主动脉组织并提取总蛋白,按照1 ∶5质量与体积比加入裂解液,于4 ℃条件下裂解40 min;BCA法测定各组腹主动脉组织蛋白质浓度;蛋白上样(按照每孔上样量40 μg计算得出上样体积);凝胶电泳;湿转法转膜;5% BSA室温封闭2 h;分别加MMP-2抗体(1 ∶1 000)、MMP-9抗体(1 ∶1 000)、TIMP-1抗体(1 ∶1 000)、YAP抗体(1 ∶1 000)、TAZ抗体(1 ∶1 000)及β-actin抗体(1 ∶2 000),4 ℃孵育过夜;加对应的山羊抗兔二抗或者山羊抗鼠二抗(1 ∶5 000),室温孵育1~2 h;TBST洗涤3次,每次5 min,滴加显影液,显影并拍照。
1.2.8qRT-PCR检测腹主动脉血管组织LncRNA p21表达 使用TRIzol试剂从主动脉组织中分离、提取总RNA,然后依据制造商提取的逆转录试剂盒将RNA逆转录为cDNA。接下来,根据Light Cycler 480 Ⅱ系统上提供的方案,使用SYBR Premix Ex TaqTM试剂盒进行定量qRT-PCR(扩增条件:92 ℃,30 s;92 ℃,5 s;60 ℃,31 s,循环40次)。最后使用 2-ΔΔCT方法计算法将腹主动脉组织中LncRNA p21的相对表达统一归化为 β-actin。引物序列LncRNAp21:F-5′-CAGCCAGAAAGGACTCCAACTCC-3′;R-5′-GGAGGCAGCTGGTGCTGAAAG-3′;β-actin:F-5′-CATCGTCCACCGCAAATGCTTC-3′;R-5′-AACCGACTGCTGTCACCTTCAC-3′。
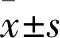
2 结果
2.1 LncRNA p21在小鼠AAA中表达变化造模28 d后,与sham组相比,model组小鼠AAA发生率、主动脉直径和主动脉质量比明显增加(P<0.01),且腹主动脉血管壁增厚,中膜及外膜出现大量炎症细胞浸润,血管弹力纤维断裂、紊乱,表明AAA小鼠模型构建成功。qRT-PCR检测显示,与sham组相比,model组小鼠腹主动脉血管组织LncRNA p21表达明显升高(P<0.01),见Fig 1。
2.2 LncRNA p21对小鼠AAA形成的影响为探究LncRNA p21对小鼠AAA形成的影响,本研究通过AAA小鼠尾静脉注射sh-LncRNA p21观察小鼠AAA形成情况。结果显示,与model组相比,sh-LncRNA p21组小鼠AAA发生率、主动脉直径和主动脉质量比明显降低(P<0.01)。HE和VVG染色显示,与model组相比,sh-LncRNA p21组小鼠腹主动脉血管壁厚度降低、中膜层和外膜层炎症细胞浸润减轻,血管弹力纤维粗且断裂减少。为进一步明确LncRNA p21对小鼠AAA小鼠形成的影响。Western blot检测MMP-2、MMP-9和TIMP-1蛋白表达。结果显示,与sham组相比,model组小鼠血管组织MMP-2、MMP-9表达增加,TIMP-1表达降低(P<0.01)。与model组相比,sh-LncRNA p21组小鼠血管组织MMP-2、MMP-9表达降低(P<0.01),TIMP-1表达增加(P<0.05),见Fig 2。
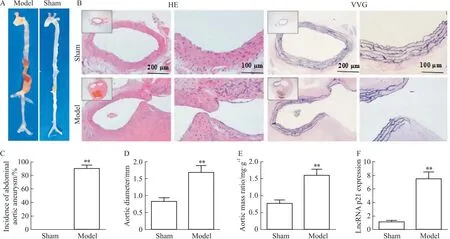
Fig 1 Changes in expression of LncRNA p21 in AAA n=6)
2.3 LncRNA p21对主动脉平滑肌细胞凋亡和增殖的影响与sham组相比,model组小鼠血管平滑肌细胞凋亡率、caspase-3蛋白表达明显增加,cyclinD1表达降低(P<0.01)。与model组相比,sh-LncRNA p21组小鼠血管平滑肌细胞凋亡率、caspase-3蛋白表达明显降低,cyclinD1表达增加(P<0.01),表明LncRNA p21能够诱导AAA小鼠血管平滑肌细胞凋亡,抑制其增殖,见Fig 3。
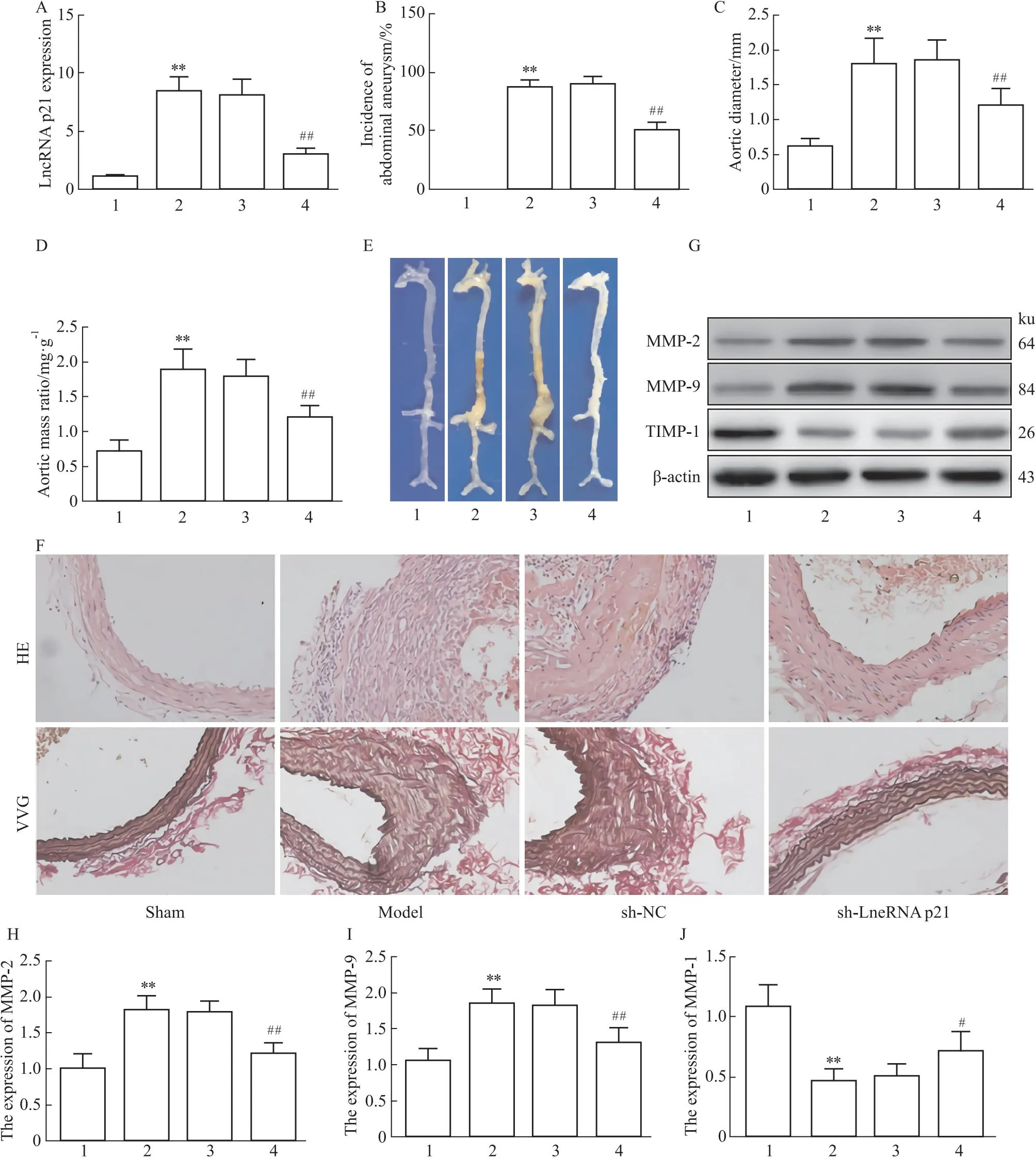
Fig 2 Effect of LncRNA p21 on formation of AAA in mice n=6)
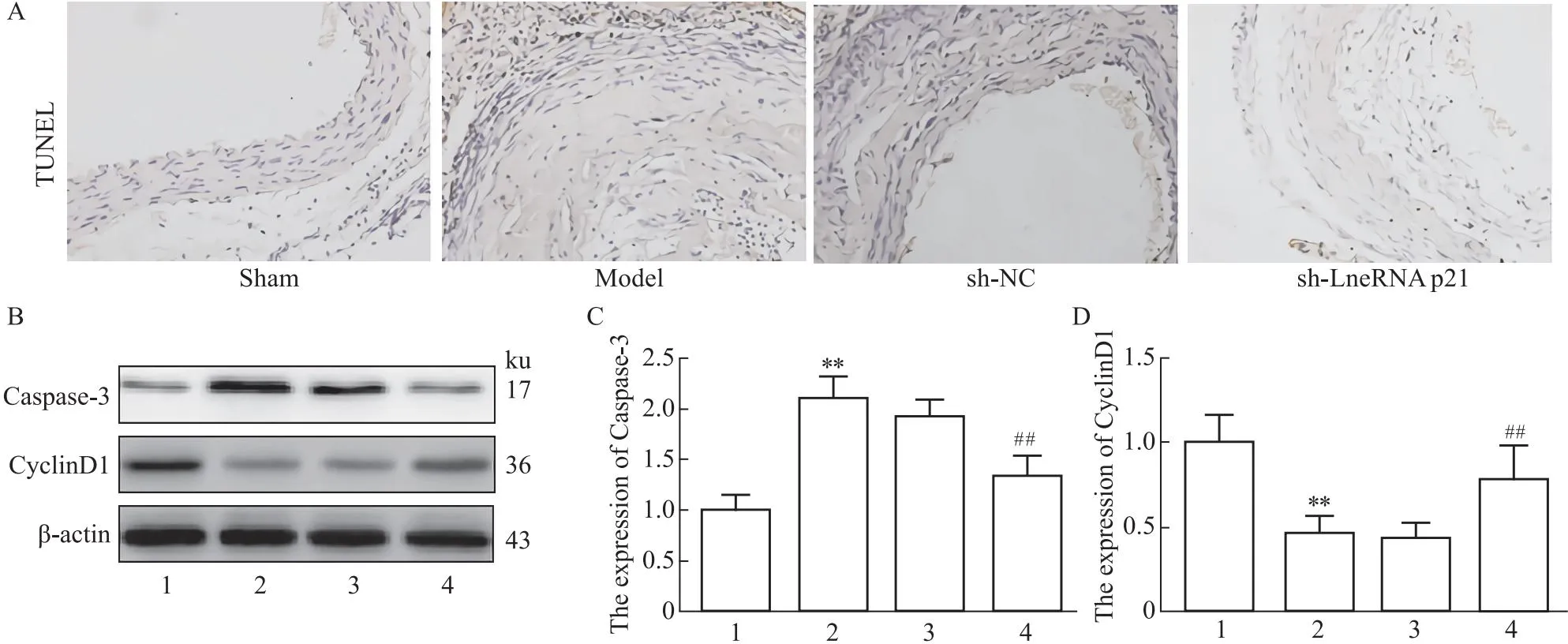
Fig 3 Effect of LncRNA p21 on apoptosis and proliferation of vascular smooth muscle cells in AAA n=6)
2.4 LncRNA p21对Hippo-YAP信号通路的影响免疫组化检测显示,与sham组相比,model组小鼠腹主动脉血管组织YAP、TAZ阳性表达明显降低(P<0.01)。与model组相比,sh-LncRNA p21组小鼠腹主动脉血管组织YAP、TAZ阳性表达明显增加(P<0.01)。Western blot检测显示,与sham组相比,model组小鼠腹主动脉血管组织YAP、TAZ蛋白表达明显降低(P<0.01)。与model组相比,sh-LncRNA p21组小鼠腹主动脉血管组织YAP、TAZ蛋白表达明显增加(P<0.01),见Fig 4。
3 讨论
AAA是一种常见的,具有潜在的致命性血管动脉瘤,主要与高血压、高血脂、动脉粥样硬化等心血管高危因素密切相关。现如今学术界普遍认为AAA的发病机制较为复杂,涉及动脉血管壁炎症反应、血管平滑肌细胞丢失、氧化应激等,从而诱发主动脉血管局部不间断膨大,并最终导致主动脉血管壁形成不可挽救的损伤[8]。目前,临床上有关AAA的外科手术治疗以及常规药物治疗能够改善其临床症状,但是AAA破裂导致的患者因抢救无效而快速死亡的发生率一直居高不下。因此,通过明确AAA的发病机制,寻找其有效防治措施,从而在源头上降低AAA发生率对临床具有重大意义。
非编码RNA一直以来是AAA疾病发生发展的研究热点与难点。研究已证实如miRNAs能够通过靶向相关功能蛋白,从而调节炎症反应、凋亡以及细胞外基质(extracellular matrix,ECM)降解等参与AAA形成[9]。作为非编码RNA中一种LncRNAs能够通过影响蛋白的转录及翻译等过程,参与机体众多生理病理过程。同样,LncRNAs亦参与了AAA的形成。新近研究显示,LncRNA LBX2-AS1、LncRNA GAS5可以通过影响血管平滑肌炎症和细胞凋亡过程参与AAA的形成[10-11],表明LncRNAs可能是AAA治疗的潜在靶点。因此以LncRNAs为切入点进行AAA研究具有重要意义。LncRNA p21是位于人第6号染色体上不编码蛋白质的非编码RNA,受p53基因调控,同时又是p53信号通路转录抑制因子,能够触发细胞凋亡[12]。研究发现,LncRNA p21是一种细胞凋亡、增殖等调节因子,参与了AAA的形成[6]。为此本研究通过AngⅡ诱导ApoE-/-小鼠AAA模型,明确LncRNA p21表达。结果显示AngⅡ诱导组小鼠腹主动脉血管壁增厚,中膜及外膜出现大量炎症细胞浸润,血管弹力纤维断裂,紊乱,且主动脉直径和主动脉质量比显著增加,表明AAA小鼠模型构建成功。相比于正常小鼠,AAA小鼠腹主动脉组织LncRNA p21表达明显增加,这一结果与Guo等[5]研究一致。血管平滑肌细胞是血管壁的重要组成部分,其细胞丢失、增殖抑制以及ECM降解均是AAA发生的关键。既往研究发现,在AAA小鼠血管组织中MMP相关蛋白表达和活性的增强以及TIMP相关蛋白表达的降低能够促进血管平滑肌细胞凋亡和ECM降解,从而导致AAA形成[13]。因此,本研究将LncRNA p21与血管平滑肌增殖、凋亡及ECM降解的关系作为研究重点。以往研究报道在动脉粥样硬化中LncRNA p21能够抑制血管平滑肌细胞增殖,促进凋亡。而降低LncRNA p21能够有效改善颈总动脉血管内膜损伤[14]。为此,本研究推测LncRNA p21可能通过调控血管平滑肌细胞增殖、凋亡和ECM,促进AAA形成。为明确LncRNA p21对AAA血管平滑肌细胞增殖、凋亡和ECM降解的作用。本研究通过AAA小鼠尾静脉注射sh-LncRNA p21。结果显示,与sham组小鼠相比,model组小鼠血管平滑肌细胞凋亡增加,增殖被抑制,MMP-2、MMP-9蛋白表达升高及TIMP-1蛋白表达降低,再次表明血管平滑肌细胞增殖、凋亡及ECM降解是AAA形成的关键。Xue等[15]研究证实,AngⅡ可以诱导小鼠型主动脉血管平滑肌细胞凋亡增加,其机制与MMP-2、MMP-9表达增加引起的ECM降解密切相关。TIMP-1作为MMPs的重要调控因子,可调节MMPs表达。与model组相比,AAA小鼠尾静脉注射sh-LncRNA p21能够上调MMP-2、MMP-9,下调TIMP-1,抑制ECM降解,降低血管平滑肌细胞凋亡,促进其增殖。
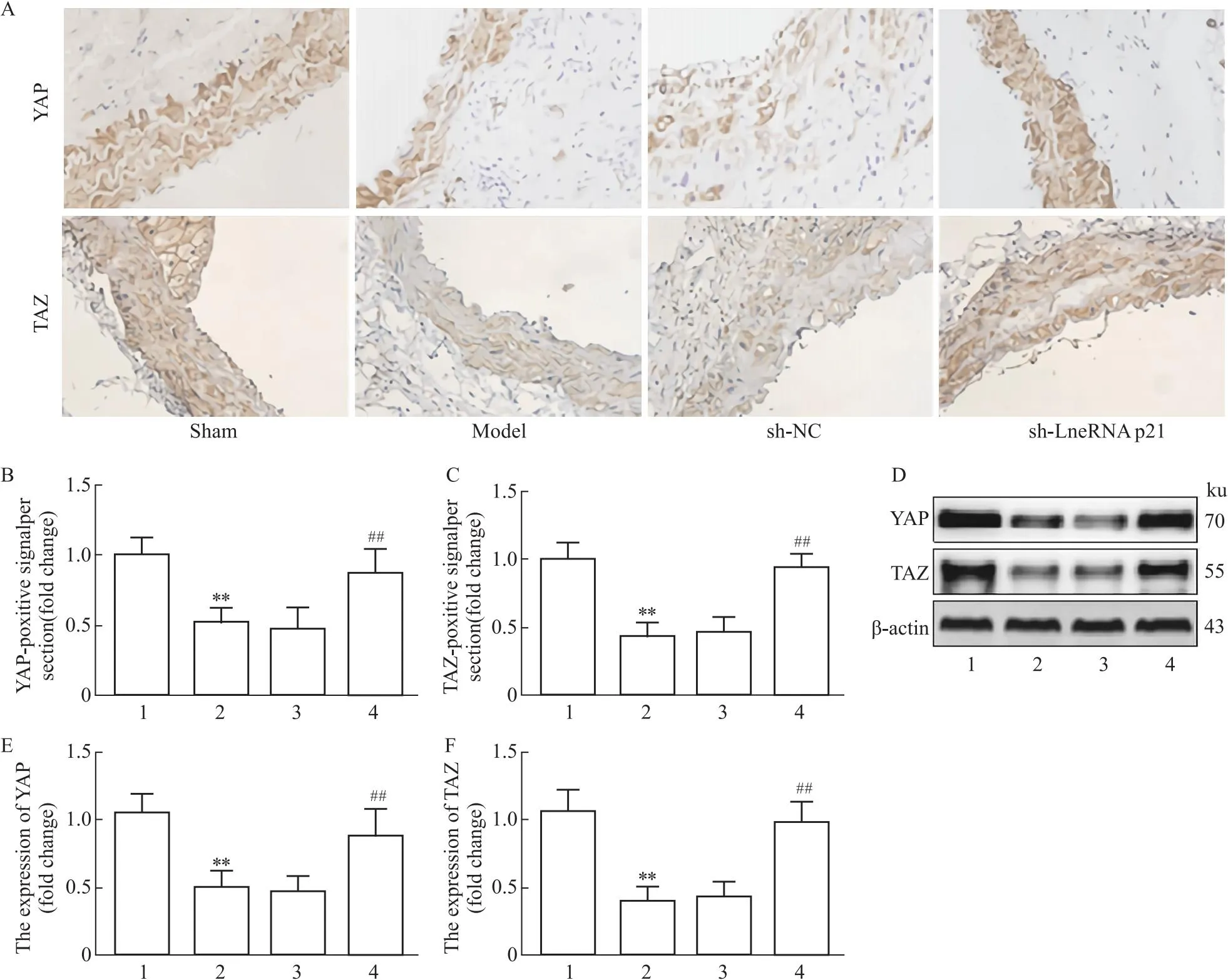
Fig 4 Effect of LncRNA p21 on
Hippo-YAP信号通路与细胞增殖、凋亡密切相关。YAP、TAZ作为Hippo信号通路的主要转录共激活因子,能够克服细胞接触抑制,促进细胞增殖,抑制细胞凋亡,从而加快恶性肿瘤的发展[16]。另外,研究发现,通过阻断Hippo信号,能够上调YAP、TAZ表达,促进肿瘤细胞增殖及肿瘤恶化[17]。新近研究证实,在Ang Ⅱ诱导AAA小鼠模型及AAA患者血管组织中YAP表达明显降低,而过表达YAP能够促进血管平滑肌细胞增殖,抑制凋亡,减弱AAA的形成[18]。本研究发现,与sham组相比,model组小鼠YAP、TAZ表达明显降低。与model组相比,sh-LncRNA p21组小鼠YAP、TAZ表达明显增加。
综上所述,通过探究LncRNA p21对小鼠AAA形成的影响及其调控机制。结果发现LncRNA p21能够促进小鼠AAA形成,其机制与调控Hippo-YAP信号,下调YAP、TAZ表达,促进细胞凋亡,抑制细胞增殖相关。以上研究结果初步揭示了LncRNA p21在AAA形成中的机制,为临床防治AAA提供了新的潜在干预靶点。但是本研究也存在一定的局限性,未能进一步阐明LncRNA p21是如何影响Hippo-YAP信号激活。为此本研究后续将通过生物信息学方法预测LncRNA p21下游靶miRNAs,通过荧光素酶报告基因和过表达实验明确LncRNA p21对Hippo-YAP信号转导的直接或间接调控作用。
