薄荷醇对低压低氧诱导小鼠肺动脉高压的作用及机制研究
2024-01-22王武帅何滢蓉1曦1段清华1强1
王武帅,胡 陶,杨 耀,何滢蓉1, ,杨 曦1, ,段清华1, ,杜 萱,4,王 强1,
(1. 西南医科大学临床医学院心血管内科,四川 泸州 646000; 2. 西部战区总医院心血管内科, 四川 成都 610083;3. 西部战区总医院药剂科,四川 成都 610083;4. 成都医学院,四川 成都 610500)
肺动脉高压(pulmonary arterial hypertension, PAH)是由多种原因引起的肺动脉压异常升高的一大类疾病,其血流动力学诊断标准为:海平面静息状态下,右心导管检测肺动脉平均压≥25mmHg[1]。根据最新欧洲指南,PAH分为五大类,低氧性肺动脉高压(hypoxia-induced pulmonary hypertension, HPH)属于第三类,由于机体慢性缺氧,造成肺血管收缩和重构,肺循环阻力增加,而导致肺动脉高压,引起右心室肥大,右心功能不全,最终发展为右心功能衰竭,造成患者死亡[2]。我国有大量人群长期居住在青藏高原地区,低氧性肺动脉高压的患病率居高不下,由此造成的心力衰竭是高原地区人群死亡的重要原因,因此,探讨低氧性肺动脉高压的发生机理和寻找新的治疗手段是当前亟待解决的重要问题[3-4]。
瞬时受体电位通道M8(transient receptor potential melastatin 8, TRPM8)是一种阳离子通道,可以被薄荷醇和寒凉性药物(如:樟脑、桉油素和icilin等)激活,在心血管及代谢功能调控中发挥重要作用[5]。既往发现TRPM8通过调控血管平滑肌细胞RhoA/ROCK-2激酶活性和线粒体氧化应激舒张血管,降低外周血压[6-7]。然而,TRPM8在肺血管和低氧性肺动脉高压中的作用尚不完全清楚。本实验拟通过构建野生型及TRPM8基因敲除(TRPM8-/-)小鼠低压低氧性肺动脉高压模型,研究薄荷醇通过激活TRPM8对小鼠低压低氧性肺动脉高压的作用,观察薄荷醇对肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMCs)增殖和迁移能力的影响,并初步探讨其可能机制。
1 材料与方法
1.1 动物SPF级C57小鼠,雄性,10~12周龄,20~25 g,40 只,购自于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004,TRPM8基因敲除(TRPM8-/-)小鼠40只,10~12周龄,体质量20~25 g,购自美国Jackson实验室,严格按照实验动物3R原则给予人道的关怀,该实验经西部战区总医院伦理委员会批准通过(批件编号:2022EC2-ky038)。
1.2 主要材料薄荷醇(HY-75161)购于美国MedChemexpress生物科技公司,GAPDH(2118S)购于美国 Cell Signaling Technology 公司。PCNA抗体(60097-1-Ig)、KLF4抗体(11880-1-AP)、山羊抗兔Ⅱ抗(SA00001-2)购自中国武汉三鹰生物技术有限公司;BCA蛋白定量(PC0020)及全蛋白提取试剂盒(BC3710)均购于北京索莱宝生物有限公司;多道生理记录仪及压力传感器购自于成都仪器设备有限公司;苏木精-伊红(HE)染色试剂盒(G1120)购自北京索莱宝科技有限公司;DMEM高糖培养基(SH302343.01)、胰蛋白酶(SH30042.01)购于美国HyClone公司;胎牛血清(10091-148)购自美国Gibco公司。
1.3 主要方法
1.3.1动物实验分组及处理 将40 只SPF级10~12周龄野生型C57小鼠及TRPM8基因敲除(TRPM8-/-)小鼠随机分配到对照组(Control)、薄荷醇组(Menthol, Ment)、低压低氧组(Hypobaric hypoxia)、低压低氧+薄荷醇组(Hypobaric hypoxia+Ment);所有小鼠均在12 ∶12小时明暗循环,温度(22~24) ℃,湿度为50%~60%的环境中饲养,并予以充足的水和食物,喂养1周。对照组适应性喂养1周后,继续常氧常温环境下喂养6周;薄荷醇组适应性喂养1周后,予以薄荷醇饲料(0.5%薄荷醇)在常氧常温环境下喂养6周;低压低氧组适应性喂养1周后,予以放入低压低氧环境模拟舱中饲养6周,建立低压低氧下诱导肺动脉高压模型;低压低氧+薄荷醇组适应性喂养1周后,连续在低压低氧环境模拟舱中以含0.5%的薄荷醇饲料喂养6周[8]。
1.3.2低压低氧暴露条件及模型建立 低压低氧环境模拟舱的参数设定模拟海拔高度为5500 m,舱内压力维持达47~48 kpa,温度为(20~22) ℃,湿度为22%~23%/RH,相对氧浓度为10%~11%。将低压低氧组及低压低氧+薄荷醇组放入环境模拟舱中,确保水及饲料充足,环境模拟舱运行时间全天24 h,更换水、饲料及垫料的频次为3~4 d/次,每次开舱时间为30 min。
1.3.3小动物超声检测肺动脉血流频谱 使用异氟烷吸入麻醉,控制小鼠心率在400~650次/分,予以固定在操作台,使用超声探头记录肺动脉切面,多普勒超声测量肺动脉血流频谱,测量肺动脉加速时间(pulmonary acceleration time, PAT)和肺动脉射血时间(pulmonary ejection time, PET),计算PAT/PET比值,评估各组肺动脉压力变化情况。
1.3.4肺动脉压力及右心室指数测定 6周后,腹腔注射4%水合氯醛麻醉并固定小鼠,分离右颈外静脉,手术线阻塞血回流,通过右颈外静脉切口缓慢插入连接生物信号采集系统的聚乙烯导管,测量右心室收缩压(right ventricular systolic pressure,RVSP),采用RVSP反映肺动脉压力;测压结束后,开胸取肺组织,用磷酸盐缓冲液(phosphate buffer saline, PBS)冲洗干净,将部分肺组织固定在4%多聚甲醛中供后续实验,其余组织储存在液氮罐中备用。首先沿室间隔将心室分离右心室(right ventricle,RV)和左心室加室间隔 (left ventricle+septum,LV+S),滤纸吸去组织上多余水分,使用微量秤精准称量组织干重,计算右心室肥厚指数(right ventricular hypertrophy index, RVHI),RVHI=RV/(LV+S) 。
1.3.5肺组织HE染色 将固定于4%多聚甲醛的肺组织依次进行脱水、石蜡包埋、切片、脱蜡,进行肺组织HE染色,观察各组肺血管的病理变化,并使用OLYMPUS OlyVIA采集图像和计算肺动脉血管壁面积/血管总面积的百分比(WA /TA) 和血管壁直径/血管总直径(WT /TT)。
1.3.6蛋白质印迹分析 取各组肺组织100 mg,各滴加裂解缓冲液1 mL,碾磨充分后继续在冰浴中裂解30 min后移置于EP管,12 000×g4 ℃环境下离心30 min,并对各组样本进行蛋白定量。将蛋白上样于电泳道中,通过10% SDS-PAGE分离蛋白, PVDF转膜,用浓度为5%的BSA进行封闭1 h,将PVDF膜与GAPDH(1 ∶20 000)、PCNA(1 ∶1 000)、KLF4(1 ∶4 000)一抗稀释液充分结合,4 ℃过夜。24 h后复温30 min,TBST缓冲液洗膜30 min,二抗孵育1 h,再次TBST缓冲液洗膜30 min,显影并采图,ImageJ进行分析。
1.3.7细胞培养及分组 将肺动脉平滑肌细胞(PASMCs)分为常氧对照组(21%氧浓度,Control)、常氧+薄荷醇组(薄荷醇100 μmol·L-1,Ment)、低氧组(3%氧浓度,Hypoxia)、低氧+薄荷醇组(3%氧浓度+薄荷醇100 μ mol·L-1,Hypoxia+Ment),于37 ℃、5% CO2环境中培养。每间隔两天进行换液,待细胞密度达到90%左右,加入胰酶消化细胞,按照1 ∶3传代,分别在低氧环境及常氧环境中诱导小鼠PASMCs增殖和迁移。
1.3.8CCK-8实验 参照课题组前期方法[9],采用CCK-8检测薄荷醇对PASMCs增殖能力的影响。待细胞密度达到 80%~90%以上后将其消化,每组6个复孔,将细胞胞悬液以1× 108·L-1接种于 96 孔板中,按条件分别放置于常氧或低氧培养箱中培养 24 h 后,每孔加入 10 μL CCK-8 溶液,在37℃下避光孵育 2 h,将处理好的培养板置于酶标仪中,在 450 nm 波长处测定吸光度值(A),取均值。
1.3.9细胞划痕实验 参照课题组前期方法[9],采用划痕实验测量薄荷醇对PASMCs迁移能力的影响。将处理后的PASMCs分别接种于 6 孔板中(每孔细胞数目约 1×105个),当细胞密度增至90% 左右进行划痕实验,并记录完成划痕实验后0 h的划痕图。加入无血清培养液,按照分组要求给予处理,置于常氧或低氧培养箱中孵育,并采集划痕后24 h图片。
2 结果
2.1 薄荷醇对低压低氧诱导小鼠肺动脉血流频谱的影响多普勒心脏超声检测肺动脉血流频谱,计算PAT和PAT/PET,反映肺动脉压力变化。经过低压低氧环境诱导后,小鼠的肺动脉加速时间(PAT)和PAT/PET比值明显降低(P<0.01,Fig 1),证实低压低氧诱导小鼠肺动脉高压建模成功。在野生型小鼠中,与低压低氧组相比,低压低氧+薄荷醇组小鼠PAT、PAT/PET明显升高(P<0.05,Fig 1A,C,D);而在TRPM8-/-小鼠中,低压低氧+薄荷醇组小鼠PAT、PAT/PET未见明显变化(P>0.05,Fig 1B,C,D)。提示薄荷醇可能通过TRPM8改善肺动脉压力。
2.2 薄荷醇对小鼠肺动脉高压和右心室肥厚的影响本实验通过右心室收缩压(RVSP)反映肺动脉压力。经过低压低氧环境诱导后,小鼠的右心室收缩压(RVSP)和右心室肥厚指数(RVHI)明显增加(P<0.01,Fig 2),证实低压低氧诱导小鼠肺动脉高压建模成功。在野生型小鼠中,与低压低氧组相比,低压低氧+薄荷醇组小鼠RVSP和RVHI显著降低(P<0.05,Fig 2);而在TRPM8-/-小鼠中,低压低氧+薄荷醇组小鼠RVSP和RVHI未见明显变化(P>0.05,Fig 2)。提示薄荷醇可能通过TRPM8降低小鼠肺动脉压力和减轻右心室肥厚。
2.3 薄荷醇对低压低氧诱导肺小动脉重构的影响经过低压低氧环境诱导后,小鼠的肺小动脉壁增厚,形态不均匀,管腔狭窄(P<0.01,Fig 3)。在野生型小鼠中,与低压低氧组相比,低压低氧+薄荷醇组小鼠肺小动脉壁增厚及管腔狭窄程度改善,肺血管病理损伤较低压低氧组明显减轻(P<0.05,Fig 3);而在TRPM8-/-小鼠中,低压低氧+薄荷醇组小鼠肺小动脉壁增厚及管腔狭窄无明显改善,肺血管病理损伤较低压低氧组无明显减轻(P>0.05,Fig 3)。提示薄荷醇可能通过TRPM8减轻小鼠肺小动脉管壁增厚及管腔狭窄。
2.4 薄荷醇对小鼠KLF4和PCNA蛋白表达的影响经过低压低氧环境诱导后,小鼠肺组织中KLF4表达明显降低(P<0.01),PCNA表达明显升高(P<0.01,Fig 4A,B,D)。在野生型小鼠中,与低压低氧组相比,低压低氧+薄荷醇组KLF4明显升高(P<0.05,Fig 4A,C),PCNA显著下降(P<0.05,Fig 4A,D);而在TRPM8-/-小鼠中,低压低氧+薄荷醇组KLF4及PCNA无明显变化(P>0.05,Fig 4B-D)。提示KLF4可能参与薄荷醇激活TRPM8调节肺血管重构的过程。
2.5 薄荷醇对PASMCs增殖能力的影响经过低氧环境诱导后,分别检测肺动脉平滑肌细胞(PASMCs)在0、6、12、24、48 h时间段的细胞增殖和活力,结果显示在低氧24 h内,PASMCs细胞活力随时间梯度逐渐增加,在24 hPASMCs细胞活力最强,在低氧处理48 h后,PASMCs细胞出现死亡,细胞活力下降;后续实验选择24 h为实验节点。与对照组相比,在低氧环境诱导24 h后,PASMCs增殖能力增加(P<0.01,Fig 5),薄荷醇干预后,PASMCs增殖能力减弱(P<0.01,Fig 5)。提示薄荷醇可抑制PASMCs增殖。
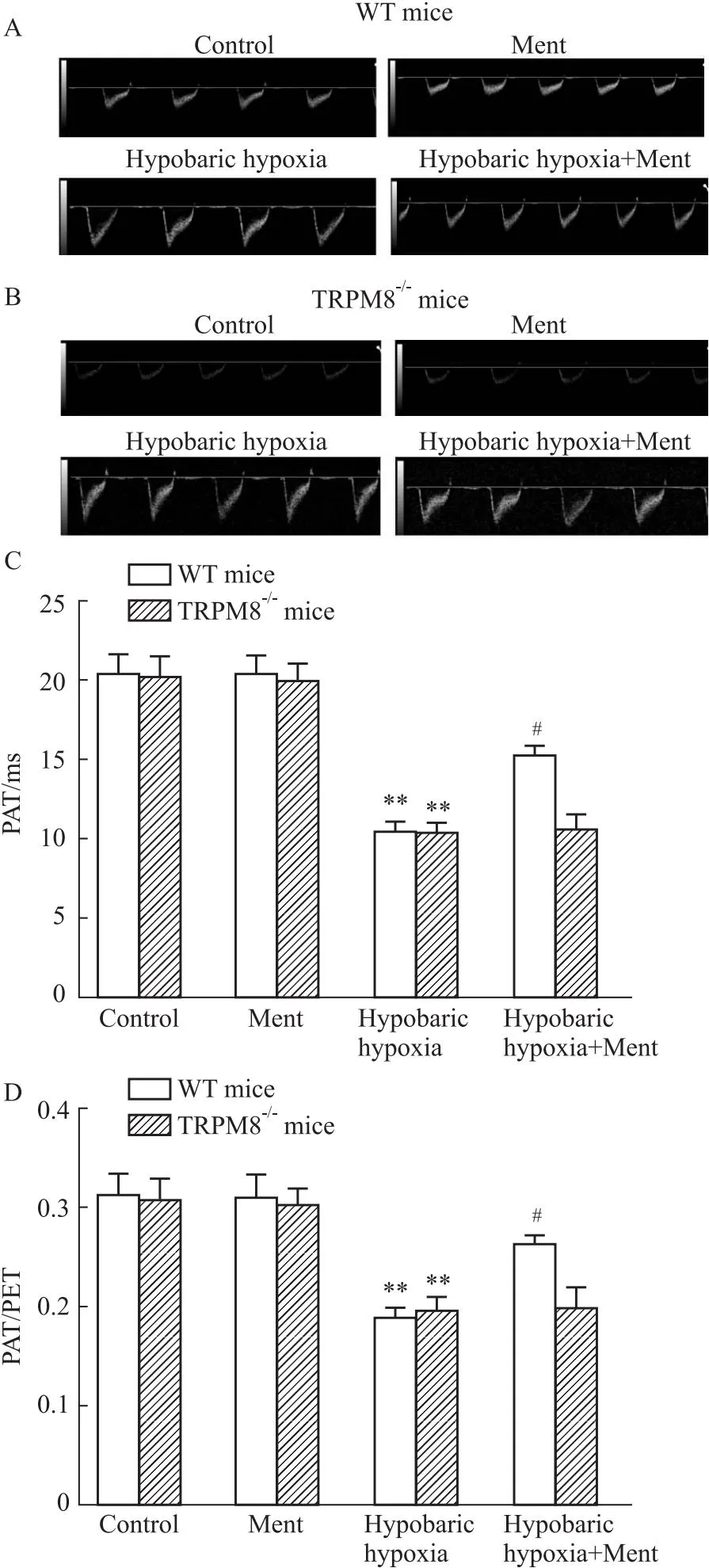
Fig 1 Pulmonary arterial hypertension estimated by doppler echocardiography n=10)
2.6 薄荷醇对PASMCs迁移能力的影响在低氧环境诱导后,低氧组细胞划痕愈合率显著加快(P<0.01,Fig 6),薄荷醇干预后,与低氧组相比,低氧+薄荷醇组的划痕愈合率明显下降(P<0.05,Fig 6)。提示薄荷醇可抑制PASMCs迁移。
3 讨论
低氧性肺动脉高压(HPH)常见原因包括:高原慢性缺氧、慢性阻塞性肺疾病(COPD)、间质性肺疾病和睡眠呼吸障碍等。我国西部有近千万人长期居住在高原地区,近年来随着青藏铁路开通、西部建设和国防安全的需要,大量人群移居高原,高原低氧性肺动脉高压的发病率逐年升高,如不及时干预,将进展为高原性心脏病,导致右心衰竭和死亡[3]。肺动脉高压的防治一直是研究的热点和难点,近期研究发现:在野百合碱(monocrotaline, MCT)诱导的肺动脉高压大鼠中,薄荷醇可降低肺动脉压力和减轻右心室肥厚,但具体机制有待探索[10]。瞬时受体电位通道家族(transient receptor potential, TRP)是一类非电压依赖性阳离子通道,参与调控多种生理功能[11]。瞬时受体电位通道M8(TRPM8)是TRP家族成员,在心脏、血管平滑肌和内皮等广泛表达,也存在于质膜、高尔基体和肌浆网,课题组和国内外前期研究发现,TRPM8在心血管及代谢功能调控中发挥重要调控作用,如:高血压、心肌梗死后炎症反应和心肌重构[5-8]。研究发现[12],TRPM8基因的rs9789675、rs9789398和rs1004478位点多态性与COPD患者的肺动脉高压密切相关,TRPM8可能参与低氧性肺动脉高压的发生发展。本实验中为更好模拟高原缺氧,我们选用低压低氧诱导小鼠肺动脉高压模型,在野生型小鼠中,薄荷醇增加肺动脉加速时间(PAT)和PAT/PET比值,降低小鼠的肺动脉压力和右心室肥厚指数;而在TRPM8-/-小鼠中,薄荷醇对小鼠的PAT、PAT/PET、肺动脉压力和右心室肥厚指数未见明显影响,提示薄荷醇可能通过TRPM8改善低压低氧诱导的小鼠肺动脉高压和右心室肥厚。
肺血管收缩和肺血管重构是低氧性肺动脉高压的主要病理生理机制,目前治疗药物(磷酸二酯酶5抑制剂和内皮素受体拮抗剂等)主要通过舒张肺血管降低肺动脉压。前期研究发现[13-14],MCT诱导的肺动脉高压大鼠肺血管中TRPM8表达降低;TRPM8激活后调节SOCE钙通道复合体介导的钙离子内流,从而舒张肺血管和降低肺动脉压力。最新研究提示[15],有效改善和逆转肺血管重构可能是治疗
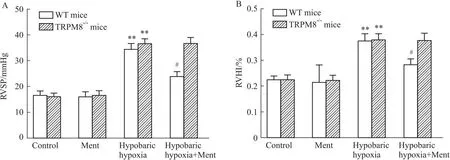
Fig 2 Dietary menthol attenuated pulmonary hypertension and RV hypertrophy via n=10)
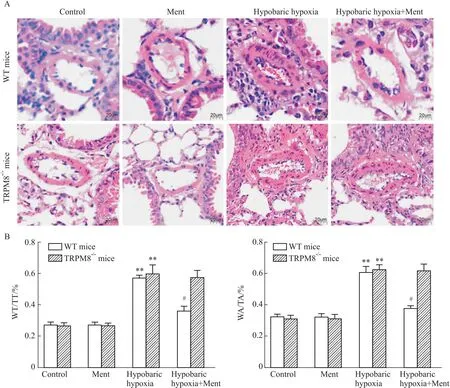
Fig 3 Dietary menthol ameliorated pulmonary arterioles remodeling via TRPM8 n=10)
肺动脉高压的关键,其中肺动脉平滑肌细胞(PASMCs)的过度增殖和迁移是肺血管重构的重要环节。本实验中,我们发现薄荷醇显著降低PASMCs的增殖能力和迁移能力;在野生型小鼠中,薄荷醇干预后肺小动脉壁增厚及管腔狭窄程度改善,肺血管病理损伤较明显减轻,肺组织中增殖细胞核抗原(PCNA)表达降低;而在TRPM8-/-小鼠中,薄荷醇干预后小鼠肺小动脉壁增厚和管腔狭窄未见明显改善,肺血管病理损伤无明显减轻,肺组织中PCNA表达未见差异;以上结果提示薄荷醇可能通过TRPM8抑制PASMCs的过度增殖和迁移,延缓肺血管重构。
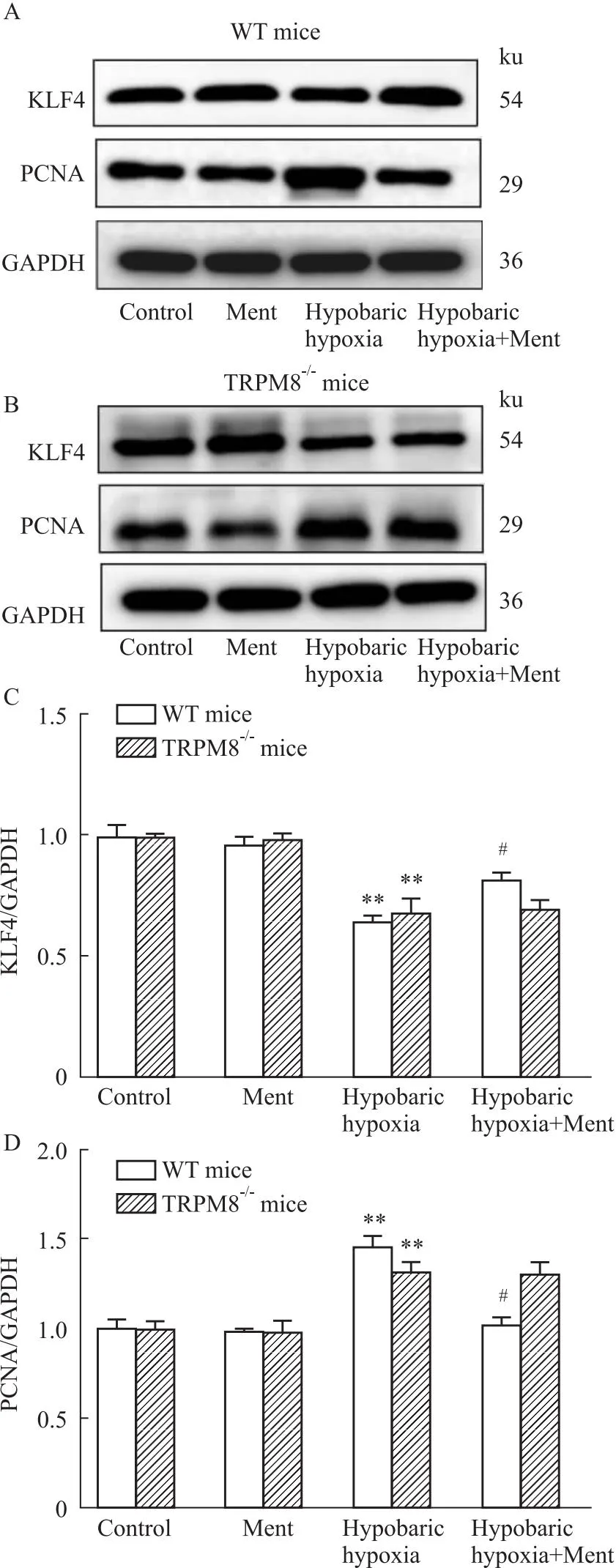
Fig 4 Effect of menthol on protein expressions of PCNA and KLF4 in each group n=10)
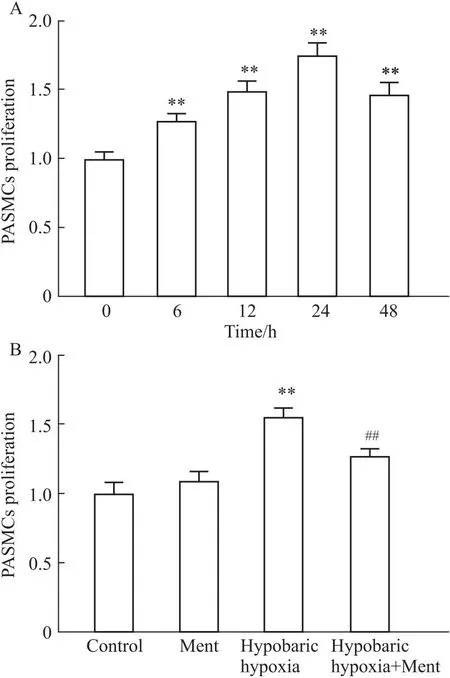
Fig 5 Effect of menthol on PASMCs proliferation n=3)
Krüppel样因子4(Kruppel-like factor 4,KLF4)是一种保守且含有锌指结构域的转录因子,表达于人体多种组织,参与细胞生长、增殖和分化等。大量研究证实[16-18],KLF4参与调控低氧性肺动脉高压的发生发展,KLF4可与p53相互作用诱导细胞周期蛋白p21表达,从而抑制PASMCs增殖;最新研究证实,KLF4还可通过富含半胱氨酸和甘氨酸的蛋白2(Csrp2)、ERK1/2信号途径和NDRG1/DRP1信号途径调节PASMCs增殖、迁移和表型转换。本实验中,低压低氧引起小鼠肺组织中KLF4表达减少,在野生型小鼠中,薄荷醇干预后肺组织中KLF4蛋白表达增加、增殖细胞核抗原PCNA蛋白表达降低;而在TRPM8-/-小鼠中,薄荷醇对肺组织中KLF4和PCNA表达未见影响。因此我们推测,薄荷醇可能通过激活TRPM8上调KLF4表达,从而调节PASMCs增殖和迁移能力。
然而,薄荷醇激活TRPM8后如何上调PASMCs中KLF4的表达,以及TRPM8对KLF4的蛋白修饰影响如何,目前尚不清楚,我们将在进一步的实验中继续研究。

Fig 6 Effect of menthol on PASMCs migration n=3)
综上所述,本探究提示TRPM8可能是薄荷醇在肺组织的重要作用靶点,薄荷醇通过激活TRPM8上调KLF4表达,抑制PASMCs增殖和肺血管重构,改善低压低氧诱导的小鼠肺动脉高压和右心室肥厚。研究结果为高原低氧性肺动脉高压的中医药治疗提供了理论基础。
