不同温度处理对珠芽魔芋球茎休眠调控的影响
2024-01-13王蕊嘉李文涵赵青青谢雨琪吴学尉
王蕊嘉,李文涵,赵青青,谢雨琪,李 缘,吴学尉
(云南大学 资源植物研究院,昆明 650091)
珠芽魔芋是天南星科(Araceae)魔芋属(AmorphophallusBlume)多年生球茎植物,其叶柄分叉、裂叶交叉点上生长有棕色气生珠芽,是植物界唯一能够在地下球茎产生大量葡甘聚糖(konjac glucomannan,KGM)的单子叶草本植物[1]。魔芋精粉在食品、医药、化工、航天等领域有极大的应用前景[2-3]。与大多数球茎类植物一样,珠芽魔芋具有休眠特性,其休眠期长达4~6个月,致使出苗率不整齐,产量不稳定[4]。珠芽魔芋的休眠属于生理休眠,是由植物内部的生理因素所调控,即使在环境条件有利的情况下,休眠的球茎也不能萌发,只有经过一定时期的低温处理后才能打破休眠,开始萌发[5-8]。温度变化引起球茎呼吸代谢物质改变,球茎中含有大量淀粉,在打破休眠转向萌发的过程中淀粉粒数量发生改变,并以可溶性糖(蔗糖、葡萄糖和果糖)的形式从球茎贮藏组织转移到茎、根等各种器官中,成为细胞生长和维持渗透压所需物质[9-11]。例如,马铃薯在16 ℃低温打破休眠过程中,其块茎淀粉含量逐渐下降,可溶性糖含量增加[12];大蒜气生鳞茎在4℃低温处理28 d后打破休眠效果最佳,其可溶性糖含量随着时间的增加逐渐积累[13]。
球茎的休眠和萌发是2个独立但连续的生理学过程,主要受到脱落酸(abscisicacid,ABA)和赤霉素(gibberellin,GA)2 种植物激素的调控。低温和GA3处理会引起紫斑牡丹内源激素发生转变,使其向生长所需营养物质转化,从而促进植株提前萌发[14]。在植物休眠过程中,ABA 含量逐渐增多,达到峰值后植物进入休眠状态[15]。ABA 合成途径的关键限速酶是位于叶绿体类囊体膜和基质上的9-顺式-环氧类胡萝卜素双加氧酶(9-cis-epoxycarote noid dioxygenase,NCED),对ABA 的合成进行调控[16]。在猕猴桃等水果中,NCED基因的表达量于果实成熟期间达到峰值,并与ABA 达到峰值的趋势一致,说明NCED可以调控ABA 的含量[17-19]。ABA 降解代谢主要有氧化降解和结合降解2种形式[20]。通过ABA 8′羟化酶的催化,形成ABA 8′甲基羟化反应,进而生成8′-羟基-ABA (8′-OH-ABA),但8′-羟基-ABA 并不稳定,容易产生自发异构化,最终形成二氢红花菜豆酸(dihydro-phaseic acid)[21]。ABA 8′羟化酶来源于CYP450单加氧酶超家族,其编码的基因家族为CYP707A 家族[22]。茶树CsCYP707A3基因经过4 ℃低温处理后表达量上调,经过38 ℃ 处理后表达量下调[23]。AtCYP707Aa1-1和AtCYP707Aa2-1在拟南芥突变体植株中的表达量分别是野生型的7倍和5倍,且在AtCYP707A2过表达拟南芥中,其ABA 含量低于野生型拟南芥,其休眠期比野生型拟南芥缩短,有利于打破休眠,促进萌发[24-25]。
温度是影响珠芽魔芋休眠调控的关键因素之一。本研究通过不同温度处理珠芽魔芋球茎,旨在寻找有利于打破珠芽魔芋休眠的最适温度,探讨不同温度影响珠芽魔芋球茎休眠的生物表型变化、内源生理代谢物质及其分子调控机理,为今后使用生物技术手段调控和改良珠芽魔芋休眠期提供理论基础,也为解决珠芽魔芋因休眠导致的休眠期过长、出苗率不齐等问题提供合理的技术保障。
1 材料和方法
1.1 材料及处理
所有珠芽魔芋球茎从叶面摘下后,选取重量在6~12 g无病害、无破损的健康珠芽魔芋球茎。由前期预实验可知,魔芋贮藏期的适宜温度为9~25℃,低于9 ℃珠芽魔芋球茎将会冻伤,但采用相对高温催芽的方式在马铃薯块茎催芽中有过报道。本研究先进行不同温度处理,以打破球茎休眠。即分别在24 ℃/9 ℃(D24/9℃)、24 ℃/13 ℃(D24/13℃)、24℃/17 ℃(D24/17℃)的昼/夜变温,9 ℃(D9℃)、13 ℃(D13℃)、17 ℃(D17℃)、21 ℃(D21℃)的恒温以及室温(Droom,约10 ℃)条件下处理珠芽魔芋球茎,然后分别将以上温度处理后的珠芽魔芋球茎置于26 ℃(G26℃)、33 ℃(G33℃)条件下进行催芽处理,共组成16个(8×2)处理组合。
每个温度处理放置300个珠芽魔芋球茎,总共处理120 d。根据温度处理后珠芽魔芋球茎的表型变化,本试验将所处理的珠芽魔芋球茎根据处理时间分为6个时期,即休眠Ⅰ期(打破休眠处理30 d);休眠Ⅱ期(打破休眠处理60 d);萌发前期(催芽处理15 d);萌发中期(催芽处理22 d);萌发后期(催芽处理28 d);萌发末期(催芽处理40 d)。每个时期每个处理取样9个珠芽魔芋球茎。分别在珠芽魔芋球茎的休眠 Ⅰ 期、休眠 Ⅱ 期、萌发初期、萌发中期、萌发后期、萌发末期对其进行取材并拍照观察。
1.2 测定指标及方法
1.2.1发芽率和出芽比
自贮藏开始每天1次观察珠芽魔芋球茎生物表型变化,记录不同温度处理后珠芽魔芋球茎芽点的变化情况,待芽点冒出新芽后统计其发芽数量及其变化规律,最后计算发芽率(发芽球茎数/300×100%)。同时,固定选取12个珠芽魔芋球茎,在不同温度处理后6个时期,观察记录其新芽(顶破球茎表皮的芽体)占总芽孔的比率(新芽数/总芽孔数),即为出芽比(%)。
1.2.2球茎质量
固定选取12个珠芽魔芋球茎,在不同温度处理后6个时期,使用电子天平称量其质量(g)并记录贮藏期间的质量变化。
1.2.3葡萄糖含量
将分光光度计预热30 min以上,调节波长至620 nm,将2 mL H2O加入5 mL蒽酮溶液调零。取1.2 mL 标准溶液(蒽酮溶液做空白),在620 nm 波长下测定标准及空白吸光度值D标准和D空白,并计算△D(D标准-D空白)。以0,20,40,60,80,100 mg/g葡萄糖标准溶液为横坐标(x),以ΔD为纵坐标(y)绘制标准曲线,得到线性回归方程y=kx+b,将样品溶液实测的ΔD代入方程得到葡萄糖含量(mg/g)。
1.2.4淀粉含量
取不同温度处理6个时期的样品(每个处理3个生物学重复),每个样品研磨混样取0.1 g,加入5 mL 80%乙醇,80 ℃水浴30 min后,3 000 r/min离心10 min;去上清留沉淀,加入5 mL 双蒸水,在沸水中煮15 min,待冷却后加入0.5 mL 高氯酸,60℃水浴15 min,中途应上下摇晃颠倒6次,且每次都摇匀,3 000 r/min 离心10 min;取上清液0.1 mL,加入0.9 mL双蒸水,再加入5 mL 0.2%蒽酮硫酸溶液,沸水煮10 min;冷却后,在分光光度计上测定吸光度值,并进行3次技术重复,记录结果。按照相关公式计算淀粉含量(mg/g)。
1.2.5可溶性糖含量
取不同温度处理6个时期的样品,每个处理3个生物学重复。每个样品研磨混样取0.1 g,加入5 mL 80%乙醇,80 ℃水浴30 min后,3 000 r/min离心10 min,取上清液1 mL,加入5 mL 0.2%蒽酮硫酸溶液,沸水煮10 min,冷却后,在分光光度计上测定吸光度值,按照相关公式计算可溶性糖含量(mg/g)。
1.2.6ABA含量
取在液氮中迅速研磨的珠芽魔芋球茎匀浆样品0.05 g,使用上海酶联生物植物激素脱落酸(ABA)酶联免疫分析(ELISA)试剂盒,应用双抗体夹心法测定不同温度处理不同时期珠芽魔芋球茎中ABA含量。
1.2.7GA3 含量
取在液氮中迅速研磨的珠芽魔芋球茎匀浆样品0.05 g,使用上海酶联生物植物赤霉素(GA3)酶联免疫分析(ELISA)试剂盒,应用双抗体夹心法测定不同温度处理不同时期珠芽魔芋球茎中GA3含量。
1.2.8球茎休眠调控相关基因克隆和表达分析
(1)基因克隆:使用华越洋生物有限公司的快速通用植物RNA 提取试剂盒提取总RNA,并根据实验材料进行适当调整,每个样品进行3个重复,并使用TaKaRa的反转录试剂盒(Code NO.RR047)按照说明书将 RNA 反转录成 cDNA。利用Primer 6.0设计引物,根据课题珠芽魔芋转录组数据中CYP707A基因的cDNA 序列,在起始密码子和终止密码子位置设计引物(表1),PCR 扩增后进行凝胶电泳实验,观测条带是否正确,若条带位置正确,则将胶回收连接转化至大肠杆菌,摇菌测序对比结果。

表1 CYP707A 基因引物序列Table 1 Primer sequences for CYP707A gene
(2)基因结构预测:利用ProtParam 软件对CYP707A 蛋白进行基本理化性质分析;利用SignaIP-4.1 分析工具对CYP707A 蛋白性质进行预测;利用TMHMM 法分析CYP707A 蛋白是否存在跨膜区;利用PSIPRED 预测CYP707A 蛋白质二级结构;利用SWISS-MODEL 同源建模预测CYP707A 的三级结构。
(3)qRT-PCR:利用Primer 6.0设计珠芽魔芋球茎休眠相关基因qPCR引物序列(表2);使用华越洋生物有限公司的快速通用植物RNA 提取试剂盒提取总RNA;并使用TaKaRa 的反转录试剂盒(Code NO.RR047)按照说明书将 RNA 反转录为 cDNA;qRTPCR在美国Applied Biosystems公司实时荧光定量PCR仪ABI7500上进行,以魔芋EF1α为内参基因,对珠芽魔芋球茎的NCED基因和CYP707A基因,使用南京Vazyme生物的2×AceQ Universal SYBR qPCR Master Mix(Q511-02/03)试剂盒的SYBR Green I嵌合荧光法进行实时荧光定量检测。

表2 qRT-PCR 的引物序列Table 2 Primer sequences for qRT-PCR
1.3 数据处理
数据使用Microsoft Excel 2021进行记录,使用GraphPad Prism 8.0.1 进行分析及做图。
2 结果与分析
2.1 不同温度处理对不同时期珠芽魔芋球茎质量的影响
不同温度处理珠芽魔芋球茎的质量均随着处理时间延长逐渐降低,在不同时期并没有因为持续的低温或高温而产生骤降,没有损伤珠芽魔芋球茎。26 ℃催芽处理(图1,A)的珠芽魔芋球茎的质量在不同时期相比相应的33 ℃催芽处理(图1,B)均更为稳定,且33 ℃催芽处理的珠芽魔芋球茎质量在萌发末期下降速率较快。同时,不同温度处理珠芽魔芋球茎的质量在26 ℃催芽处理下差异相对明显,在33 ℃催芽处理下差异相对较小(图1)。以上结果表明,本试验过程中处理温度设置合理,没有对参试珠芽魔芋球茎造成损伤。
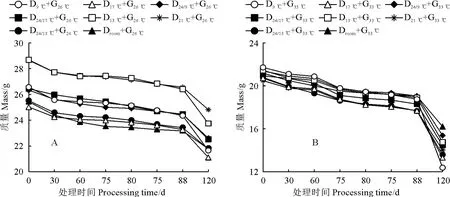
图1 不同休眠温度和催芽温度组合处理下珠芽魔芋球茎质量的变化D24/9℃,D24/13℃,D24/17℃,D9℃,D13℃,D17℃,D21℃,Droom stand for day/night temperature (24 ℃/9 ℃,24 ℃/13 ℃,24 ℃/17 ℃),constant temperature (9 ℃,13 ℃,17 ℃,21 ℃) and room temperature treatments during the dormancy period,while G26℃and G33℃ stand for high temperature (26 ℃ and 33 ℃) treatments during the germination period.The same as below.Fig.1 The mass changes of konjac bulbil under different dormant temperature and germination temperature combinations
2.2 不同温度处理对珠芽魔芋球茎发芽率的影响
8个休眠温度处理珠芽魔芋球茎在26 ℃催芽处理后,其发芽速率以D13℃+G26℃处理的最快,在处理83 d达到最大值,而以Droom+G26℃处理的最慢,在处理86 d达到最大值(图2,A);8个休眠温度处理珠芽魔芋球茎在33 ℃催芽处理后,其珠芽魔芋球茎出芽以D21℃+G33℃处理最快,在处理80 d达到最大值,而以D9℃+G33℃处理最慢,在处理87 d达到最大值,而且D9℃+G33℃处理珠芽魔芋球茎发芽率低于其他所有温度处理,其发芽率仅有75%(图2,B);进一步比较26 ℃和33 ℃催芽下的最佳处理组合发芽时间可知,33 ℃最佳催芽处理(D21℃+G33℃)的发芽时间比26 ℃最佳催芽处理(D13℃+G26℃)快3 d,33 ℃最佳催芽处理的发芽时间比其最差催芽处理(D9℃+G33℃)快7 d。

图2 各休眠处理温度和催芽处理温度组合下珠芽魔芋球茎发芽率的变化Fig.2 The changes in germination rate of konjac bulbil under different dormant temperature and germination temperature combinations
2.3 不同温度处理对休眠期和萌发期珠芽魔芋球茎淀粉、可溶性糖含量的影响
在休眠期,经不同温度处理后,珠芽魔芋球茎淀粉含量整体上表现为休眠期Ⅱ期均低于休眠Ⅰ期,且D13℃和D24℃/13℃处理的下降速率明显高于其他温度处理;在休眠Ⅰ和Ⅱ期,珠芽魔芋球茎淀粉含量均以D17℃处理最高,以D24℃/17℃处理最低,其余温度处理居中(图3,A)。

图3 不同温度处理下休眠期珠芽魔芋球茎淀粉和可溶性糖含量的变化Ⅰ and Ⅱ represent the dormancy stage Ⅰ and Ⅱ.The different normal letters within the same treatment temperature indicate significant difference between stages at 0.05 level.The same as below.Fig.3 Changes of starch and soluble contents in konjac bulbil treated with different temperatures during dormant period
与此同时,珠芽魔芋球茎可溶性糖含量整体上表现为休眠期Ⅱ期均高于休眠Ⅰ期,且D21℃处理上升速率最高,D13℃处理上升速率次之,其他温度处理的上升速率比较平稳;在休眠Ⅰ和Ⅱ期,珠芽魔芋球茎可溶性糖含量均以D13℃处理最高,与其他温度处理存在明显差异(图3,B)。
在萌发期,打破休眠过程中珠芽魔芋球茎淀粉含量降低速率较大的处理D13℃、D24℃/13℃,及其可溶性糖含量升高速率较大的处理D21℃、D24℃/17℃,经后期G26℃、G33℃催芽处理后,它们的珠芽魔芋球茎淀粉和可溶糖含量的测定结果(图4)显示,前期采用恒温处理打破休眠的,经后期高温催芽处理的珠芽魔芋球茎淀粉和可溶性糖含量在萌发前期与萌发后期之间均存在显著性差异(P<0.05);而在前期采用昼夜变温处理打破休眠的,经后期高温催芽处理的珠芽魔芋球茎淀粉含量在萌发前期与萌发后期之间没有显著性变化(P>0.05),但其可溶性糖含量在萌发前期与萌发后期之间仍存在显著性差异(P<0.05)。以上结果说明随着珠芽魔芋球茎打破休眠,其淀粉含量降低,可溶性糖含量增加,并以13℃恒温处理的珠芽魔芋球茎淀粉含量下降最快,可溶性糖含量最高。
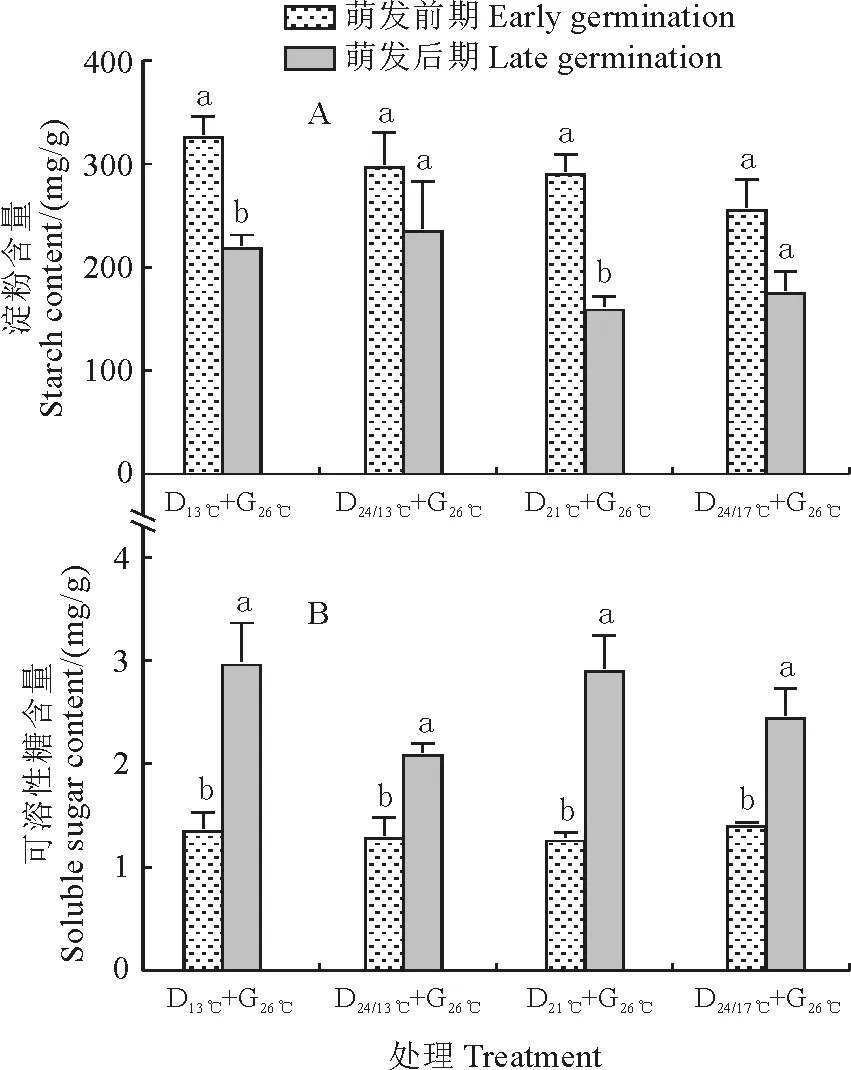
图4 不同温度处理下萌发期珠芽魔芋球茎淀粉和可溶性糖含量变化Different lowercase letters within same treatment indicate significant difference between early and later periods at 0.05 level (P<0.05).Fig.4 Changes of starch and soluble sugar contents in konjac bulbil treated by different temperatures during germination period
2.4 不同温度处理对珠芽魔芋球茎出芽比的影响
前期低温打破休眠,后期经26 ℃催芽处理后,以D13℃+G26℃处理组合的珠芽魔芋球茎出芽比(新芽占芽孔的比率)最高,这与26 ℃催芽处理后,D13℃+G26℃处理发芽速率最快的结果一致(图5,A);在前期低温打破休眠,后期经33 ℃催芽处理后,整体上出芽比较高(图5,B)。另外,进一步对比前期恒温、昼/夜变温打破休眠,后期经26 ℃、33 ℃催芽处理的珠芽魔芋球茎出芽比结果可以看出,前期低温打破休眠时,使用恒温处理的珠芽魔芋球茎出芽比更佳(图5)。
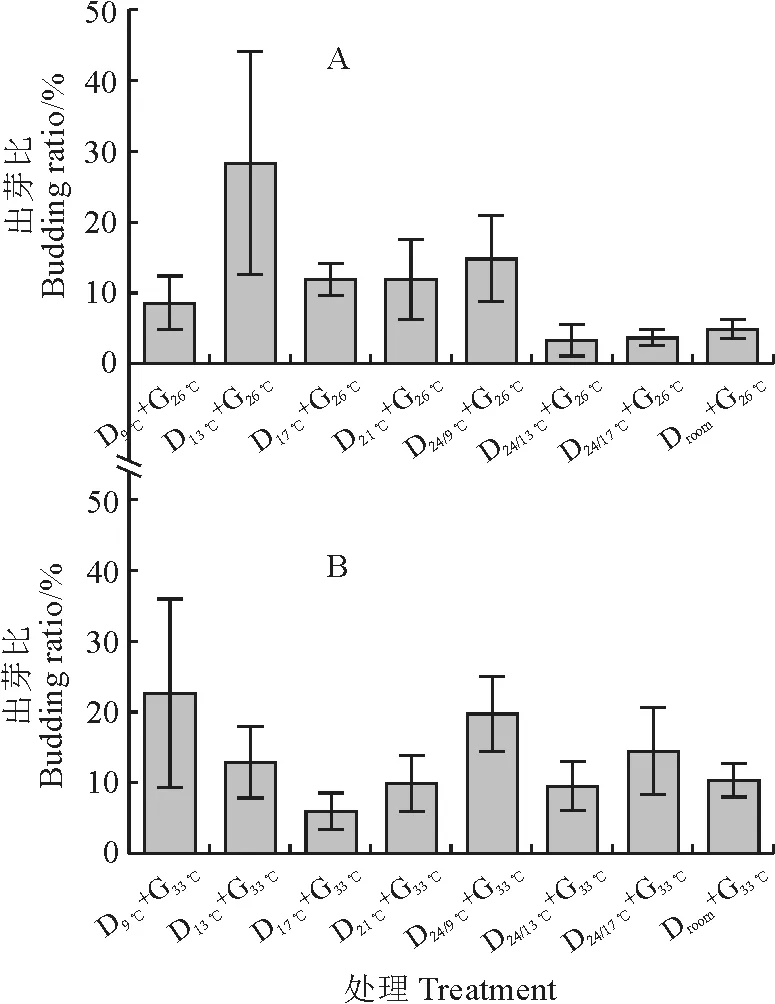
图5 不同温度处理下珠芽魔芋球茎出芽比变化Fig.5 Changes of sprouting ratio of konjac bulbil under different temperature treatments
2.5 不同温度处理对珠芽魔芋球茎ABA 和GA3含量的影响
休眠期珠芽魔芋球茎ABA 含量随着处理时间逐渐增加,而其GA3含量随着处理时间逐渐减少。对比打破休眠最快的D21℃处理和最慢的Droom处理的珠芽魔芋球茎ABA 和GA3含量(图6,A、B)可知,在休眠Ⅰ期和休眠Ⅱ期,D13℃和D21℃处理珠芽魔芋球茎ABA 含量均明显低于Droom处理;在相同温度处理下,休眠Ⅱ期珠芽魔芋球茎ABA 含量在D13℃处理下显著低于休眠Ⅰ期,在D21℃处理下显著高于休眠Ⅰ期(P<0.05),而在Droom处理下没有显著差异(P>0.05)。在休眠Ⅰ期和休眠Ⅱ期,珠芽魔芋球茎GA3含量在D13℃和D21℃处理下同样低于Droom处理;在相同温度处理下,休眠Ⅱ期珠芽魔芋球茎GA3含量在D13℃处理下显著高于休眠Ⅰ期,在D21℃和Droom处理下均显著低于休眠Ⅰ期(P<0.05)。

图6 不同温度处理下珠芽魔芋球茎休眠期的ABA 和GA3 含量The different normal letters within the same temperature treatment indicate significant difference between stages at 0.05 level (P<0.05)Fig.6 The ABA and GA3 contents in konjac bulbil treated by different temperatures during dormant period
珠芽魔芋萌发期球茎ABA含量在不同催芽温度处理下均表现出先升后降的单峰变化趋势,其GA3含量在26 ℃催芽处理下也先升后降,而在33 ℃催芽处理下逐渐升高(图7,A、B)。其中,珠芽魔芋ABA含量在萌发前期和萌发后期均表现为33 ℃催芽处理
2.6 珠芽魔芋球茎调控相关基因克隆、鉴定及表达
2.6.1 CYP707A基因克隆、鉴定
以3个生物学重复的珠芽魔芋球茎cDNA 为模板,利用已设计的CYP707A基因引物,PCR 扩增后进行凝胶电泳。结果显示,3个生物重复均得到2 000 bp附近的单一条带(图8)。将PCR 扩增产物进行胶回收后,连接转化至大肠杆菌,摇菌后挑菌测序得到1 965 bp 的序列,开放阅读框(open reading frame ORF)为1 221 bp,序列对比一致性为99.59%(图9)。

图8 CYP707A 基因PCR 扩增结果Fig.8 PCR amplification results of CYP707A gene

图9 测序结果序列对比图Fig.9 Sequence comparison plot
利用ProtParam 软件对CYP707A蛋白进行基本理化性质分析,结果表明,其氨基酸数目为386,共含有赖氨酸(Lys)、色氨酸(Trp)、苯丙氨酸(Phe)、蛋氨酸(Met)、苏氨酸(Thr)、异亮氨酸(Ile)、亮氨酸(Leu)、缬氨酸(Val)、精氨基酸(Arg)、组氨基酸显著高于26 ℃催芽处理(P<0.05),在萌发中期2种温度处理之间没有显著性差异(P>0.05);珠芽魔芋球茎GA3含量在萌发初期表现为26 ℃催芽处理显著高于33 ℃催芽处理,在萌发中期和后期2种催芽温度处理之间均无显著性差异。(His)、谷氨酸(Glu)、谷氨酰胺(Gln)、天冬氨酸(Asp)、天门冬酰胺(Asn)、丙氨酸(Ala)、脯氨酸(Pro)、甘氨酸(Gly)、半胱氨酸(Cys)、酪氨酸(Try)和丝氨酸(Ser)20种氨基酸,其中精氨酸(Arg)占比最高为16.40%,酪氨酸(Tyr)占比最低为0.8%。
CYP707A 蛋白分子式为C2945H4621N1007O790S42,分子质量为68 120.88,总原子数为9 405,等电点为11.88,脂肪系数为43.96,正电荷残基数为20,总平均亲水性为-0.684,负电荷残基数为109。进一步利用SignaIP-4.1分析工具对CYP707A 蛋白性质进行预测发现,CYP707A 蛋白为非分泌性蛋白,不存在信号肽(图10,A);利用TMHMM 法分析表明CYP707A 蛋白不存在跨膜区(图10,B)。
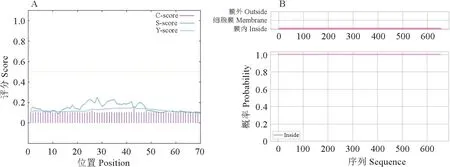
图10 CYP707A 蛋白性质预测(A)和跨膜区预测(B)Fig.10 CYP707A protein property prediction (A) and transmembrane region prediction (B)
利用PSIPRED预测CYP707A 蛋白质二级结构为无规卷曲的形式(图11,A),利用SWISS-MODEL同源建模预测CYP707A 的三级结构,其三级结构为单体结构(图11,B)。

图11 CYP707A 蛋白质二级结构(A)和三级结构(B)预测图Fig.11 Prediction of the secondary (A) and tertiary (B) structures of the protein CYP707A
2.6.2休眠调控相关基因的表达分析
以EF1α为内参基因,不同温度处理后不同时期珠芽魔芋球茎的NCED和CYP707A基因的表达结果见图12。

图12 不同温度处理不同时期珠芽魔芋球茎中NCED(A、B)和CYP707A(C、D)基因的表达量D1 and D2 stand for dromancy Ⅰ and Ⅱ stage,while GE,GM,GL,GT stand for early,midde,later,terminal germinalion stages,respectively.Fig.12 NCED (A,B) and CYP707A (C,D) gene expression in konjac bulbil under different temperatures at different developmental stages
其中,NCED基因的相对表达量随着休眠的加深逐渐增加,而在萌发期逐渐减少;Droom+G26℃处理的珠芽魔芋球茎NCED基因表达量均始终高于相应最佳处理温度D13℃+G26℃;由此推测珠芽魔芋球茎NCED基因会维持休眠,抑制萌发(图12,A)。
同时,珠芽魔芋球茎的CYP707A基因相对表达量随着休眠加深逐渐减少,却在萌发期逐渐增加;最佳温度处理的珠芽魔芋球茎CYP707A基因表达量均始终高于室温+催芽处理;由此推测CYP707A基因的表达能够打破珠芽魔芋球茎休眠,促进其萌发(图12,B)。
3 讨论
温度是植物生长发育过程中重要的环境因子,对球茎植物打破休眠和萌发起着关键作用[26-27]。在本研究中也发现,温度不仅影响着珠芽魔芋球茎休眠调控,也使珠芽魔芋球茎表型、内源生理特征以及休眠相关基因表达量发生改变,是影响珠芽魔芋休眠的关键因子。研究表明,卷丹百合珠芽在5 ℃低温层积处理下最有利于打破休眠[28];兰州百合在23 ℃/18 ℃、18 ℃/13 ℃和13 ℃/8 ℃昼/夜变温处理135 h 皆可以打破休眠,并以昼/夜温18 ℃/13℃处理打破休眠的效果最佳[29];温度保持在10~13℃有益于魔芋打破休眠,产生新芽[30]。本研究对比休眠期昼/夜变温(24 ℃/9 ℃、24 ℃/13 ℃、24 ℃/17 ℃)和恒温(9 ℃、13 ℃、17 ℃、21 ℃)处理珠芽魔芋球茎的萌发结果发现,恒温13 ℃处理最有利于珠芽魔芋打破休眠,33 ℃催芽处理更有利于珠芽魔芋球茎的萌发。
据报道,马铃薯经过室温和20 ℃恒温处理的出芽数明显高于1.5 ℃处理[31];唐菖蒲通过5 ℃低温处理40 d后,新芽的数量最多,芽长均达到1 cm[32]。本试验观察发现,珠芽魔芋球茎上具有很多芽孔,但并不是所有芽孔都能长出新芽。珠芽魔芋起源于印度尼西亚热带丛林地区,所以其生境决定了其生长发育所需温度较高,且常年处于温热环境中,昼夜温差变化不大,气温相对恒定。本研究结果表明前期低温处理打破催眠时,恒温处理会诱导珠芽魔芋球茎出芽数量更多。
植物休眠的内在生理变化受到物质代谢的影响[33-34]。休眠期碳水化合物与其物质代谢有关,而可溶性糖和淀粉是植物营养组织中碳水化合物的主要储存形式[35-36]。本研究发现,休眠期珠芽魔芋球茎淀粉含量不断下降,可溶性糖含量不断上升;萌发期珠芽魔芋球茎淀粉含量也在下降,可溶性糖含量不断上升,且恒温处理的球茎淀粉含量比昼夜变温处理的下降速率更快,而其可溶性糖含量比昼夜变温处理的上升速率更快。许多研究表明桃、欧李等植物在打破休眠过程中,其淀粉含量逐渐下降,而可溶性糖含量逐渐上升[37-38],本研究中珠芽魔芋球茎可溶性糖和淀粉含量的变化与之相符,但球茎中其他糖类物质的代谢特征还有待进一步研究。
ABA、GA3两类激素含量的变化会影响珠芽魔芋球茎休眠。球茎休眠过程中低温处理会使ABA含量增加,而GA3含量下降[39]。本研究中休眠期珠芽魔芋球茎的ABA 含量不断增多,GA3含量不断减少。前人的研究表明[40],当植物受到各种环境胁迫(如干旱、温度等)时,其体内ABA 会合成和积累,ABA 含量增加,本研究中不同温度处理珠芽魔芋球茎后,其萌发期ABA 含量呈现“先升后降”的规律,本试验结论与前人研究结论相符。33 ℃处理莴苣后,在休眠后期积累大量的内源激素GA3,将会打破休眠,进而开始萌发[40],本试验中,经过不同温度处理珠芽魔芋球茎后,萌发期珠芽魔芋球茎GA3含量呈现“先升后降”的规律,萌发后期球茎GA3含量最高,且存在显著性差异,结论与之相符。在莴苣(Lactucasativa)中,温度通过诱导NCED4调节ABA 合成,而通过细胞色素CYP707A2调节ABA 分解[41]。番茄SlNCED1基因是调控ABA合成的关键基因,而SlCYP707A2是调控ABA 分解代谢的关键基因,在番茄成熟过程中分别作为正调控因子和负调控因子发挥作用[42]。本研究中NCED基因表达量在珠芽魔芋休眠期增加,而在萌发期减少,CYP707A基因表达量却在休眠期减少,在萌发期增加。NCED、CYP707A两个基因可以作为珠芽魔芋球茎休眠和萌发过程中的关键基因,或为球茎休眠和萌发的标志基因,这对以后研究珠芽魔芋休眠相关机理具有重要意义,但与GA3合成相关调控途径及作用基因还待进一步研究。
4 结论
本研究以珠芽魔芋叶面球茎为材料,在球茎休眠期设置昼/夜变温、恒温及室温处理,萌发期设置不同温度催芽处理,分析了各处理珠芽魔芋球茎在休眠期以及萌发期的生物表型、内源淀粉、可溶性糖、ABA、GA3含量及其休眠调控相关基因的变化情况。结果表明,珠芽魔芋打破休眠的最佳温度为恒温13 ℃,促进萌发的最佳温度为33 ℃;随着珠芽魔芋打破休眠,球茎中的淀粉含量降低,可溶性糖含量升高,ABA 含量先升后降,GA3含量先降后升;NCED和CYP707A基因可能是珠芽魔芋休眠调控中的关键基因,它们可以作为珠芽魔芋球茎休眠的生物标志物来使用。该研究结果为珠芽魔芋产业化发展措施制定,以及通过生理、基因敲除和过表达等手段提早打破珠芽魔芋球茎休眠提供理论依据。
