淫羊藿次苷 Ⅱ 改善APP/PS1 双转基因小鼠认知功能的研究
2024-01-12闻彩名肖洪贺赵宇萌田晋明杨静娴
闻彩名,肖洪贺,田 雨,李 贺,赵宇萌,田晋明,杨静娴
(辽宁中医药大学药学院,辽宁 大连 116000)
阿尔茨海默病(Azhemer disease AD)是一种以进行性认知障碍和记忆能力衰退为主要症状的中枢神经系统退行性疾病[1],其病理特征主要包括脑内Aβ 淀粉样蛋白沉积、Tau 蛋白过度磷酸化导致的神经纤维缠结,以及神经元的退变性丢失等,其中Aβ淀粉蛋白沉积被认为是主要原因[3]。研究[4-5]表明,作为中枢神经系统(Central nervous system,CNS)的固有免疫细胞,星形胶质细胞、小胶质细胞参与炎症和神经损伤,是神经退行性疾病的始动因子,在Aβ 介导的神经损伤过程中扮演着重要的角色。因此减轻脑内炎症反应,改善脑内氧化应激水平是治疗AD 的有效途径。
淫羊藿次苷Ⅱ (IcarisideⅡ,ICS Ⅱ)是中药淫羊藿的主要活性成分之一[6],具有抗炎、抗肿瘤、抗雄性激素活性、神经保护等药理作用[7-9]。本课题组前期研究发现,以ICS Ⅱ为主要药效成分的参枣健脑口服液能有效抑制APP/PS1 小鼠脑内海马神经元凋亡,促进海马神经轴突再生[10]。基于上述研究结果,我们推测ICSⅡ具有改善APP/PS1 小鼠认知功能的作用,因此,采用筑巢实验,Morris 水迷宫实验、病理染色、免疫荧光染色,探究ICSⅡ改善Aβ 损伤引起的炎症反应进而改善APP/PS1 小鼠认知功能的作用。
1 实验材料
仪器:水迷宫分析系统(MS-1 型,成都仪器厂);冰冻切片机(HM525NX,ThermoFisher);荧光倒置显微镜(Ti-s,日本尼康公司);超低温冰箱(DW-86L386,青岛海尔公司);通用电泳仪(Power Pac Universal Power Supply,美国Bio-Rad 公司);半干式蛋白转膜仪(Trans-Blot SD,美国Bio-Rad 公司);凝胶成像仪(5200Multi,天能公司)。
主要药品与试剂:淫羊藿次苷 Ⅱ,购于四川省维克奇生物有限公司,批号:Wkq19050410;尼氏染色试剂盒、H&E 染色试剂盒,购于碧云天生物技术有限公司,批号分别为:C0117、C0105S;PBS粉末,购于索莱宝公司,批号:P1010;SOD 试剂盒、丙二醛(MDA)测定试剂盒(TBA 法),购于南京建成生物工程研究所,批号分别为:A001-1-2、A003-1-2;Rabbit Anti Aβ、Goat Anti-rabbit IgG/FITC、Rabbit Anti GFAP、AIF1 Polyclonal Antibody,购于博奥森生物有限公司,批号分别为:bs-0036R、bs-23379R、bs-0295G-FITC、bs-0199R、bs-1363R。驴抗兔Cy3 标记二抗,购于Jackson 公司,批号:88067。
实验动物:3 月龄SPF 级APP/PS1 小鼠(雄性)购于江苏华创信诺医药科技有限公司,合格证号为SCXK(苏)2020-0009。动物使用许可证编号;SYXK(辽)2019-0004。同龄SPF 级C57BL/6 小鼠(雌性)购于辽宁长生生物有限公司,合格证号为SCXK(辽) 2017-0001。饲养于温度20~25℃,相对湿度 40%~60%环境中,每日 12 h 光照维持,昼夜循环,自由摄食、饮水。雄性APP/PS1 小鼠和雌性C57BL/6 小鼠合笼繁殖,鉴定APP/PS1 阳性小鼠,饲养至7 月龄用于实验,同窝出生的阴性C57BL/6 小鼠作为空白对照组。
2 实验方法
2.1 动物分组与给药
取7 月龄雄性APP/PS1 小鼠30 只,随机分为模型对照组和ICS Ⅱ 给药组,每组15 只;另取15 只同窝出生的雄性C57BL/6 小鼠作为空白对照组。根据课题组前期实验结果确定ICS Ⅱ的灌胃给药剂量为10 mg·kg-1[11],每日1 次,连续灌胃28 d,空白对照组和模型对照组灌胃等体积的CMC-Na。
2.2 筑巢实验检测 APP/PS1 双转基因小鼠的日常生活能力
给药第20 天,将小鼠单笼饲养,笼中垫料更换为玉米芯垫料,在小鼠适应2 d 后开始实验。实验开始时更换新的玉米芯垫料,并在投料口处放置2 叠卫生纸片(5 cm×5 cm),每叠10 张,拍照跟踪小鼠筑巢情况,参照 5 分法原则进行评分[12-13],连续观察3 d。评分标准:1 分,没有明显的触碰和撕咬纸片;2 分,撕碎部分纸片;3 分,撕碎大部分纸片,但没有形成明显巢状;4 分,纸巾撕成碎片,并聚集形成1 个巢状结构;5 分,纸片撕成碎片,并聚集在形成1 个完整或接近完整的巢状结构。
2.3 Morris 水迷宫检测APP/PS1 双转基因小鼠的学习和记忆能力
筑巢实验结束后进行Morris 水迷宫实验。水迷宫系统由1 个黑色圆形水池(直径120 cm× 高60 cm)、1 个可移动的圆形平台(直径10 cm)、自动图像采集分析系统组成。将桶内分成东、西、南、北4 个象限,将平台置于其中1 个象限内,水面没过平台0.5~1.0 cm,温度控制在21℃左右。Morris水迷宫实验包括定位航行实验和空间探索实验。在定位航行实验中,将小鼠从任一象限 1/2 弧度处面向池壁轻放于水中,如果小鼠 60 s 内无法找到平台,则引至平台停留 20 s,每个象限训练 1 次,连续训练 5 d,记录小鼠找到平台所用的时间(逃避潜伏期)评估小鼠的学习能力。定位航行实验结束后撤去平台进行空间探索实验,选择原平台所处象限的对侧作为小鼠的放入点,测定小鼠60 s 内穿越原平台的次数以及在原平台所在象限停留的时间,并记录整个运动轨迹。根据穿越原平台的次数、在原平台所在象限停留时间百分比及第1 次穿越平台前的游泳距离,评估小鼠的空间记忆能力[14-16]。
2.4 HE 染色法检测小鼠脑组织病理损伤情况
采用 20%乌拉坦深度麻醉小鼠,暴露心脏,4%多聚甲醛(PFA)灌注固定,随即剥离脑组织,去除嗅球和小脑,置于30%蔗糖溶液中,4℃脱水至沉底后吸干表面水分,冰冻包埋剂包埋,行厚度为10 μm 的连续冠状切片,4%多聚甲醛固定15 min,苏木素染色5 min,流水去浮色,1% 盐酸乙醇分化10 s,0.5%氨水反蓝10 s,dd H2O 润洗,伊红染色3~5 s,洗去浮色,经 70%、80%、90%、无水乙醇脱水各5 min,二甲苯 I、二甲苯 Ⅱ各透明10 min,中性树胶封片,在显微镜下观察皮层和海马区域脑组织病理改变情况。
2.5 Nissl 法检测皮层和海马组织尼氏体数量
脑组织冰冻切片,4%多聚甲醛固定15 min,双蒸水润洗2 min,置于37℃尼氏染液中15 min,镜下观察,待尼氏体清晰后终止反应,双蒸水润洗5 s。依次经 90%、无水乙醇脱水,二甲苯透化5 min,中性树胶封片。显微镜下观察,拍照记录,并统计皮层、海马CA3 尼氏体数量。
2.6 免疫荧光染色法检测脑组织Aβ、GFAP、IBA-1的表达情况
脑组织冰冻切片,4%多聚甲醛固定 15 min,磷酸缓冲盐溶液(PBS)润洗3 次;1% Triton X-100透化30 min,5% 牛血清白蛋白(BSA)溶液封闭1 h,加入兔抗鼠Aβ(1:200)、兔抗鼠GFAP(1:200)、兔抗鼠IBA-1(1:150)置于湿盒中,4 ℃孵育过夜;PBS 润洗3 次,然后加FITC 标记山羊抗兔二抗(1:200)、Cy3 标记的二抗稀释液(1:200),室温避光孵育1 h,PBS 润洗3 次;DAPI 染核5 min,防荧光淬灭剂封片,荧光显微镜下观察。
2.7 TBA 法、羟胺法检测小鼠脑内氧化应激指标
取各组小鼠的海马及皮层组织,剪碎组织,冰水浴制备匀浆,加入适量的预冷PBS 溶液进行匀浆,4℃10 000 rpm,离心10 min,取上清液测定。按照SOD、MDA 检测方法试剂盒说明书进行。
2.8 统计学方法
采用GraphPad Prism 8.0 软件进行统计分析,实验数据以均数±标准差(±s) 表示,逃避潜伏期多组间不同时间点比较采用重复测量双因素方差分析(Two-wayANOVA),其他数据多组间比较采用单因素方差分析(One-wayANOVA),以P<0.05表示差异具有统计学意义。
3 实验结果
3.1 ICS Ⅱ 改善APP/PS1 小鼠日常生活能力
筑巢行为能够反映小鼠的日常生活能力。结果如图1 所示,空白对照组小鼠在投放纸片的 24 h 内即出现筑巢行为,在72 h 之内纸片被撕成小碎片,并筑成完整的巢状结构,模型组的 APP/PS1 小鼠没有将纸片撕成碎片,在 72 h 内纸片散落在鼠笼里,没有筑成完整的巢状结构,筑巢评分明显低于空白对照组(P<0.01);ICS Ⅱ给药组小鼠在 24 h 内出现筑巢行为,72 h 内大部分纸片被撕成碎片,形成较为完整的巢状结构,筑巢评分明显高于模型组(P<0.01)。以上结果提示,ICS Ⅱ能够改善APP/PS1 小鼠生活能力。
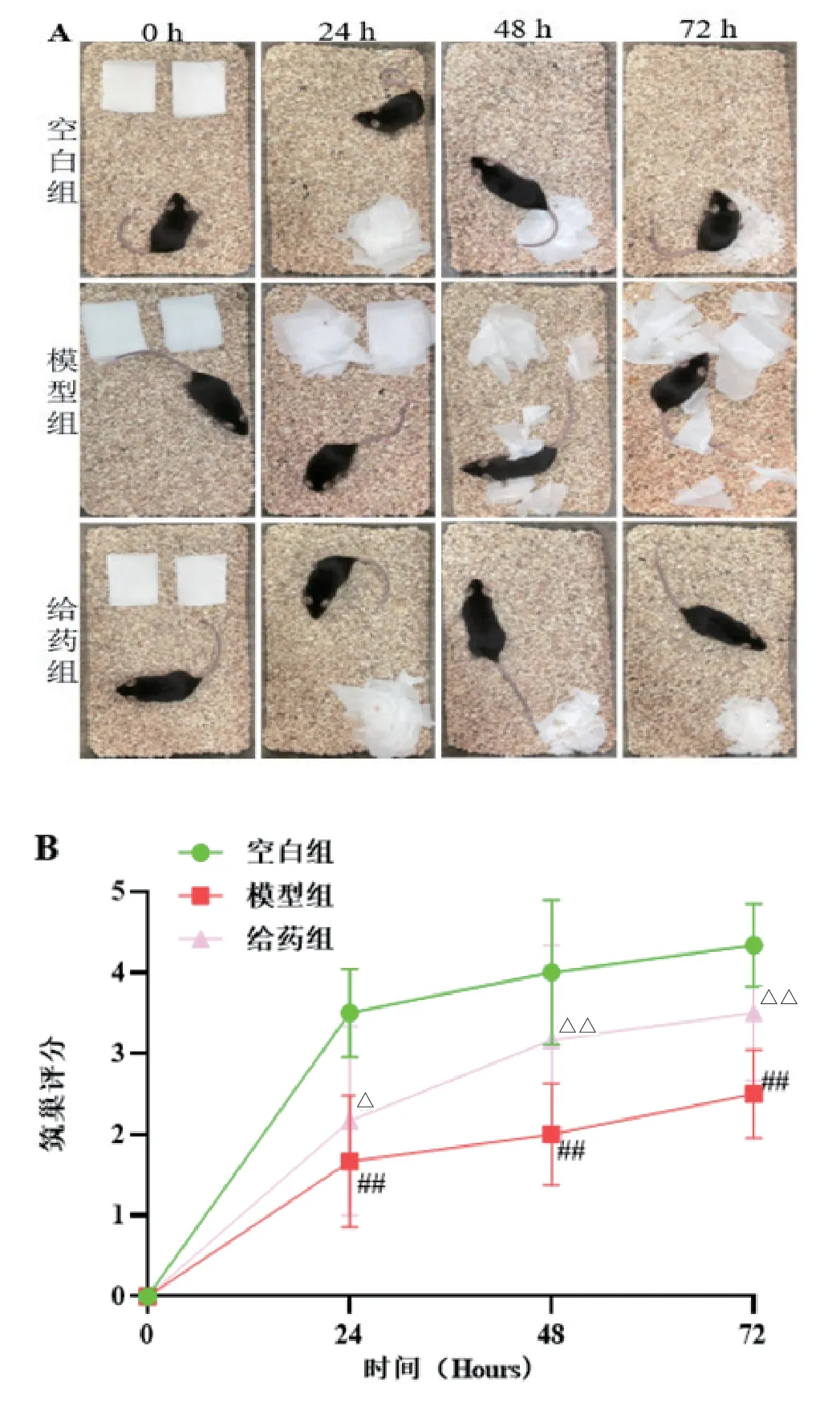
图1 筑巢实验检测各组小鼠的日常生活能力(n=10)
3.2 ICS Ⅱ 改善APP/PS1 双转基因小鼠学习和记忆能力
Morris 水迷宫实验结果如图2、图3 所示,从训练的第3 天开始,与空白组比较,模型组小鼠的逃避潜伏期明显增加(P<0.01),目标象限停留时间减少(P<0.01),游泳距离增加(P<0.01),穿越平台次数显著降低(P<0.01)。与模型组比较,给药组小鼠找到平台前游泳距离明显缩短(P<0.01)穿越平台次数和目标象限时间百分比明显升高(P<0.01)。各组小鼠的游泳速度无统计学差异(P>0.05),说明以上指标的改变并不是游泳速度不同导致的。以上结果提示,ICS Ⅱ 能改善 APP/PS1 小鼠学习和记忆能力。
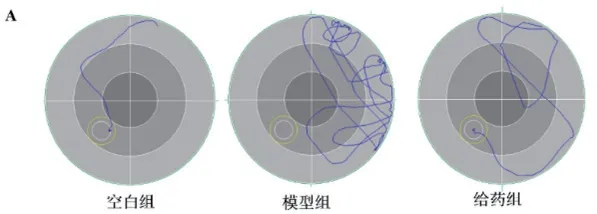
图2 定位航行实验第 5 天的游泳轨迹典型图(n=10)

图3 Moriss 水迷宫实验检测各组学习和记忆能力(n=10)
3.3 ICS Ⅱ 改善APP/PS1 小鼠脑组织病理损伤
HE 染色结果显示,空白组神经细胞数量多、层次清晰、排列整齐、胞质丰富,细胞核大而圆,胞核染色均匀,组织形态结构正常;模型组神经细胞则明显减少、排列松散、形态不规则,细胞核皱缩明显,说明模型小鼠脑组织明显受损;与模型组比较,给药组神经细胞数目明显增多,层次较为清晰,胞浆、胞核染色均匀,细胞核固缩明显减轻,以上结果提示ICS Ⅱ 能够减轻APP/PS1 模型小鼠脑组织的病理损伤。HE 染色结果见图4。

图4 HE 染色检测各组鼠皮层和海马病理损伤情况
Nissl 染色结果显示,空白组小鼠的皮层、海马CA3 和DG 区神经细胞排列整齐且紧密,尼氏体呈块状或虎斑状,尼氏体数量较多。模型组小鼠的皮层、海马CA3 和DG 区的尼氏体数量都较空白组明显减少(图5);给药组小鼠的上述区域尼氏体数量明显增多,与模型组比较差异显著(P<0.01,图6)。以上结果表明,ICS Ⅱ 对APP/PS1 小鼠脑的组织具有明显保护作用,显著减轻了APP/PS1 小鼠脑内神经元的损伤。

图5 Nissl 染色代表图(n=10)

图6 Nissl 染色检测各组小鼠皮层和海马的尼氏体病理损伤情况(n=3)
3.4 ICS Ⅱ 减少APP/PS1 小鼠脑内Aβ 淀粉样蛋白沉积
免疫荧光结果显示,空白组小鼠皮层和海马部位少见Aβ 淀粉样蛋白沉积,模型组小鼠皮层和海马区域Aβ 斑块数目显著增多,ICS Ⅱ 给药后Aβ 沉积明显减少。结果说明ICS Ⅱ 能减少小鼠脑内Aβ沉积。见图7。

图7 免疫荧光染色法检测各组海马区Aβ 沉积情况(n=3)
3.5 ISC Ⅱ 抑制APP/PS1 小鼠海马星形胶质细胞的过度活化
免疫荧光法检测各组小鼠脑内GFAP 的表达情况,结果见图8,与空白组比较,模型组小鼠海马GFAP 蛋白表达明显增多,提示模型组小鼠海马部位星形胶质细胞过度活化;经ISC Ⅱ治疗后,GFAP的表达较模型组明显下降,结果说明ISC Ⅱ抑制了APP/PS1 小鼠海马部位星形胶质细胞的过度活化。

图8 免疫荧光 染色法检测小鼠海马星形胶质细胞的表达情况
3.6 ISC Ⅱ 抑制APP/PS1 小鼠海马胶质细胞的过度激活
免疫荧光法检测IBA-1 表达情况识别各组小鼠海马部位的小胶质细胞数量,结果见图9,与空白组比较,模型组小鼠的小胶质细胞胞体变大,呈现阿米巴虫样,其IBA-1 表达量明显增加,提示模型组小鼠海马部位胶质细胞过度活化。与模型组比较,ICS Ⅱ给药组IBA-1 表达量明显减少,并且小胶质细胞胞体变小,说明ISC Ⅱ能有效抑制 APP/PS1 双转基因小鼠海马小胶质细胞的过度活化。

图9 免疫荧光染色法检测各组海马小胶质细胞的活化情况
3.7 ICS Ⅱ 减轻APP/PS1 小鼠脑内的氧化应激损伤
为探索ICSⅡ对APP/PS1 小鼠脑内氧化应激反应的抑制作用,本研究检测了小鼠脑组织SOD 与MDA 含量。结果见图10,与空白组相比,模型组小鼠脑内SOD 的活性明显降低(P<0.01),MDA水平明显升高(P<0.01),说明模型组小鼠脑内存在明显的氧化应激损伤;经ICS Ⅱ治疗后,小鼠脑内SOD 的活性明显升高,MDA 水平显著降低。以上结果说明ICS Ⅱ 能减轻小鼠脑内氧化应激损伤。
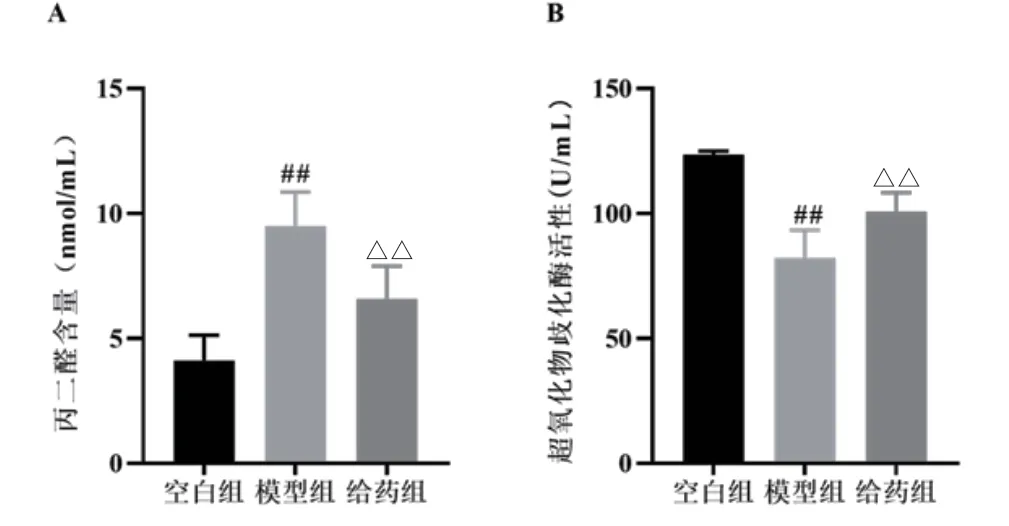
图10 TBA 法、羟胺法检测各组脑内氧化损伤情况(n=6)
4 讨论
AD 是一种由于自身中枢神经系统变性所致的慢性神经退行性疾病。随着我国人口老龄化进程的加快,AD 患者急剧增多,预计到2030 年AD 患者数量将达到6 500 万[17]。目前,科学家提出多种广为认可的 AD 发病机制假说,如Aβ 级联假说、胆碱能假说等[18]。
星形胶质细胞和小胶质细胞相互影响、密切关联,二者的相互作用参与AD 的病理改变。突触可塑性损害是AD 患者认知功能减退的重要原因。活化的小胶质细胞通过分泌神经毒素(如IL-1α 和TNF-γ)和补体成分(如C1q、C3)促使星形胶质细胞转化为具有神经毒性的A1 表型,从而导致神经元死亡、突触损害[19-20]。
APP/PS1 双转基因小鼠是AD 动物模型的典型代表。APP/PS1 基因病理表现为6~8 月龄出现斑块沉积,胶质增生,突触和神经元丢失,脑血管淀粉样变性,7 月龄时出现空间和学习记忆障碍[21]。
本实验结果表明模型组小鼠展示了更长的逃避潜伏期与航行距离,并且穿越平台的次数与停留在原平台所在象限的时间明显减少,无法完成筑巢,小鼠海马细胞排列稀疏,尼氏体模糊不清,Aβ 沉积过多、有炎症反应、有氧化应激损伤,证明APP/PS1 小鼠已经出现痴呆症状。经过ICS Ⅱ 给药后,APP/PS1 小鼠不仅能够缩短平均逃避潜伏期与航行距离,而且延长穿越平台的次数与停留在原平台所在象限的时间。ICS Ⅱ 能提高小鼠的筑巢行为,改善小鼠脑内细胞形态,减轻小鼠脑内Aβ 沉积情况,改善小鼠脑内海马区得炎症反应与小鼠脑内氧化应激损伤。本实验结果证明,ICS Ⅱ对APP/PS1 小鼠能起到一定的神经保护作用。
综上所述,ICSⅡ能够改善 APP/PS1 小鼠学习记忆能力,减少脑内炎症反应、抗氧化应激与Aβ 的沉积所致的病理损伤。
