蒙医温针下调脊髓背角小胶质细胞STAT3 缓解大鼠脊髓损伤后坐骨神经痛
2024-01-12斯楞格阿古拉阿日嘎太包立道阿茹娜
斯楞格,阿古拉,阿日嘎太,包立道,阿茹娜*
(1.内蒙古医科大学蒙医药学院蒙医传统疗法教研室,呼和浩特 010110;2.内蒙古科技大学包头医学院中医学院,内蒙古 包头 014040)
脊髓损伤常见为引起机体损伤平面以下的感觉、运动功能损伤,同时部分患者可合并中枢性坐骨神经痛(central neuropathic pain,CNP)样改变[1-2]。但目前针对中枢性坐骨神经痛的发生机制尚未阐明。STAT3 信号传导通路具有外周神经损伤后脊髓功能的中枢敏化效应,可能是坐骨神经痛的发病机制[3-4]。坐骨神经痛多数病例是继发于坐骨神经局部及周围结构的病变对坐骨神经的刺激压迫与损害,称为继发坐骨神经痛;少数系原发性即坐骨神经炎,属蒙医“白脉病”范畴[5-7]。大量的实践研究表明,蒙医温针是一种有效的镇痛方法,可通过增加CCI 模型大鼠的中脑导水管周围灰质中5-HT 和NE 的含量,降低GABA 和ACH 的含量起到镇痛作用。对于慢性坐骨神经痛有良好的疗效[8-10]。STAT3 信号通路被认为是外周神经损伤后中枢敏化过程中的主要调节信号,其介导神经小胶质细胞的激活,引起机体无菌性炎症反应,增加神经系统兴奋性,进而引起脊髓损伤后中枢性坐骨神经痛的发生发展。本研究利用慢病毒构建携带STAT3 siRNA的转染体,从而特异性的激活小胶质细胞STAT3信号转导通路,并观察脊髓损伤后中枢性坐骨神经痛大鼠STAT3 表达水平变化情况,从而为阐明蒙医温针治疗脊髓损伤后中枢性坐骨神经痛的作用机制提供依据。
1 材料与方法
1.1 实验动物及分组
SPF 级健康3 月龄雄性Wistar 大鼠(内蒙古医科大学实验动物中心提供,实验动物许可证号:SCXK 蒙2013-0004),体质量200~250 g。自由摄食和饮水,室温21℃~23℃。随机分为5 组,正常对照组(Normal 组,n=15);假手术组(Sham 组,n=20);脊髓钝性损伤模型组(CNP 组,n=30):STAT3 siRNA 注射组(n=30),蒙医温针治疗组(n=30)。本研究通过内蒙古医科大学生物医学科研伦理审批(YKD2018094)。
1.2 模型
用Nembutal(50 mg·mL-1)腹腔注射大鼠麻醉,取背部正中相当于T8、T9、T10 脊椎水平,暴露T8、T9、T10 椎体,T10 椎板切除,背侧暴露T10 脊髓,固定脊柱,置于NYU Impactor 设备(ABI PE-Applied Biosystem)之下,调节高度和撞击水平,以150 kdyn撞击力损伤脊髓。损伤后,逐层缝合肌肉、皮肤。
1.3 蒙医温针治疗方法
取鼠膝眼穴(髌韧带两侧凹陷处),髋穴(臀下横纹的中点)用特制银针(内蒙古医学院蒙医药学院,专利号:ZL201120058078.0,直径0.5 mm,长度3.0 cm)斜刺,并连接MLY-I 型蒙医疗术温针仪(内蒙古医学院蒙医药学院,专利号:ZL201120058078.0)。电流强度100 mA,温度40 ℃,每次刺激15 min,每隔2 d 治疗1 次,共30 次。
1.4 观察指标
运动功能:运动神经功能评定采用BBB 分级法进行评定;热缩足持续时间测量,分别于造模前1 天、造模后3、7、14、21、28 d 针对大鼠后肢热痛阈值进行干预,待大鼠出现缩足反射时立刻按下秒表进行计时,直至缩足反射消失停止计时;机械性痛觉超敏测量:使用足底触觉测量仪,于造模前1 天、造模后3、7、14、21、28 d 测定大鼠后肢机械痛阈值,记录大鼠出现50%缩足反应时的压力值。
1.5 统计学方法
采用SPSS 16.0 统计软件进行数据处理,以均数±标准差(±s)表示,2 组间差异比较用t检验;多组间差异比较用方差分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠行为学评分结果
CNP 组大鼠造模后28 d 时BBB 评分,高于造模 后3、7、14、21 d 时 (P<0.05),Sham 组及Normal 造模前、造模后BBB 评分无明显差异(P>0.05)。CNP 组大鼠造模后第3 天开始后肢热缩足持续时间短于Sham 组和Normal 组(P=0.032)。CNP 组鼠术后第3 天,后肢机械缩爪阈值低于Sham组和Normal 组(P=0.021)。见表1。

表1 假手术组、正常对照组及CNP 组大鼠的行为学结果
2.2 蒙医温针治疗及鞘内注射STAT3 siRNA 药后大鼠行为学影响
蒙医温针组及STAT3 siRNA 组大鼠的TWD时间与Normal 组、Sham 组和空载病毒组相比显著降低(P<0.01),MWT 显著升高(P<0.01),BBB 评分显著升高(P<0.01);蒙医温针治疗后,造模后第7 天、第14 天和第28 天脊髓STAT3表达均显著降低(P<0.01),蒙医温针组及STAT3 siRNA 组STAT3 mRNA 表达显著低于Normol 组、Sham 组和空载病毒组(P<0.01)。见表2,图1,图2。
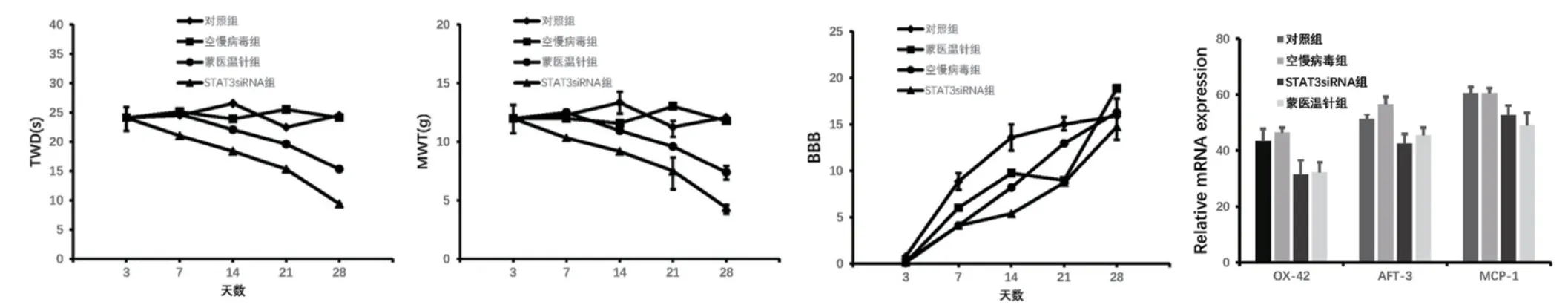
图1 各组TWD、MWT、BBB 等行为学评分及OX-42、AFT-3、MCP-1 等mRNA 相对表达水平
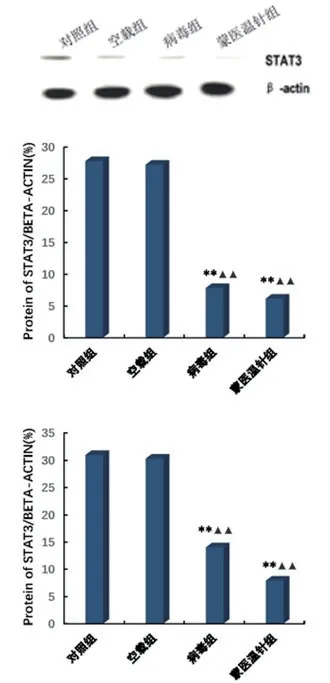
图2 各组造模后7d、14d、28d 脊髓STAT3 蛋白表达及mRNA 相对表达
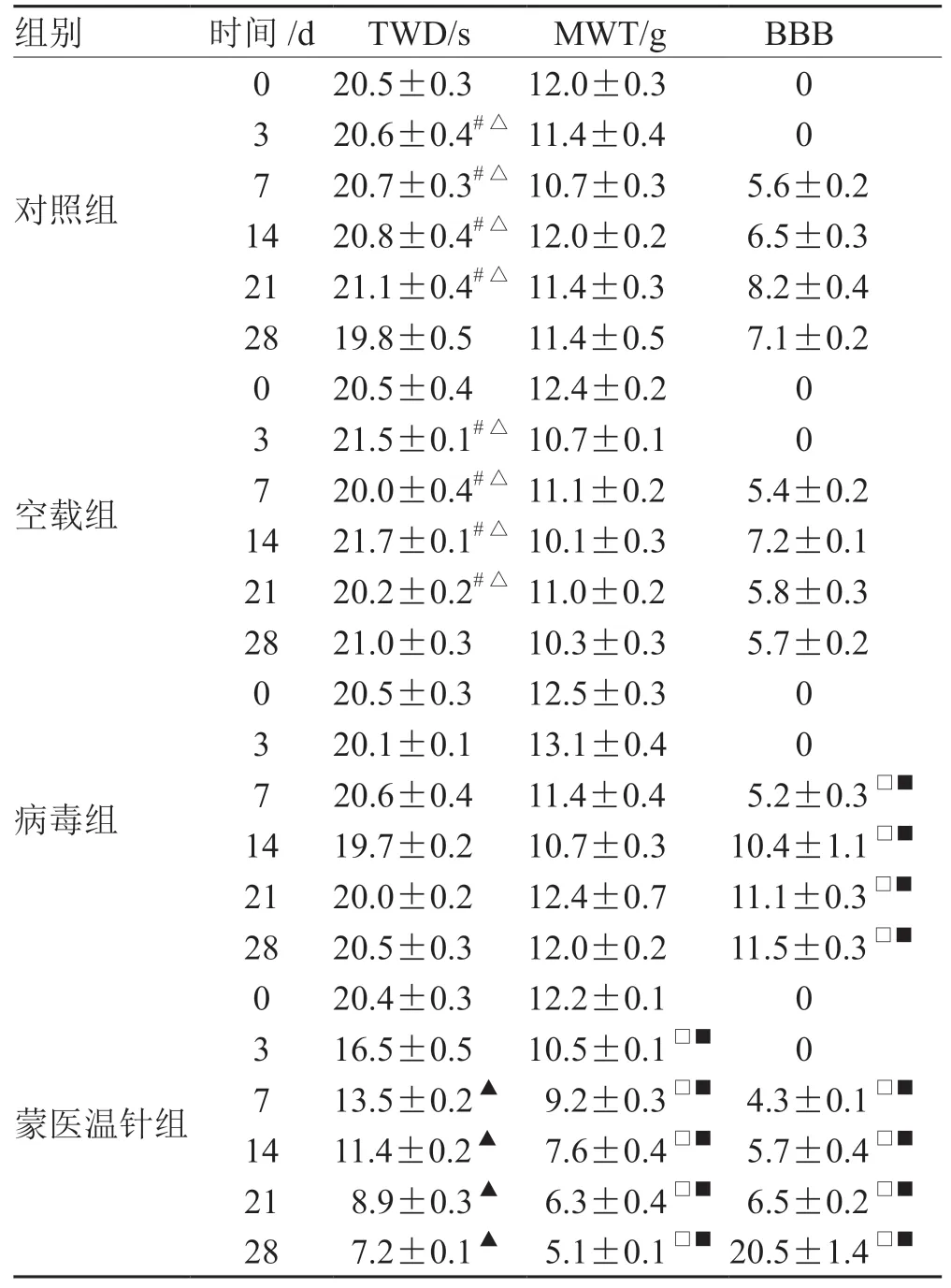
表2 蒙医温针治疗及鞘内注射STAT3siRNA 药后大鼠行为学影响
3 讨论
近期研究发现,STAT3 信号通路在外周神经损伤后脊髓中枢敏化形成中起到重要作用,小胶质细胞活化增殖进一步促进TNF-α 及MCP-1 等炎性因子产生和释放增多,进而引起一系列免疫炎症反应和神经兴奋性增高,导致坐骨神经痛发生和发展。本研究通过荧光双标染色观察到STAT3 主要是在小胶质细胞中表达分布,从基因和蛋白质水平分别检T10 节段脊髓损伤后中枢神经痛模型大鼠腰4~6节段脊髓背角的STAT3 表达水平,发现脊髓损伤7 d大鼠脊髓的STAT3 mRNA 和蛋白质均较Normol 组和Sham 组显著增加,研究采用实时定量PCR、免疫组织化学和Western Blot 检测STAT3 在T10 节段脊髓损伤后中枢神经痛大鼠腰4~6 节段脊髓背角的分布及表达,结果相互验证,且CNP 组STAT3 表达上调的同时,疼痛行为学也有相应改变。以上实验结果初步表明,腰4~6 节段脊髓背角中的STAT3表达增加与中枢神经痛产生和维持存在一定相关性。
STAT3 信号通路被认为是外周神经损伤后中枢敏化过程中的主要调节信号,可介导神经小胶质细胞激活,引起机体无菌性炎症反应[11-13],增加神经系统兴奋性,引起脊髓损伤后中枢性坐骨神经痛发生[14]。本研究以基因和蛋白质水平检测T10 节段脊髓损伤造模大鼠的腰4~6 节段脊髓背角STAT3 水平,研究结果提示造模成功后7 天,大鼠腰4~6 节段脊髓背角的STAT3mRNA 及蛋白水平均显著高于Normol 组及Sham 组。同时检测实验大鼠STAT3 的分布与表达,各种实验方法所得结果具有高度吻合性,均提示CNP 组大鼠STAT3 水平明显升高,且疼痛行为学亦存在相应变化,从而可认为T10 节段脊髓损伤造模大鼠的腰4~6 节段脊髓背角STAT3 表达水平的升高与中枢性神经痛的发生发展存在相关性。
本研究检测了T10 节段脊髓钝性损伤后腰4~6节段脊髓背角小胶质细胞和星形胶质细胞的活化表达分布,造模后1 d 起,腰4~6 节段脊髓背角OX-42和GFAP 染色阳性细胞开始增多,染色加深,突起显著增多,小胶质细胞核星形胶质细胞同时开始活化,CNP 大鼠腰4~6 节段脊髓背角的OX-42 染色阳性细胞数在脊髓损伤后第7 天达到高峰。说明脊髓损伤后小胶质细胞和星形胶质细胞激活兴奋激活可能是脊髓损伤节段之下的CNP早期启动和维持的重要因素,在CNP 早期小胶质细胞激活更为明显。
本研究将RNAi 技术结合慢病毒载体技术,在大鼠T10 脊髓损伤后第3 天开始,行蒙医温针治疗及蛛网膜下腔内连续注射STAT3 siRNA 治疗,结果提示造模后第3 天开始,给予蒙医温针治疗和蛛网膜下腔内连续注射STAT3 siRNA 治疗,蒙医温针组及STAT3 siRNA 组大鼠的TWD 时间与Normol组、Sham 组和空载病毒组相比显著降低,MWT 显著升高,BBB 评分显著升高;蒙医温针治疗后,于造模后第7 天、第14 天和第28 天脊髓STAT3 表达均显著降低,蒙医温针组及STAT3 siRNA 组STAT3 mRNA 表达显著低于Normol 组、Sham 组和空载病毒组。表明在脊髓损伤后中枢神经痛形成早期,小胶质细STAT3 信号转导通路的激活可能发挥重要作用[15-16],蒙医温针治疗坐骨神经痛可能通过影响STAT3 信号途径发挥作用[17]。
综上所述,小胶质细胞内STAT3 信号转导通路的激活可能为脊髓损伤后中枢性坐骨神经痛的发病机制之一,蒙医温针治疗可能通过阻断脊髓背角小胶质细胞内STAT 信号转导通路活性而发挥治疗作用。
