啮齿类动物抑郁相关行为学评价*
2024-01-10卢宇佳王安娜赵静洁
卢宇佳 张 珊 赵 谦 王安娜 李 丽 赵静洁
(首都医科大学附属北京友谊医院,北京 100050)
抑郁症又称抑郁障碍,以显著而持久的心境低落为主要临床特征,是心境障碍的主要类型。世界卫生组织预测,2030年抑郁症将成为最大的健康挑战[1]。研究者尝试建立稳定的抑郁相关动物模型,用于其机制研究及开发治疗药物。啮齿类动物价格低廉、繁殖迅速、取材简便。造模后出现的一般活动状态的改变、对新鲜环境的好奇程度及探索能力下降、快感丧失等特征,与抑郁症精神运动性变化相似。因此为抑郁相关模型的常用动物选择。
在过去的50年中,抑郁相关动物模型的构建推动了抑郁症病理生理学研究,促进了抗抑郁药物的开发。抑郁相关动物模型构建最初基于手术方法(例如嗅球切除术)或急性应激诱导。近年来研究表明,与短期急性应激相比,慢性长期应激,如慢性束缚应激、慢性社会挫败应激和慢性不可预知的温和刺激似乎可以模拟人类在日常生活中接受的不良应激事件,更加有效构建了抑郁症动物模型[2]。判断这些模型是否造模成功,抗抑郁药物是否有效的评价方法主要基于行为学实验。常用的行为学实验主要分为:检测绝望情绪的实验,如强迫游泳实验、悬尾实验[3]。基于奖赏的实验,如糖水偏好实验、新奇抑制摄食实验[4]。基于探索行为的实验,如旷场实验、高架十字迷宫实验、明暗箱实验[5]。然而目前关于行为学评价操作方法不统一,为使其对抑郁症模型评价的准确度更高,本文基于绝望、奖赏、探索三个方面对啮齿类动物抑郁相关行为学评价方法进行全面疏理,总结如下:
1 资料来源和检索策略
作者于2021年10月在中国知网(CNKI)、万方数据知识服务平台、National Center for Biotechnology Information(PubMed)数据库进行检索;其中检索式为“主题+自由词”,抑郁(depression or depressive-like)AND行为学(behavior)AND啮齿类动物(rodent or rat or mouse),共检索出438篇相关文献。
2 文献纳入标准和排除标准
纳入标准:(1)涵盖抑郁症动物行为学评价的相关文献;(2)2010年12月至2021年10月公开发表的期刊文献;(3)研究设计完整的文献。
排除标准:(1)综述等二次评价类文献;(2)抑郁症合并其他疾病的文献;(3)用于评价其他精神类疾病的文献;(4)行为学评价流程或结果描述不清;(5)所涉及行为学方法使用频率较低。
3 质量评估与数据提取
本次综述最后纳入文献196篇,约2/3文献是近5年内的,如同一研究团队发表,中英文观点一致,选择文献质量较高的纳入。纳入的文献着重阐述抑郁相关动物模型的行为学评价相关研究。因行为学评价方法较多,操作流程不一,仅作定性描述(图1)。
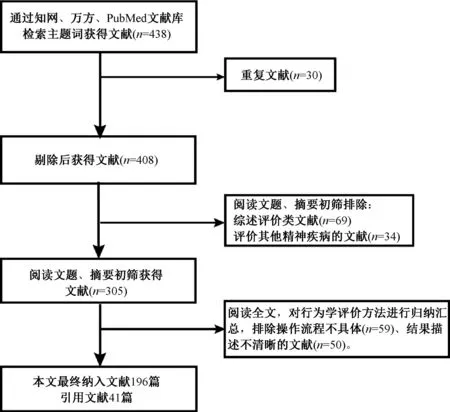
图1 文献筛选流程图Fig.1 Flow chat of literature screening
4 文献研究结果
4.1 行为学检测方法
啮齿类动物行为学检测,在精神类疾病研究中具有重要意义。通过观察啮齿类动物行为学变化,结合现代临床中精神疾病的症状,加深人类对精神类疾病的探索和药物的研发。由于行为学检测目的不同,各实验室选择的组合方式不尽相同,本文基于绝望、奖赏、探索三个方面,对所纳入文献中涉及的行为学检测方法出现频率进行了统计(表1)。
4.2 基于绝望的行为学检测方法
4.2.1强迫游泳实验(forced swimming test,FST):早在1977年法国学者Porsolt发明了该实验并将其用于行为绝望的抑郁模型造模[6]。啮齿类动物因无法脱离困境,放弃挣扎的行为表现,属于“行为绝望”。此种行为不仅是身体能量或运动减少的反应,而且表明动物的精神活动水平。FST可以较好的模拟抑郁障碍患者的绝望感,在抑郁症研究中应用广泛[7]。
根据对各团队发表文献查阅,现总结基本流程如下:实验前应排除游泳能力不佳的动物。小鼠/大鼠适应性游泳时间为10~15 min,适应后将小鼠/大鼠置于湿度45%~65%,温度21~23 ℃的实验环境中,间隔24 h进行正式实验。如图2所示,选择往圆柱体(大鼠和小鼠所需高度分别约为50、30 cm,直径分别约为30、20 cm)水缸中注水,液面高度以鼠尾不能碰触为宜。适应后,将动物放入水中并记录,小鼠/大鼠记录时间为5~10 min(部分实验团队将动物放入水中10 min,记录后4~5 min游泳不动时间)。记录后捞出吹干,恢复体温,每只动物交换时换水[8]。实验动物维持漂浮状态:身体微蜷,只露出鼻孔维持呼吸,前爪停止刨水,后爪偶有划水,定义为“静止时间”,静止时间长的动物为绝望行为明显[9],抑郁表型鲜明。
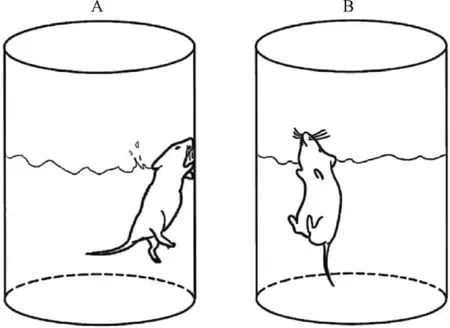
注:A.强迫游泳实验中小鼠挣扎状态;B.强迫游泳实验中小鼠静止状态。Note: A.Struggling state of mice in the FST;B.Stationary state of the mice in the FST.
实验环境、水温是影响该实验结果的重要因素,因此该实验需注意的是:(1)由于实验光线较强,会缩短啮齿类动物不动时间,不利于准确反映其抑郁状态[9],因此FST实验应在不超过0.96 W/m2环境下进行[10]。(2)水温是FST重要影响因素之一,研究表明,水温与静止状态呈U型关系,水温过低或过高则会缩短不动时间,故宜控制在20~25 ℃[12]。
4.2.2悬尾实验(tail suspension test,TST):1985年Steru等[13]提出悬尾实验,用于建立行为绝望模型。现代研究认为,TST可用于广泛测定广谱抗抑郁药的作用效果,价格低廉且方法简单,易于自动化。啮齿类动物由于尾端倒悬,产生剧烈挣扎,一段时间后因不能摆脱,出现不动状态,此状态类似抑郁症患者的绝望行为[14]。
通过总结文献了解,各实验团队实验时将小鼠置于12 h/12 h昼夜间断照明,湿度45%~65%,温度21~23 ℃的实验环境中,用胶带将小鼠的尾端悬挂在与地板距离为 20~25 cm的悬挂杆上。实验动物较多时,为防止动物彼此观察或互相影响,中间用隔板隔开;动物悬挂在隔间中间,宽度和深度足够大,不能与墙壁接触。如图3所示,当小鼠在悬挂时表现出的无挣扎状态视为不动时间,记录时常为5~10 min(部分实验团队实验进行10 min,记录后4~5 min的不动时间)。不动时间长的小鼠绝望行为明显。

注:A.悬尾实验中小鼠挣扎状态;B.悬尾实验中小鼠静止状态。Note: A.Struggling state of mice in the TST;B.Stationary state of the mice in the TST.
TST原理与FST原理相近,在众多实验团队发表的文章中,其实验结果也具有一致性[15]。然而,TST实验结果依赖于啮齿类动物的运动行为,不同品系的啮齿类动物对实验有较大影响。如大鼠体型较大,悬尾时可上翻,不适用于TST。也有实验团队认为C57BL/6小鼠存在沿着尾巴上爬的趋势,对TST测试结果影响较大[16]。因此为避免因品系不同对实验结果造成影响,应在实验前,测量实验动物尾巴占总体长度的百分比,以确定其爬上尾巴的程度,将上爬趋势明显的实验动物在数据中排除,以免对数据造成干扰。
4.3 基于奖赏的行为学检测方法
4.3.1糖水偏好实验(sucrose preference test,SPT):1981年,Katz等[17]首次在抑郁症动物造模过程中发现,应激后的模型鼠在SPT实验中,消耗量减少了50%。Willner P等[18]发现内源性抑郁症的核心特征是奖励机制缺陷和快感缺乏。SPT因其有效的模拟了抑郁症患者快感缺乏的临床表现,被广泛应用于抑郁动物模型造模成功与否的评价[19]。
根据现有文献总结实施步骤如下:将啮齿类动物置于12 h/12 h昼夜间断照明,湿度45%~65%,温度21~23 ℃的实验环境中单笼饲养(小鼠多采用长×宽×高约为10 cm×24 cm×13 cm,大鼠采用38 cm×32 cm×18 cm),可自由接触糖水瓶与白水瓶。在笼具上方放置瓶A、瓶B(瓶A为1%~2%蔗糖,瓶B为无糖饮用水)进行12~24 h实验装置适应,实验动物可自由进食。适应结束,禁食禁水12~24 h后,进行测试,实验动物给予瓶A与瓶B测量12~24 h。瓶A与瓶B测试前后都需称重。饮糖水比率根据公式A/(A+B)×100%计算[20]。
部分实验团队认为,实验动物糖水消耗量占总饮水量的比率<60%,则该动物有快感缺失。也有部分实验团队进行SPT实验时,糖水消耗量占总饮水量的比率>60%。这可能与实验适应时间、实验环境、糖水浓度等关系密切。因此实验时应注意:(1)实验前应进行“两瓶水装置”适应性喂养,以降低突然增加装置动物不能识别造成的实验偏差。(2)正式实验前应基线测量,排除个体差异(例如,个体天生不喜爱糖水而影响整体糖水偏爱率的评估)[21]。(3)如是禁水24 h后进行该实验,应测试24 h的糖水消耗量,因为1 h测试方法会使禁水动物因口渴而选择就近原则,不一定表现出偏爱糖水行为。(4)根据动物喜好,蔗糖浓度可在1%~2%变化,但实验研究表明2%浓度实验结果明显优于1%[3]。
4.3.2新奇摄食抑制实验(novelty suppressed feeding test,NSF):NSF实验依据禁食后啮齿类动物在新奇环境摄食潜伏期延长的原理,测量其在新环境的进食潜伏期,评估动物的抑郁状态。NSF表现了啮齿类动物摄食的消沉程度及焦虑水平。啮齿类动物摄食的渴望和对新奇空间的惧怕两者之间的矛盾竞争,使得该实验能够有效反应临床中抑郁症患者的快感缺失[22]。
实验前,模型动物置于12 h/12 h昼夜间断照明,湿度45%~65%,温度21~23 ℃,可自由活动的实验环境中,禁食不禁水12~24 h。准备一定尺寸(小鼠多采用长×宽×高约为50 cm×40 cm×30 cm,大鼠采用70 cm×70 cm×50 cm)旷场箱,旷场中央放置7~8 g的鼠粮,将动物沿箱子一角放入,记录5 min内成功觅食所花费的时间及啃食食物的总重量。动物的摄食潜伏期越长,则表示焦虑程度越高。
通过总结文献,环境因素对该实验具有较大影响。(1)实验过程中,应尽量实验环境安静,最大程度减少噪音对啮齿类动物的影响。(2)为了顺应啮齿类动物的摄食习惯,应选择较暗的实验环境,光照应在0.12 W/m2左右。(3)该实验需排除因为食欲差异而导致影响进食时间,故在模型动物放回笼中后需要记录5~10 min的食物消耗量。(4)为保证实验准确,在每次实验前应校准天平,清除天平上食物碎屑并擦拭干净。此实验可多次重复,为避免动物熟悉环境,而违背此实验原理,两次实验间隔时间应大于5 d。
4.4 基于探索的行为学检测方法
4.4.1旷场实验(open field test,OFT):Hall等在1934年首次将OFT测试应用于动物情绪研究中[23]。其原理基于啮齿类动物畏惧空旷场地的天性,即其活动具有趋避性,对新事物易产生好奇性。OFT作为啮齿类动物抑郁焦虑状态的行为学评价方法,已推广到神经学及精神药理学的研究中。
主要操作流程为:大小鼠旷场装置不同(小鼠旷场一般为30~50 cm长的正方形,深30 cm;大鼠旷场一般为小鼠两倍,60~100 cm,深30 cm)。如图4所示,旷场周围由黑色不透明挡板围成,并配有摄像头,旷场中心边界到外周的距离为总距离的20%或25%,即红色方格区域为中心区,黑色方格区域为外周区域。测试时应提前30 min,把模型动物放置在测试房间适应,周围环境参数为12 h/12 h昼夜间断照明,实验光照强度不超过0.12 W/m2,湿度45%~65%,温度21~23 ℃。适应结束,把动物放入旷场中心,同时开始视频记录,测试过程5~10 min。测试结束,软件追踪并记录啮齿类动物在旷场中心区及外周区停留时间。
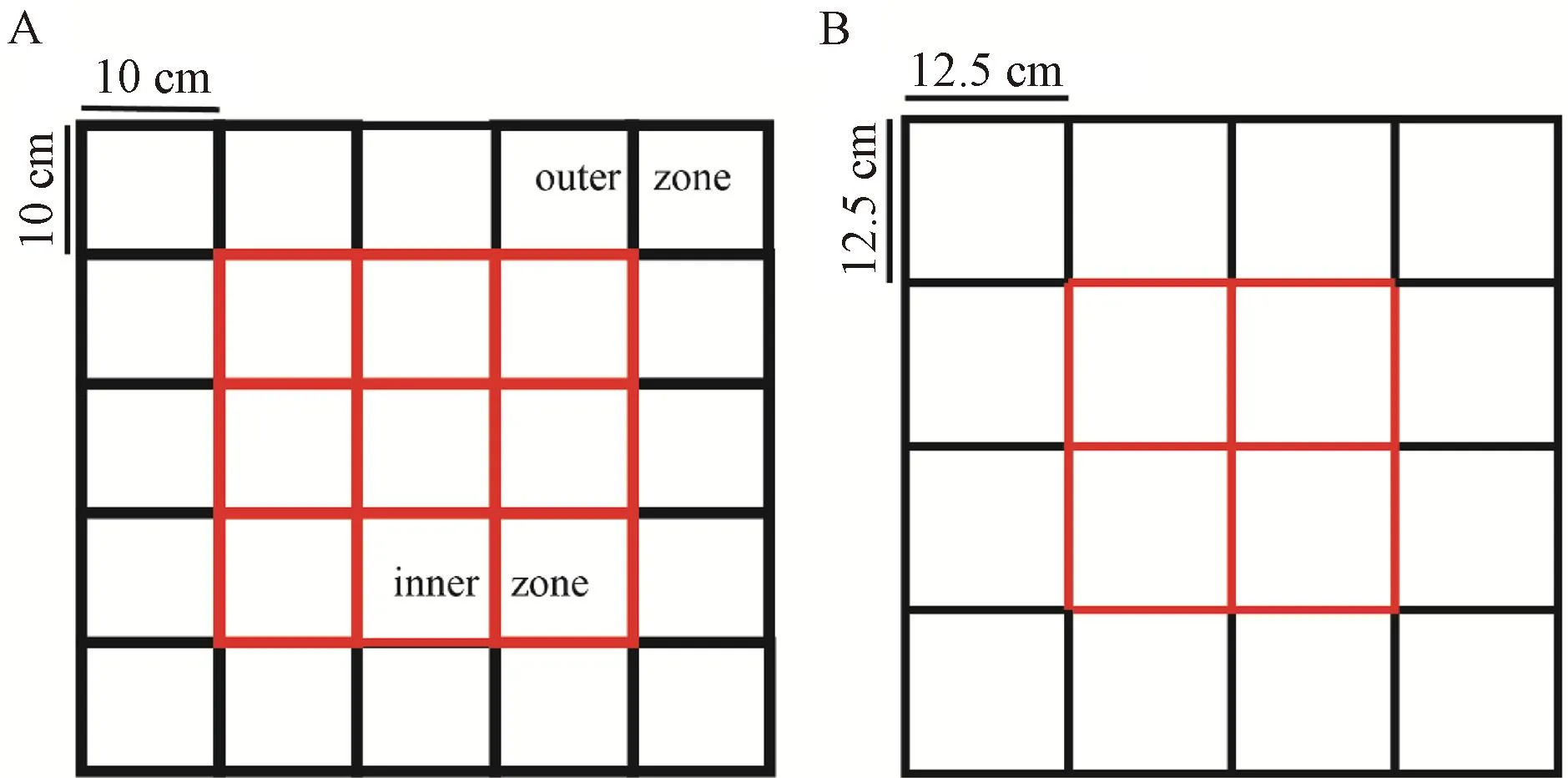
注:图中所示长宽为小鼠装置所用,中心边界至外周距离比总距离,A为20%,B为25%。Note: The length and width shown in the figure are for the mice device, and the distance from the center boundary to the periphery is 20% for A and 25% for B.
通过对不同文献的查阅总结,在具体操作中应注意如下几点:(1)实验中需保持安静环境,以免噪音干扰,使模型动物产生紧张的情绪。(2)旷场需清洁除味,防止模型动物因嗅到同类的气味而产生警觉性。(3)基于啮齿类动物嗜暗的特性,应注意旷场亮度,使模型动物更接近其自然天性,增加实验结果的准确性。
4.4.2高架十字迷宫实验(elevated plus maze,EPM):EPM基于啮齿类动物对新异环境产生的探究性和对高悬敞开臂产生的恐惧心理的特点,利用二者所形成的矛盾冲突行为考察其焦虑状态。EMP能有效反映临床中患者的焦虑状态,被广泛用于精神类药物药理研究,可有效评估抗焦虑药物的药理效应[24]。
测试前1周,应把模型动物放置在测试房间中进行适应,周围环境参数为12 h/12 h昼夜间断照明,温度21~23 ℃,湿度45%~65%,自由饮用食水。如图5所示,实验者通常将小鼠置于长宽约为50 cm×10 cm的两对相对开放臂(大鼠的开放臂长度多>45 cm、宽度为10或15 cm)和长宽高分别约为50 cm×10 cm×40 cm的两对相对闭合臂(大鼠闭合臂的长宽与开放臂相同)及10 cm×10 cm连接成的中央区(大鼠多为15 cm×15 cm或10 cm×10 cm)[25]。记录实验动物放置于中心区后5~10 min内行为变化,目前多采用进入开放臂次数/时间百分比作为判定结果。

注:图中所示装置长度均为小鼠所用,A为高架十字迷宫结构图,B为小鼠运动模式图。Note: The length of the device shown is used by mice, A is the structure of the elevated plus maze, B is the movement pattern of the mouse.
参考各研究团队实验结果,在操作过程中应考虑以下几点:(1)模型动物初始摆放位置较为关键,目前多认为应将其放在中央连接区,头朝向开放臂,使其陷入探究与回避的矛盾中,更有利于通过记录开放臂的时间及次数客观评价其焦虑程度。若头朝向封闭臂,则使模型动物更倾向于躲避,在实验全程不进入开放臂。(2)光照强度应保持统一,以便行为分析软件能更好的追踪动物[26]。笔者建议选择灯光为25 W灯泡,置于中央区40 cm处照明。(3)实验时间以5~10 min为宜,时间过短,动物尚未适应环境,时间过长则可能造成动物对开放环境新奇度降低。(4)两次实验之间应使用乙醇喷洒并擦拭迷宫箱,避免实验动物气味对实验结果造成一定影响。(5)为精确实验结果,可将此实验重复2次,每次间隔1周。
4.4.3明暗箱实验(light/dark box,LDB):LDB利用动物对强光线的厌恶感以及对新奇环境探究习性之间的矛盾冲突,广泛用于评价啮齿类动物的焦虑样行为。实验研究表明,啮齿类动物明箱活动时间与穿梭次数差异,模拟了抑郁症患者在临床当中的抑郁焦虑样行为。
测试前1周,应把模型动物放置于12 h/12 h昼夜间断照明,温度21~23 ℃,湿度45%~65%,自由饮用食水的实验环境中。如图6所示,明暗箱(小鼠多采用长×宽×高约为45 cm×45 cm×30 cm,大鼠采用62 cm×48 cm×51 cm),包括较宽阔的明箱区(小鼠采用30 cm×45 cm×30 cm,大鼠采用42 cm×48 cm×51 cm),较狭窄的暗箱区(小鼠采用15 cm×45 cm×30 cm,大鼠采用20 cm×48 cm×51 cm),两箱体隔板中间存在通道,可允许实验动物自由穿梭。实验者将小鼠放置明箱区正中央,通过摄像系统记录5~10 min内动物的行为变化,包括暗箱停留时间、垂直运动及穿梭次数[27]。
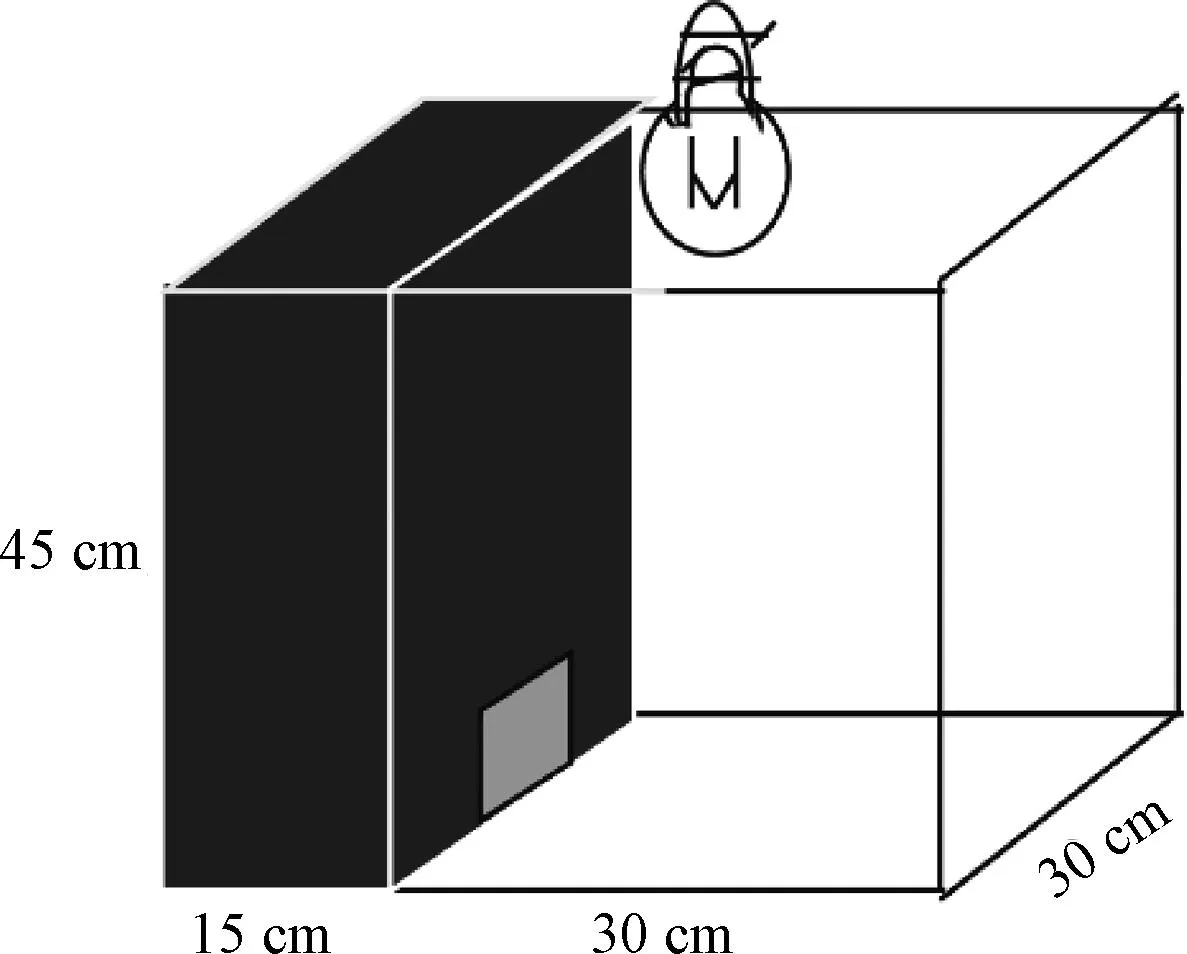
图6 明暗箱实验示意图Fig.6 Diagram of light/dark box
在总结文献后,我们应注意(1)LDB是基于啮齿类动物天生对明亮区域的厌恶,以及啮齿类动物对新环境的自发探索行为,应选择30 W灯泡距离箱底45 cm处照明,使明暗箱区域对比明显,避免假阳性实验结果。(2)啮齿类动物的焦虑情绪易受到外界环境改变的影响;应保证实验过程中光照强度、光照位置、光照颜色保持一致。(3)明暗箱在实验中需清洁除味,防止模型动物因嗅到特殊气味而产生焦虑情绪。
5 讨论
行为学检测方法有助于衡量疾病的表型状态,尤其适用于神经、精神类动物模型辅助探究疾病机制及药物疗效等。在研究过程中,选择的行为学评价方法是否恰当、行为学实验操作是否合理关系到研究成果的科学性、有效性和外推性。尤其是对于尚无客观病理特征和诊断标志物的神经、精神疾病,必须由行为学评价作为其疾病表型的评估方法。
因此,行为学评价的规范化操作是保障其客观有效的关键所在。由于啮齿类动物行为学检测受环境影响较大,如光照强度、声音、温度、气味等,导致不同实验团队实验结果存在差异。为使行为学结果更加准确可靠,未来行为学实验的发展应尽可能寻求标准化和统一化,以减少各变量对实验结果造成的影响。其次,行为学评价过程应进一步客观化,为提高实验结果的准确性,应更加广泛发展计算机图像识别技术的应用,避免实验人员的主观因素对实验动物的运动表现造成错记和漏记。此外,多种行为学评价方法联合使用、多种行为学结果综合分析,可一定程度上避免单一指标的局限性,更能提高不同疾病模型的行为学评价的可信性。
