新型同种异体骨修复骨缺损动物实验研究
2024-01-10朱力鸣李胜利
朱力鸣 焦 昆 刘 伟 李胜利
(1.首都医科大学实验动物部,北京 100069)(2. 北京化工大学,北京 100029)
临床上,因外伤、先天畸形、牙周疾病、开颅手术等各种原因导致的骨缺损十分常见,尤其在骨科、口腔科、神经外科等领域的患者较为集中,上述诸原因造成的大范围骨缺损是临床上的一大难题。据统计,我国每年约400万人需要进行植骨治疗[1]。
常见的骨缺损修复方法有自体骨移植、异体骨移植及人工材料等[2]。根据骨移植材料在体内的骨形成特性,理想的植骨移植材料应具有骨生成性、骨诱导性、骨引导性[3]。单纯的人工骨材料仅能作为骨引导的支架,缺乏诱导成骨能力,成骨速度慢,效果欠佳,需加入有骨诱导性或骨生成性的移植材料。组织工程学意在将生物材料、细胞以及生物活性分子结合起来,恢复或改善受损或病变组织的生物功能[4]。传统的骨组织工程是通过将种子细胞接种在支架材料上植入骨缺损处进行修复,但存在种子细胞凋亡、引发免疫炎性反应等缺陷,这将削弱修复效果[5]。人工骨替代材料也具有各自的优势和缺点,磷酸钙陶瓷与骨有着相似的化学组成,但其溶解性影响破骨细胞的活性[6],高分子聚合物具有生物活性但机械强度低[7]。异体骨移植存在发生免疫反应、成骨活性差、可能传播疾病等问题。同种异体骨则可能有效避免异体移植材料的危害,继而成为当前骨移植材料的重要研究方向。本研究通过动物模型,研究同种异体骨修补骨缺损效果,利用X线观察实验动物术后骨的生长愈合情况,借助组织病理学观察评估该移植材料修补骨缺损的有效性,通过与对照组、空白对照组进行比较,为临床应用提供实验数据,以期丰富骨缺损修复的移植材料。
1 材料和方法
1.1 材料
1.1.1实验动物:成年普通级新西兰兔,60只,体质量2.2 kg以上,雄性,购自北京富豪实验动物养殖中心,实验动物生产许可证号【SCXK(京)2019-0015】,饲养于首都医科大学实验动物部,实验动物使用许可证号【SYXK(京)2018-0003】,实验动物质量控制及饲养环境均符合国家相关标准规定[8-9]。60只动物随机分成3组,分别为实验组、对照组和空白对照组,每组均20只。对于所有实验组,分别在手术后的第1、4、8和12周时取5只动物,称体质量、抽血检测血常规指标及生理生化指标。本实验项目经首都医科大学实验动物福利伦理委员会审查批准,伦理审批号为:AEEI-2022-083。
1.1.2试剂与仪器:同种异体骨(批号:TZG-S1-211124。型号规格:松质骨小块,DG-SZGXK,0.5 g;皮质骨粒,DG-PZGL-3,0.5 g),由北京桀亚莱福生物技术有限责任公司提供,干燥避光密闭保存,供试品在每次使用前用适量无菌0.9%氯化钠溶液调和,并在2~3 h内使用完毕。对照品:市售同种骨植入材料。主要仪器:BC-5150全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司),日立7000型全自动生化分析仪(日立高科技贸易上海有限公司),Strong 204精密微型研磨机(世新精密中国分社)。
1.2 方法
1.2.1动物模型制备方法:将兔称重,全麻(麻醉剂:舒泰+速眠新,使用剂量分别为:舒泰0.03 mL/(kg·bw),速眠新0.1 mL/(kg·bw),保定,取侧卧位,备皮(半径约3 cm),碘酊消毒,铺无菌巾。避开皮下血管,切开皮肤、皮下组织及筋膜,切口为2.0 cm,分离肌群,暴露股骨外侧面。在股骨近心端之外缘、大转子下缘1 cm处,用直径4 mm球头精密研磨机制备骨缺损,深度以不打穿髓腔、目视隐约可见红色骨髓为度(防止骨髓腔开放后暴露的髓内干细胞自愈合能力的干扰),此时,骨缺损深度约为1 mm,骨缺损体积约为5.24 mm3。制造骨缺损时予以0.9%冲洗降温。同样的方法处理对侧股骨。在实验组和对照组每只兔的左股骨缺损区填充皮质骨粒,右股骨缺损区填充松质骨小块,轻压填紧,尽量使材料与孔密合,分层缝合。空白组动物进行上述同样手术,不填充任何材料。术后对动物肌注青霉素钠溶液3 d,剂量为每天80万单位/只,肌注对乙酰氨基酚注射液3 d,剂量为2.5 mg/(kg·bw)。
1.2.2影像学检查:在术后1、4、8和12周时进行X线检测骨缺损区。对各组缺损愈合情况进行评估和影像学评价。
1.2.3病理检查:包括尸体大体检验和器官组织切片的显微观察检验。
1.2.3.1 尸体检查:由病理专业人员对研究期间死亡或者被处死的所有动物的尸体进行检验。
1.2.3.2 组织病理学检查:对每组的5只动物行安乐死,切取骨缺损区组织作为标本,10%甲醛常温固定,标本常规脱钙、脱水、包埋后行HE染色,分析材料植入后降解、缺损部位的骨形成情况,成骨细胞、炎性细胞浸润情况等。
1.3 统计学分析
实验数据使用IBM SPSS Statistics 22软件对数据进行统计。统计方法为方差分析或双样本独立t检验,确定各组实验结果差异的比较是否有统计学意义。
2 结果
2.1 影像学观察结果
术后1周X线检查结果显示,空白对照组骨缺损明显。实验组与对照组影像学结果高度相似,左右侧骨缺损明显,因分别在骨缺损处植入皮质骨粒和松质骨,故缺损处仍显示较大密度,与空白对照组显著不同(图1)。

注:L:左侧;R:右侧。Note: L:left; R:right.
术后4周,空白对照组,骨缺损较1周时变浅,但仍清晰可见。实验组骨修复情况与空白对照组差别不太明显,缺损区可见低密度骨痂,缺损断端仍较为明显。对照组骨修复情况亦类似于实验组,左右侧差别同样不明显(图2)。

注:L:左侧;R:右侧Note: L:left; R:right.
术后8周时,实验组动物骨修复较4周时有显著变化,骨痂影密度较高,和正常骨质差别不太大,个别可见断端。在缺损区周围尚可见散落填充物颗粒。左右侧骨恢复情况区别不明显。对照组可见缺损,缺损区内可见与正常皮质骨密度不同影像,缺损区周围仍可见散落之填充物颗粒。上述两组动物骨修复速度优于空白对照组动物(图3)。
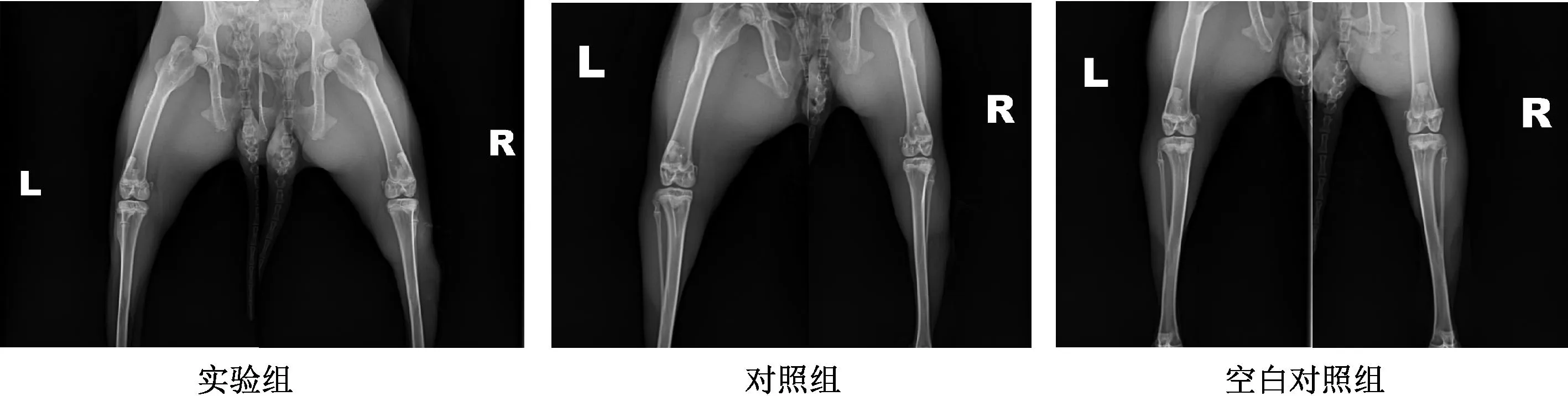
注:L:左侧;R:右侧。Note: L:left; R:right.
至术后12周,实验组动物骨损愈合较佳,骨密质修复完整,图像显示骨损区显影密度与周围皮质骨相同。实验组动物样本左右侧骨愈合情况差别不明显。对照组右侧骨愈合情况优于左侧骨,与实验组恢复速度相似。空白对照组动物骨损修复情况差于前面两组动物,个别样本股骨尚能看到轻度缺损(图4)。
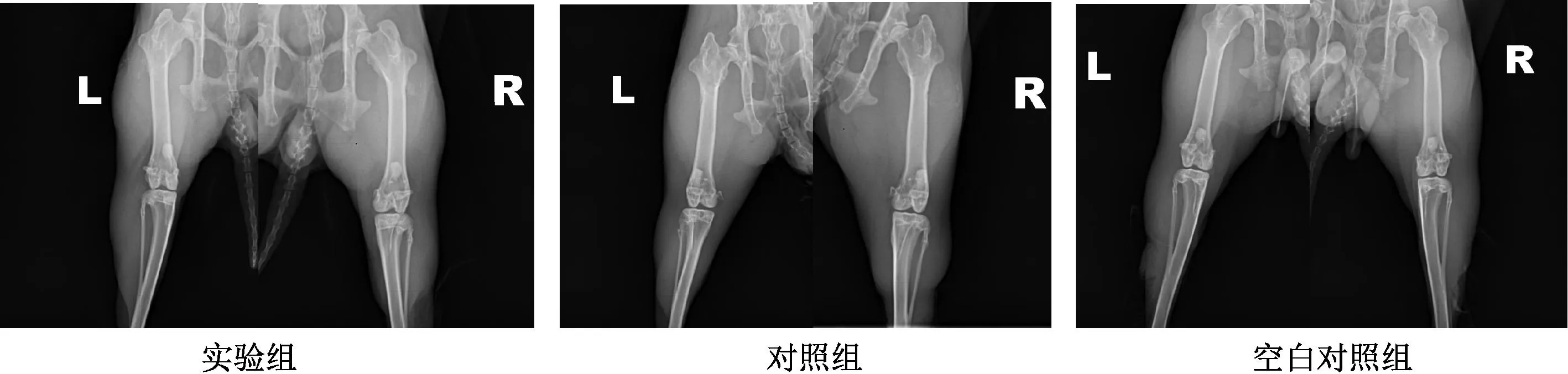
注:L:左侧;R:右侧Note: L:left; R:right.
2.2 组织病理学结果
术后1周,解剖取材时肉眼可见,供试品植入物和对照品植入物与原有骨组织尚未有效结合,在取材过程中均可轻易脱离创面,在周围肌肉组织内,部分动物样本可见少量散落填充物。3组动物的组织学观察结果相似,创面残留菲薄骨质,表面有残留造模时所致坏死组织及炎性渗出,炎症不明显(图5)。

图5 术后1周实验组、对照组及空白对照组骨组织切片(HE,×100)Fig.5 Bone section of experimental group, control group and blank control group 1 week after operation(HE,×100)
术后4周,剖检时在实验组和对照组可见植入物与骨组织结合较为紧密,手术区无炎性症状。组织学结果显示,实验组骨缺损区尚无成型之新生骨组织,可见不连续骨小梁,小梁周边有大量成骨细胞,同时可见脂肪细胞、新生血管及纤维结缔组织。对照组情况相似。空白对照组与前面两组相比,成骨细胞数量、小梁量均偏少。3组动物骨损区内均未见明显组织坏死和炎性细胞浸润(图6)。

图6 术后4周实验组、对照组及空白对照组骨组织切片(HE,×100)Fig.6 Bone section of experimental group, control group and blank control group 4 week after operation(HE,×100)
至术后8周,实验组动物样本中,供试品吸收较好。显微镜下观察骨小梁更加粗大、密集,但排列尚不规则,新生骨表面成骨细胞密集排列,成骨性肉芽组织浸润,周边有较为丰富的毛细血管。对照组与此相似。空白对照组与实验组相比,骨小梁略纤细,成骨性肉芽组织偏少(图7)。

图7 术后8周实验组、对照组及空白对照组骨组织切片(HE,×100)Fig.7 Bone section of experimental group, control group and blank control group 8 week after operation(HE,×100)
术后12周,各组动物新生骨大量形成。相较于空白对照组,实验组动物样本的新生骨组织内出现类似骨髓组织。骨小梁的连续性更好,排列更加规则,表面形成致密骨板(图8)。
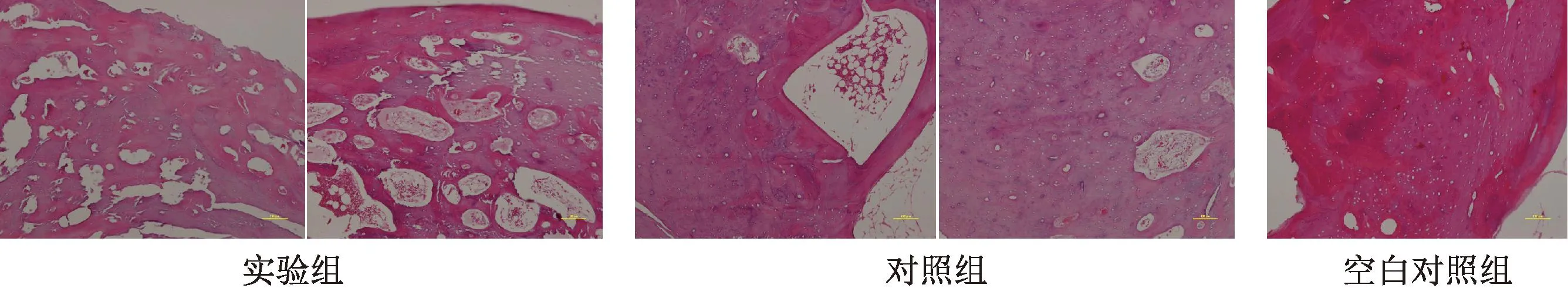
图8 术后12周实验组、对照组及空白对照组骨组织切片(HE,×100)Fig.8 Bone section of experimental group, control group and blank control group 12 week after operation(HE,×100)
3 讨论
本实验以成年雄性兔为实验材料,制作骨缺损疾病模型,填充皮质骨粒或松质骨小块以探究骨修复效果。结果表明:动物使用供试品,较使用同类市售产品和不使用填充材料者,生长状态良好,骨组织修复速度快,愈合效果好。
骨的愈合一般需经历纤维性骨痂、骨性骨痂及骨痂改建等过程[10]。从实验结果可以看出,供试品用于实验动物兔后,经过12周的生长恢复,骨损区结构基本符合正常骨组织的组织结构特点,皮质致密,排列规律[11]。病理学观察结果表明,供试品能够刺激间充质细胞分化为成骨细胞,促进成骨细胞产生骨胶纤维和有机骨基质,加速钙盐的沉积,推进骨细胞的形成及骨痂成熟,具备理想的植骨材料应兼具骨生成性、骨诱导性及骨引导性之特征,是较为有效的骨移植材料。本研究为增加临床上骨缺损修复过程中的移植材料奠定了实验基础,对植骨材料库的丰富及扩容提供了研究支撑,但该受试材料的生物力学特性及其他生物学性能,尚需进一步研究探讨。
