多成像模式对淋巴瘤荷瘤鼠化疗疗效的评估*
2024-01-10李田田陈祉悦施青青淼2
李田田 陈祉悦 施青青 孙 幸 朱 淼2,
(1.扬州大学临床医学院超声科,扬州 225001)(2.扬州大学医学院,扬州 225001)(3.扬州大学临床医学院血液科,扬州 225001)
随着肿瘤研究进展,肿瘤动物模型的建立与研究是临床研究的基础,合适的动物模型对研究肿瘤形成机制,肿瘤生物学特性,肿瘤早期影像表现都有着重要意义,其中荷瘤小鼠模型相关研究多见。研究者实验目的多样,对模型小鼠影像需求逐渐提升,成像手段也呈多样化,目前较为多见的有超声(ultrasound,US)、磁共振(magnetic resonance Imaging,MRI)及可见光活体成像三种,但尚未有研究将多种成像模式总结对比分析,本研究旨在利用三种常规成像方法,尝试对淋巴瘤荷瘤鼠模型进行治疗前后评估,归纳各模式成像方法优势,为动物小鼠实验总结方法与经验。
1 材料和方法
1.1 材料
复苏鼠源性淋巴瘤细胞38B9(由扬州大学非编码RNA实验室郁多男教授惠赠),将细胞培养于含10%胎牛血清(Gibco)的RPMI-1640(Hyclone)中,待细胞稳定传代后,向2×105个/mL细胞中加入4 μL聚凝胺polybrene和10 μL空载体病毒(Genechem)充分混匀,37 ℃,2 000 r/m,离心2 h转染,继续培养3 d,随后加嘌呤霉素1 μg/mL筛选,荧光显微镜下观察,待细胞稳定表达红色荧光,继续扩增细胞。
1.2 方法
1.2.1动物模型建立与干预:清洁级8周龄雌性BALB/c小鼠适应性饲养一周,小鼠体质量20~25 g,购自扬州大学比较医学中心,实验动物生产许可证号【SCXK(苏)2022-0009】。将带荧光的38B9细胞扩增,于小鼠右侧颈肩背部皮下注射细胞悬液(2×106个/0.2 mL)荷瘤,10 d后可见注射处毛发倒立,有瘤状突起,予以US、MRI、可见光活体成像评估小鼠后。干预组予以环磷酰胺(Cyclophosphamide,CTX)腹腔注射(每天40 mg/kg)治疗3 d,对照组同时予等量0.9%氯化钠溶液腹腔注射,一周后再次予以3种成像方式评估两组小鼠。小鼠全部检测完毕后统一安乐死,取瘤体称重并予以病理检查,小鼠瘤体积计算:长轴×短轴2/2。实验已通过扬州大学临床医学院医院福利伦理委员会审查,伦理审批号:2022ky113-1。
1.2.2动物模型影像评估
1.2.2.1MRI扫描前准备:小鼠予吸入异氟烷麻醉,彻底麻醉后将其放置于Rat-Coil-12鼠用线圈内,使用联影公司uMRI 790 3.0T磁共振仪器。T2WI参数:TR 4019 ms,TE 107.2 ms,激发翻转角90度,回聚翻转角140度,平均次数2次,层数15 mm,层厚2.5 mm,间距0 mm,FOV 200×200 mm,读出分辨率384,相位分辨率80。
1.2.2.2可见光活体成像扫描前准备:小鼠成像前用75%乙醇给小鼠擦拭全身,必要时予以脱毛膏脱毛,排除特异性荧光,随后予小鼠吸入异氟烷麻醉,将小鼠放入成像仪中(Perkin Elmer活体成像仪),关灯,在580 nm(激发波长),650 nm(接受波长)条件下,摄片拍照,应用image proplus 6.0软件处理图像。
1.2.2.3US扫描前准备:二维超声,小鼠予吸入异氟烷麻醉,彻底麻醉后采用GE Logiq E9超声诊断仪,在MSK Gen模式下,通过频率为5~12 MHz的高频线阵探头,由2名工作经验3年以上的超声科医师对小鼠瘤体进行扫查,二维灰阶超声找寻至病灶最大切面,随后切换为超声造影模式。造影检查时,需助手与操作者默契配合,助手溶解六氟化硫微泡(SonoVue,BRACCO)于配套5 mL氯化钠中,充分振荡后尾静脉注射混悬液50 μL,将小鼠迅速转移至操作者处进行造影检查,造影参数:甲状腺造影设置,机械指数调节至0.13,造影总增益设置为70%,深度2.5 cm,单点聚焦置于图像最深部。通过超声诊断仪绘制信号-时间曲线,由两名医师测算3次,取平均值,主要研究参数:达峰强度(peak intensity,PI)、上升时间(rise time,RT) 。
2 结果
2.1 淋巴瘤荷瘤鼠模型建立
荷瘤后10 d可见小鼠注射处瘤状突起,MRI、US及可见光活体成像提示对应部位瘤体形成,肿瘤剖面呈鱼肉状,瘤体组织石蜡包埋后制作成病理切片,经HE染色后可见大量大小均一的淋巴瘤细胞分布,提示模型建立成功,CTX干预后瘤体病理提示肿瘤细胞固缩坏死,肿瘤血管分布减少。
2.2 干预前后荷瘤鼠MRI表现
成瘤时MRI提示小鼠圆形或类圆形病灶,T2WI呈高信号,肿瘤境界清晰,瘤体周边显像佳,较之于未干预组,MRI提示小鼠干预后瘤体明显缩小,各小鼠均未见明显远处转移图像,MRI测算肿瘤大小与大体标本相仿。
2.3 干预前后荷瘤鼠可见光活体成像表现
模型小鼠干预后,瘤体范围缩小,瘤体部位荧光面积缩小,瘤体荧光最强点荧光强度下降,各鼠未见转移图像。
2.4 干预前后荷瘤鼠US表现
成瘤时US提示小鼠颈肩背部低回声包块,干预后包块缩小,在超声造影(contrast-enhanced ultrasound,CEUS)检测中,瘤体呈弥漫性高增强,整体呈快进慢出,干预后时间强度曲线中PI有显著下降,RT时间延长(表1)。
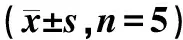
表1 模型鼠瘤体积及血管灌注参数变化Table 1 Changes in tumor volume and vascular perfusion parameters in model
3 讨论
小鼠在病理学、生物学等方面与人类相似,是实验研究肿瘤疾病常用的动物模型。随着实验方法的更新,小鼠造模由简单的皮下细胞系移植模型,逐渐过渡到了复杂的个性化异种移植模型。为了研究肿瘤发生发展中的不同临床表现,设计严谨的实验配合合适的模型鼠是目前研究所必须的。而不管是证明荷瘤成功率,还是研究药物对肿瘤功能的影响,影像学检查始终贯穿模型鼠各实验阶段,选择合适的影像学检查可以提高动物在实验中的使用效率,节省时间并获得有意义的实验数据[1]。
本实验室选取操作简单,可多次重复,成功率高的皮下移植瘤模型进行实验,所选取的MRI、可见光活体成像、US三种均为无创成像模式,可以反复多次成像,非常适合于研究肿瘤干预前后同体对比研究。在MRI中T1WI与周围肌肉组织信号差异不大,选择成像效果佳的T2WI,可以清晰观察肿瘤内部情况及显示肿瘤边界,对肿瘤周边脏器有极佳的显示作用[2]。MRI有较好的组织及空间分辨率,通过MRI可以精确评估肿瘤大小变化,对肿瘤动态随访评估,是研究肿瘤治疗药物体内实验的良好的评价方式[3],本实验也证明了MRI可以精确测量淋巴瘤荷瘤小鼠干预前后肿瘤体积。目前开发了许多靶向响应的纳米探针,与相关的生物标志物结合,极大地促进和加速癌症机制研究与药物研发,对肿瘤预后与治疗的评估均具有重要意义,诊疗一体化的探针设计,在诊断时即可兼顾治疗,也是未来MRI临床研究与发展的趋势[4]。
可见光活体成像是基于生物发光或荧光的成像方式,对肿瘤转移显像有无可比拟的优势,有早期、无创、实时、动态的优势[5],生物发光利用荧光素酶催化底物发光成像,而本实验使用了慢病毒介导的RNA干扰技术,将含有红色荧光素酶的基因插入至淋巴瘤细胞的染色体内,随后通过嘌呤霉素筛选培养出稳定表达红色荧光的细胞株。但该方法需要经过多轮压力筛选才能获得理想荧光强度细胞株,消耗时间成本与精力成本较大,另外,虽然荧光信号强于生物发光,但非特异性荧光产生的背景噪音较大,成像效果不如生物发光[6],本实验给小鼠脱毛,酒精擦拭鼠身尽可能降低背景噪声影响,小鼠脸部及生殖器部位仍存在非特异性荧光。由于本实验选取的皮下移植瘤模型转移率低,远处转移有限,不能准确模拟正常人体肿瘤发生发展的过程[7],可见光活体成像显示结构信息能力不如MRI及US,但其可以提供MRI及US不具备的分子影像信息,对微小转移灶检测灵敏度高。随着技术的进展,可见光活体成像已经可借由360°水平旋转的动物承载台和多次更新的算法实现3 D断层扫描及重建,集成功性能光学成像与结构性CT成像两大功能,实现多模式成像与影像融合的检查。
超声在临床检查中有着方便、快捷、经济且灵敏度较高的优势,但在移植瘤模型影像评估中较少选择,超声成像效果受小鼠毛发、组织中空气的影响较大[8]。超声功能成像用造影剂来增加组织中声阻抗的差异性,对解剖血流信息有更进一步的阅读,可明确显示组织血流灌注变化。在肿瘤发生发展中,新生血管起到了非常重要的作用,如果没有新生血管供应营养,肿瘤扩增至107细胞左右将不再增大[9]。本研究中,CTX干预后CEUS测量肿瘤血管参数有明显下降,结合病理证明了CTX对淋巴瘤细胞有显著的抑制作用,并且减少了肿瘤部位的新生血管,也提示了CEUS可以精确的评估模型鼠肿瘤大小及血流灌注情况。在临床或者科研中将CEUS与其他成像手段整合在一起来提高成像准确性,这可能是医学成像发展的一种趋势。CEUS除了对新生血管有较佳的成像能力,目前也可以被用于动物肿瘤淋巴结转移的诊断,同时超声造影剂也可作为药物的理想载体,可以通过超声辐照进行靶向药物传递[10-11]。
MRI、可见光活体成像、US三种成像模式均有着成像效果佳,肿瘤部位显像灵敏度高,无创可重复等特点。MRI可精确测量肿瘤大小及观察肿瘤周边情况,可见光活体成像能够直观评估肿瘤转移情况,CEUS优势在明确肿瘤血流灌注情况,多成像模式结合较佳的协同评估作用。本研究中小鼠麻醉后呼吸频率增大,MRI成像中运动伪影较重,CEUS中尾静脉注射小鼠疼痛难以耐受,影响成像结果,且荷瘤小鼠样本量小,以上问题还需要进一步完善。
根据正确的科学问题选择合适的小鼠模型,可降低研究成本,在3Rs(替代、减少和优化)框架内提高动物在实验中的使用效率。同时也能获得更具有临床指导意义的实验数据。
