巨大口蘑与双孢蘑菇原生质体融合育种*
2024-01-08闫亚敏梁大伟马建伟刘欣芊肖裕玲高锦运薛建邦莫美华
闫亚敏,梁大伟,马建伟,刘欣芊,肖裕玲,高锦运,田 怡,薛建邦,莫美华
(华南农业大学食品学院,广东 广州 510642)
原生质体融合是生物工程育种的一项重要技术,该技术可以去除细胞壁的屏障,实现远缘杂交,集双亲优良遗传性状于一体,并定向筛选表现双亲优良遗传性状的融合子,遗传信息传递量大,操作方便,适用性强[1-3]。近年来食用菌原生质体融合技术在理论和应用上都取得了很大进展,国内许多研究者通过试验已经获得了食用菌种内、种间、属间,甚至科间原生质体融合子,并结合分子生物学技术就食用菌育种进行了大量的研究,取得了令人瞩目的进展[4-9]。通过原生质体融合技术,可以改善食用菌品质,提高产量,增强抗性,对食用菌的良种选育具有深刻意义[10-11]。
双孢蘑菇(Agaricus bisporus) 具有清热解毒、消炎润肺等多种保健功能,是目前世界上人工栽培最广泛、产量最高、消费量最大的食用菌,产量约占世界食用菌总产量的40%[12-13]。巨大口蘑(Macrocybe gigantea) 是一种口感鲜美、营养丰富、产量高的珍稀食用菌,具有防癌抗癌、抗氧化、抑制高血压、抑制细菌、抑制真菌、抑制艾滋病病毒、提高免疫力等多种功效[14-19]。而且货架期长,在贮藏运输中不易褐变和腐烂,8~12 ℃条件下保存30 d 不变色、不变味,适合鲜销和加工,有很好的开发价值和应用前景。但实际生产中发现其生长速度慢、栽培周期长,该缺点严重制约了产业化与规模化的发展[20-22]。为了解决巨大口蘑生长速度慢、栽培周期长、较难均衡供应市场的难题,选育生长速度快、栽培周期短的巨大口蘑新菌株显得尤为重要。
将优质、耐贮藏的巨大口蘑和高产、适应性强的双孢蘑菇作为亲本菌株,进行原生质体融合育种,建立巨大口蘑与双孢蘑菇原生质体制备、融合及再生的优化体系,以得到具有新的生理特性的融合菌株。
1 材料与方法
1.1 供试菌株
巨大口蘑菌株,华南农业大学食品学院应用真菌实验室保藏;双孢蘑菇2796,购于广东省微生物研究所。
1.2 试验培养基
PDA 培养基:马铃薯20%、葡萄糖2%、MgSO40.05%、KH2PO40.15%、琼脂2%。
再生培养基:马铃薯20%、葡萄糖2%、MgSO40.05%、KH2PO40.2%、VB10.001%、蛋白胨0.3%、琼脂2%、0.6 mol·L-1甘露醇1 L,pH 7.0。
液体培养基:马铃薯20%、葡萄糖2%。
栽培料配方:棉籽壳30%、蔗渣60%、麸皮8%、石灰1%、轻质碳酸钙0.2%、MgSO40.1%、KH2PO40.2%、酵母粉0.5%,pH 6.0~7.0。
1.3 试验方法
1.3.1 菌丝体制备
在巨大口蘑的PDA 培养基上用打孔器(直径为1.2 cm) 取2~3 块菌丝体最前端生长旺盛的菌丝块,接种于160 mL 液体培养基中,30 ℃、160 r·min-1条件下培养7~10 d,得到菌丝球。将菌丝球转移到160 mL 液体培养基中,30 ℃静置培养4 d 以上,无菌条件下挑取菌丝体,无菌滤纸吸干水分,得到巨大口蘑菌丝体。双孢蘑菇菌丝培养温度为26 ℃,其他方法同上。
1.3.2 原生质体制备
使用一定量的渗透压稳定剂(0.6 mol·L-1KCl 与0.6 mol·L-1的甘露醇以1 ∶1 复配) 将收集到的菌丝反复洗涤2~3 次。按照每0.3~0.5 克菌丝加入1 mL 酶液的比例,巨大口蘑采用5%纤维素酶和5%蜗牛酶作为混合酶系,在31 ℃条件下,酶解4.5 h;双孢蘑菇采用7.6%纤维素酶和4%蜗牛酶作为混合酶系,在32 ℃条件下,酶解2.2 h。酶解完毕后,滤液低速离心弃上清液收集沉淀,用渗透压稳定剂洗涤2 次,并加入与酶液等体积的渗透压稳定剂重悬原生质体,测定巨大口蘑和双孢蘑菇原生质体的释放量。
1.3.3 原生质体灭活
将巨大口蘑和双孢蘑菇的原生质体的量调整到1×106个/mL。巨大口蘑原生质体使用紫外灭活:15 W 紫外灯,于25 cm 处照射18 min。双孢蘑菇原生质体使用热灭活:56 ℃水浴,热灭活30 min。均达到100%灭活。
1.3.4 原生质体的融合条件研究
使用分子量为6 000 的聚乙二醇(PEG) 为融合剂,研究PEG 浓度、融合时间和温度对原生质体融合的影响。初始条件为30 ℃融合20 min,再以前一步筛选结果作为后一步试验条件,分别逐步设置PEG 质量分数为10%、20%、30%、40%、50%;融合时间为5、10、15、20、25、30 min;融合温度为20、25、30、35、40 ℃。
1.3.5 原生质体的融合与再生
分别将0.5 mL 纯化灭活的巨大口蘑和双孢蘑菇原生质体悬液按照体积比1 ∶1 混合,30 ℃条件预热5 min 后加入一定浓度的PEG 1 mL,迅速置于30 ℃水浴中,按照设定时间取样,3 000 r·min-1离心15 min,弃去上清液,加入渗透压稳定剂洗涤2 次去除PEG,得到原生质体融合物。取0.1 mL 原生质体融合物涂布于再生培养基上,26 ℃避光培养10~20 d,定期观察融合子的生长情况并计算融合率。融合率(R,%) 的计算公式为[23]:
式中:N 为融合子的再生菌落数(个);P 为双亲原生质体数(个)。
1.3.6 融合菌株的鉴定
融合菌株和亲本菌株在PDA 培养基上进行培养,观察、记录菌落形态。采用插片法培养,待菌丝长满盖玻片后用乳酸石炭酸染色,于16×40 倍显微镜下观察、记录菌丝形态。根据融合子形态特征、拮抗试验结果和菌丝生长速度进行初步鉴定,经过鉴定之后,选取与母种具有明显形态差异、发生拮抗反应且具有锁状联合的菌株,进行出菇试验,记录、比较其出菇时间和商品性状。
2 结果与分析
2.1 巨大口蘑和双孢蘑菇原生质体的制备
在前期研究的基础上[24],巨大口蘑和双孢蘑菇分别以菌龄5 d 和4 d 的菌丝体作为材料,经过纤维素酶和蜗牛酶混合酶解后,巨大口蘑原生质体的释放量为7.5×106个/mL,双孢蘑菇原生质体的释放量为9.9×106个/mL,制备得到的双孢蘑菇和巨大口蘑的原生质体如图1 所示。

图1 巨大口蘑(A) 和双孢蘑菇(B) 的原生质体(10×)Fig.1 Macrocybe gigantea (A) and Agaricus bisporus (B) protoplasts (10×)
2.2 PEG 浓度对原生质体融合的影响
PEG 浓度是影响原生质体融合的关键因素,研究表明分子量为4 000~6 000 的PEG 对原生质体的融合效果较好[25]。将分子量为6 000 的PEG 作为融合剂,不同PEG 质量分数下巨大口蘑和双孢蘑菇的原生质体融合率见图2。
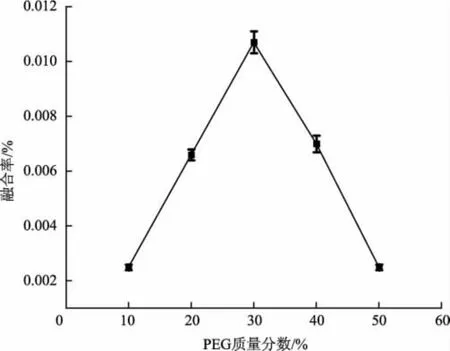
图2 PEG 浓度对巨大口蘑和双孢蘑菇原生质体融合的影响Fig.2 Effect of PEG concentration on protoplast fusion between Macrocybe gigantea and Agaricus bisporus
由图2 可知,当PEG 质量分数为30%时,巨大口蘑与双孢蘑菇原生质体的融合率达到最高,为0.010 7%,在此基础上PEG 的浓度再增大或者减小,融合率都开始下降。这是因为低浓度的PEG 会使原生质体破裂而失去稳定性,浓度过高则会导致原生质体失水收缩,从而融合率降低,且高浓度的PEG 还有一定的毒性。因此巨大口蘑和双孢蘑菇原生质体融合的最佳PEG(分子量为6 000) 的质量分数为30%,可观察到出现2 个或2 个以上原生质体融合现象,见图3。

图3 PEG 质量分数为30%时融合子电镜图(100×)Fig.3 Electron micrograph of fusion at 30% PEG mass fraction (100×)
2.3 融合时间对原生质体融合的影响
不同融合时间下巨大口蘑和双孢蘑菇的原生质体融合率见图4。
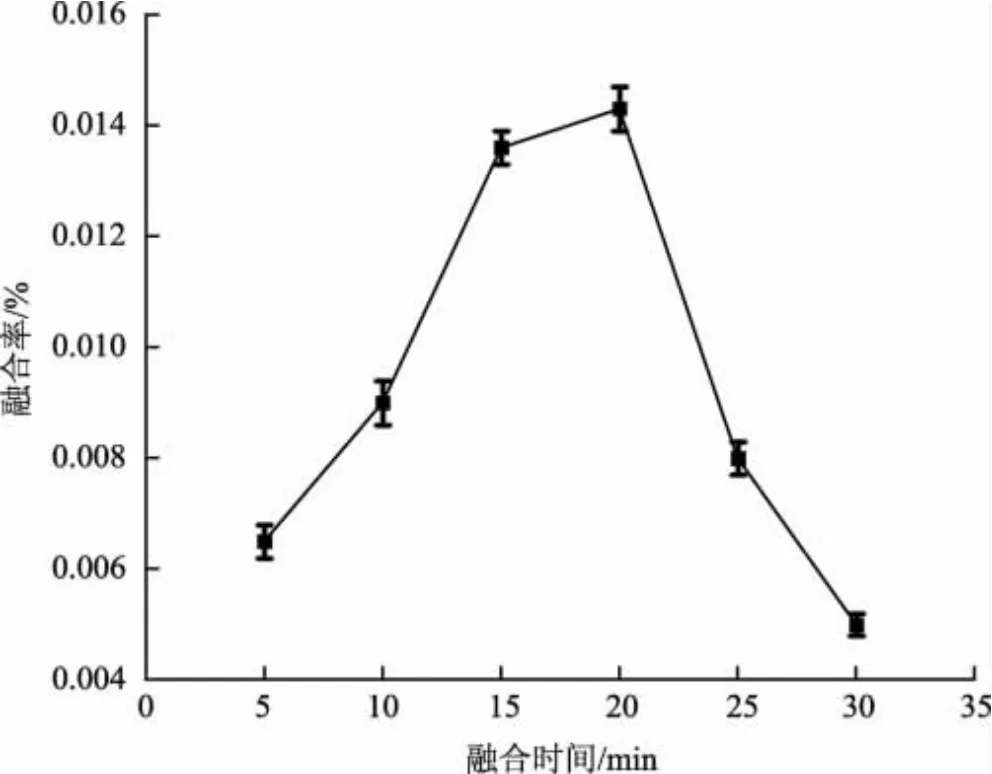
图4 融合时间对巨大口蘑与双孢蘑菇原生质体融合的影响Fig.4 Effect of fusion time on protoplast fusion between Macrocybe gigantea and Agaricus bisporus
由图4 可知,当融合时间为20 min 时,巨大口蘑与双孢蘑菇原生质体融合率最高,为0.013 6%。融合时间过长或者过短都会使融合率下降,这是因为融合时间过短,原生质体没有充分的融合;融合时间过长,可能使已经形成的原生质体桥断裂,融合率和再生率都降低。因此,巨大口蘑与双孢蘑菇原生质体融合的最佳时间为20 min。
2.4 融合温度对原生质体融合的影响
不同融合温度下巨大口蘑和双孢蘑菇的原生质体融合率见图5。

图5 融合温度对巨大口蘑与双孢蘑菇原生质体融合的影响Fig.5 Effect of fusion temperature on protoplast fusion between Macrocybe gigantea and Agaricus bisporus
由图5 可知,当温度从20 ℃升高到30 ℃时,巨大口蘑与双孢蘑菇原生质体融合率一直处于上升的趋势,说明融合过程中适当提高温度能促进原生质的融合,温度高于30 ℃时融合率开始下降。考虑到低温原生质体的活性低,而高温又对原生质体有一定的损伤,因此,巨大口蘑与双孢蘑菇原生质体融合时温度应以30 ℃为宜。
2.5 融合子的再生
在pH 为8.5、PEG 质量分数为30%、融合时间为20 min、融合温度为30 ℃、三羟甲基氨基甲烷(Tris)浓度为0.016 mol·L-1、CaCl2的浓度为0.014 mol·L-1的条件下,巨大口蘑与双孢蘑菇原生质体的融合率为0.038 7%,显微镜观察下的融合子见图6。
如图6 所示,挑选出14 个融合子进行再生培养,从中筛选出有利于稳定传代培养的7 个融合菌株进行下一步培养鉴定试验。
2.6 融合菌株的鉴定
2.6.1 菌落特征观察
对2 个亲本菌株和筛选出的7 个融合菌株进行培养,菌落特征见图7。

图7 7 个融合菌株与2 个亲本菌株的菌落形态Fig.7 Colony morphology of 7 fusion strains and 2 parent strains
由图7 可知,亲本巨大口蘑的菌丝洁白且粗壮,菌落边缘较整齐,表面平坦、光滑,呈绒毛状;而双孢蘑菇的菌丝细密,菌落边缘不规整,呈菌束状并且疏松。融合菌株的菌落形态介于2 个亲本之间,菌株H49、H99、H100 菌丝形态接近巨大口蘑,菌丝致密、粗壮,表面呈绒毛状,贴合培养基生长;而菌株612、41、710、75 的菌丝形态接近双孢蘑菇,菌丝细密,呈菌束状并且疏松,菌落边缘大多不整齐。
2.6.2 拮抗试验结果
7 个融合菌株分别与2 个亲本菌株进行拮抗试验,结果见图8。

图8 融合菌株与亲本菌株的拮抗试验结果Fig.8 Results of antagonism test between fusion strains and parent strains
如图8 所示,7 个融合菌株均与亲本菌株形成明显的拮抗线。其中融合菌株H49、H99、H100 与亲本巨大口蘑发生强烈的拮抗反应,菌丝接触位置形成明显隆起的拮抗线,并且通过菌落形态可以观察出与巨大口蘑的同源性较大。融合菌株612、41、710、75 与亲本双孢蘑菇的拮抗线明显,并且通过菌落形态可以观察出与双孢蘑菇的同源性较大。
2.6.3 菌丝形态观察
对菌丝形态进行观察,具有锁状联合的4 个融合菌株和2 个亲本菌株的菌丝形态见图9。

图9 4 个融合菌株与2 个亲本菌株的菌丝显微图片(16×40)Fig.9 Mycelial micrograph of 4 fusion strains and 2 parent strain (16×40)
由图9 可知,亲本巨大口蘑的菌丝较细,有锁状联合体。亲本双孢蘑菇菌丝较巨大口蘑菌丝粗,没有锁状联合体,横隔膜较明显。融合菌株H99 锁状联合较多,菌丝细密,而融合菌株H49、H100、612 菌丝有较少锁状联合,菌丝宽度介于巨大口蘑与双孢蘑菇之间。融合菌株41、710、75 的菌丝无锁状联合,且结合前期菌落特征观察和拮抗试验结果,表明融合菌株41、710、75 与双孢蘑菇较为接近,因此后续不再进行研究。
2.6.4 母种的菌丝生长速度
筛选出的4 个融合菌株与2 个亲本菌株的母种生长情况见表1。

表1 4 个融合菌株与2 个亲本菌株的母种菌丝生长情况比较Tab.1 Comparison of the mycelial growth of stock culture between 4 fusion strains and 2 parent strains
由表1 可知,各菌株菌丝生长速度显著快于亲本巨大口蘑(P<0.05)。在相同的培养条件下,亲本双孢蘑菇的菌丝生长速度较快,巨大口蘑的菌丝生长速度较慢。融合菌株H49、H99、H100 菌丝生长速度与双孢蘑菇相比较慢,但显著快于巨大口蘑菌丝生长速度,且菌丝长势浓密,形态接近巨大口蘑。融合菌株612 的生长速度显著快于双孢蘑菇,且菌丝形态接近于双孢蘑菇,因此后续没有进行进一步研究。
2.6.5 栽培种的菌丝生长速度
对筛选出的融合菌株H49、H99、H100 与亲本巨大口蘑开展进一步的比较试验,记录从接种到不同培养时间段栽培种的平均菌丝生长速度,结果见表2。

表2 融合菌株与亲本巨大口蘑栽培种的菌丝生长速度比较Tab.2 Comparison of spawn mycelial growth rates between fusion strains and parent Macrocybe gigantea
由表2 可知,3 个融合菌株的栽培种菌丝生长速度显著快于亲本巨大口蘑(P<0.05)。并且在试验过程中发现,接种后培养7 d,融合菌株即可明显观察到菌丝生长,而亲本巨大口蘑的菌丝生长不明显,说明融合菌株的菌丝活性明显优于亲本巨大口蘑。
2.6.6 出菇试验
对3 个融合菌株与亲本巨大口蘑进行出菇试验,结果见表3 和图10。

表3 3 个融合菌株与亲本菌株巨大口蘑出菇时间比较Tab.3 Comparison of fruiting time between 3 fusion strains and parent Macrocybe gigantea

图10 3 个融合菌株与亲本菌株巨大口蘑出菇图Fig.10 Fruiting of parental strain Macrocybe gigantea and 3 fusion strains
由表3 和图10 可知,在相同的培养条件下,融合菌株的出菇时间明显短于母本菌株巨大口蘑。栽培试验中,融合菌株在温度和湿度都随天气改变的条件下也能正常出菇,只是出菇量相对减少,表现出明显的抗逆性,进一步说明融合菌株具有与母本优势互补的优良性状。融合菌株与母本菌株相比菌柄更加粗壮,朵形优美,菇形整齐,长势较好。
3 结论与讨论
食用菌原生质体融合根据诱导因子不同,分为化学融合、物理融合和生物融合三大类,目前PEG诱导的化学融合应用最为广泛,影响原生质体PEG融合的因素主要有PEG 的浓度、融合时间、融合温度等[26]。PEG 诱导原生质体融合机制主要是通过氢键和原生质体的结合水结合,引起膜结构的改变,导致原生质体失水,引起原生质体凝集作用,发生原生质体融合。分子量为4 000~10 000 的PEG 均能诱导原生质体的全融合,小分子量的PEG 较大分子量的PEG 处理的融合率低,而大分子量的PEG 处理则易出现多核融合。在食用菌原生质体融合过程中,质量分数为25%~45%的PEG 处理可获得较高的原生质体融合率,与本试验中得到的PEG(分子量为6 000) 质量分数为30%时融合率高的结果相符[27-30]。融合时间和融合温度都会对原生质体的融合率产生影响,融合时间过长PEG 对原生质体的毒性增加,融合温度直接影响原生质体的流动和活性。本试验中筛选的融合时间为20 min,融合温度为30 ℃,与前人的研究基本相符。最终在pH 8.5、Tris 浓度为0.016 mol·L-1、Ca2+浓度为0.014 mol·L-1条件下,融合率达0.038 7%,建立了巨大口蘑与双孢蘑菇原生质体PEG 融合体系。
融合子的验证可以从多个方面进行,本试验从形态学特征、拮抗试验结果、菌丝生长速度和出菇试验多个角度和层次,确切地表明了融合菌株是不同于亲本的新菌株。形态学是菌种鉴定的基础,形态的差异表明菌株的生理代谢存在差异;通过拮抗线说明融合菌株和亲本菌株之间存在排异现象;再通过母种和栽培种生长速度的测定更确切地验证了融合菌株是不同于亲本的新菌株,比亲本菌株具有更多优势;最后应用出菇试验进一步证明了融合是成功的,实现了科间融合成功。试验中虽然获得了多株融合菌株,但是没有对类似于双孢蘑菇的菌株进行进一步研究。
本试验中选育出的稳产、栽培周期较短的巨大口蘑融合新菌株,为食用菌的生产提供了可稳定扩繁的优良杂交菌系,这对巨大口蘑品种的更新换代和在原生质体水平上成功开展巨大口蘑杂交育种提供了范例,可为巨大口蘑育种、栽培提供一定的指导。
