子痫前期患者胎盘组织中抑微管装配蛋白1表达对滋养层细胞的影响及其机制
2024-01-05欧曼颖胡春霞李跃萍
欧曼颖, 胡春霞, 李跃萍,2
(1. 海南医学院第一附属医院产科,海南 海口 570100; 2. 海南医学院组织学与胚胎学教研室,海南 海口 570100)
子痫前期(pre-eclampsia,PE)是一种妊娠期特有的疾病,以妊娠20 周后出现高血压和蛋白尿为主要特征[1]。胎盘作为维持胎儿生长发育的重要器官,不仅为胎儿提供营养,还可合成并分泌多种激素、酶、神经递质和细胞因子等物质促进胚胎的发育。研究[2-3]显示:PE 是胎盘源性疾病,终止妊娠并娩出胎盘是治疗病情持续进展患者的唯一有效措施。因此,进一步了解胎盘功能障碍的分子机制对PE 的防治具有重要意义。“两阶段”模型是描述PE 病因和发病机制的理论假说,该模型认为滋养层细胞是胎盘中最重要的功能细胞,其入侵不足是导致胎盘发育异常的主要原因[4]。上皮-间质转化(epithelial-mesenchymal transition, EMT) 在调控细胞迁移和侵袭中起重要作用,其标志是E-钙黏蛋白 (E-cadherin) 和 N- 钙黏蛋白(N-cadherin)等非上皮钙黏蛋白的表达变化和再平衡[5]。妊娠期间,EMT 的异常调节可导致滋养层细胞侵袭不足和胎盘血管重铸异常,并会进一步诱导PE 的产生和胎儿生长受限等情况发生[6]。
抑微管装配蛋白1(stathmin 1,STMN1) 是由位于人类1 号染色体上STMN1 基因编码的蛋白分子。STMN1 是一种重要的胞质磷酸蛋白,可通过阻滞微管蛋白的聚合和增加微管的突变促进微管去稳态,并参与调节微管的动力学[7]。STMN1 广泛参与多种肿瘤细胞的分化、增殖、侵袭和迁移,如细胞中STMN1 功能障碍可导致微管的重组装和细胞周期的紊乱,从而诱导细胞的癌变和肿瘤形成[8]。研究[9-10]显示:STMN1 在啮齿动物和人类胎盘组织中的表达水平较高,而STMN1 表达的降低可能通过抑制滋养层细胞的增殖和侵袭功能参与复发性流产的发生。但在PE 患者中,STMN1 在胎盘组织中的表达及其相关作用机制尚未完全阐明。因此,本研究探讨STMN1 在正常妊娠者与PE 患者胎盘组织中的表达差异,并阐明其对滋养细胞功能的影响及其机制。
1 材料与方法
1.1 一般资料选取2020 年10 月—2022 年6 月于海南医学院第一附属医院产科采集并保存的17 名健康妊娠孕产妇(对照组)和15例PE患者(PE 组)的胎盘组织。纳入标准:①PE 的诊断标准参考第9 版《妇产科学》[11]的诊疗标准;②2 组研究对象均为自然单胎受孕,未并发胎盘早剥和前置胎盘等妊娠并发症,且无早产、宫内死胎和胎儿染色体异常等不良分娩史;③2 组研究对象均经阴道分娩,且孕期未使用避孕药、免疫调节剂或其他激素类药物,临床资料完整。排除标准:①研究对象年龄<20 岁或>35 岁;②并发原发性高血压、肝肾疾病、心脏疾病、糖尿病、甲状腺疾病和自身免疫性疾病者;③患者或家属拒绝签署知情同意告知书者。本研究经海南医学院第一附属医院伦理委员会审批,伦理审批号:K202009-12。
1.2 细胞、主要试剂和仪器人滋养层细胞系HTR-8/SVneo(HTR-8) 购自中国科学院上海细胞库。RPMI-1640 培养基、胎牛血清(fetal bovine serum, FBS)和Lipofectamine 2000 转染试剂(美国Invitrogen 公司),沉默STMN1 的小干扰RNA(small interfering RNA, siRNA) (siRNASTMN1)、 阴性对照序列 (siRNA-NC) 和STMN1 的过表达质粒(pcDNA3.1-STMN1) 及阴性对照序列(pcDNA3.1-NC)(上海吉玛制药技术有限公司),TRIzol 试剂和BCA 蛋白定量试剂盒(美国Life Technologies 公司),逆转录试剂盒SYBR Premix Ex Taq 和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒SYBR Premix Ex Taq (日本TaKaRa 公司),基质胶(美国BD 公司),大鼠抗STMN1 、E-cadherin 和 N-cadherin 抗体(美国Abcam 公司),CCK-8 试剂盒(美国Sigma 公司),大鼠抗GAPDH 抗体、辣根过氧化物酶标记的兔抗大鼠免疫球蛋白G (immunoglobulin G,IgG) 抗体和RIPA 裂解缓冲液(上海碧云天生物技术有限公司), 免疫组织化学(immunohistochemistry,IHC)染色试剂盒(美国Cell Signaling Technology公司),RT-qPCR 引物[生工生物工程(上海)股份有限公司]。光学显微镜(Axio 型,德国ZEISS公司),超净工作台(美国Thermo 公司)。
1.3 HTR-8 细胞转染和分组采用含10%FBS 的RPMI-1640 完全培养基于37 ℃、5%CO2的培养箱中培养HTR-8 细胞。按照Lipofectamine 2000 转染试剂使用说明书方法将 siRNA-STMN1 和pcDNA3.1-STMN1 及其阴性对照序列siRNA-NC和pcDNA3.1-NC 转染入细胞中。将HTR-8 细胞分为 siRNA-STMN1 组 (转染 siRNA-STMN1)、siRNA-NC 组(转染阴性对照序列siRNA-NC)、pcDNA3.1-STMN1 组(转染pcDNA3.1-STMN1)和 pcDNA3.1-NC 组 (转染阴性对照序列pcDNA3.1-NC)。
1.4 IHC 染色法观察2 组研究对象胎盘组织中STMN1 和EMT 相关蛋白表达强度将胎盘组织样本于4% 甲醛溶液固定24 h,石蜡包埋并切片后,经二甲苯脱蜡,梯度乙醇水化,高压下置于pH 值为9.0 的Tris-EDTA 缓冲液中进行抗原修复,3%过氧化氢溶液阻断内源性过氧化物酶,5%山羊血清进行抗体封闭后,加入STMN1(1∶100)、N-cadherin (1∶300) 和E-cadherin (1∶300) 抗体,4 ℃下孵育过夜,充分洗涤后,加入生物素标记的二抗(1∶500),室温下孵育2 h,DAB 染色,苏木精复染后,再次进行梯度酒精脱水和二甲苯透明,中性树胶封片后倒置显微镜观察并拍照,观察STMN1 和EMT 相关蛋白表达强度。
1.5 CCK-8 法检测各组HTR-8 细胞增殖率取各组HTR-8 细胞,按每孔2×103个细胞的密度接种于96 孔细胞培养板中,加入CCK-8 试剂,接种0、24、48 和72 h 后于酶标仪450 nm 波长处检测各孔吸光度(A)值,以各组细胞接种0 h 时A 值为对照组A 值,计算细胞增殖率。细胞增殖率=(实验组A 值—对照组A 值)/对照组A 值×100%。每组每个时间点设置5 个复孔。实验单独重复3 次。
1.6 细胞划痕实验检测各组HTR-8 细胞迁移率将各组HTR-8 细胞按每孔1×106个细胞的密度接种于6 孔细胞培养板中,使用完全培养基培养细胞,待细胞生长融合至95%时,采用200 μL 无菌移液器枪头垂直于培养板底部划出间隔为1 cm 的平行线,刮除线内细胞,拍照,计为0 h 划痕宽度(W0)。改用无血清培养基进行培养24 h 后,再次拍照,作为24 h 的划痕宽度(W24)。采用Image J 软件分析,计算各组细胞迁移率。细胞迁移率= (W0—W24)/W0×100%。实验单独重复3 次。
1.7 Transwell 小室实验检测各组HTR-8 细胞侵袭能力取各组HTR-8 细胞,按每孔2×105个细胞的密度接种于预先包被BD 基质胶的Transwell小室(孔径为8 μm)中,并加入200 μL 的无血清培养基,下室为600 μL 含10% FBS 的完全培养基,于37 ℃、5% CO2培养箱中孵育24 h 后,采用4%多聚甲醛溶液在室温下固定进入下室的细胞30 min,0.1%结晶紫溶液在室温下染色20 min 后,倒置显微镜下每组随机选取5 个视野进行拍照,并计数进入下室的细胞数量,以侵袭细胞数代表细胞侵袭能力。实验单独重复3 次。
1.8 RT-qPCR 法检测2 组研究对象和各组HTR-8细胞中STMN1 mRNA 表达水平采用TRIzol 试剂提取2 组研究对象胎盘组织和各组HTR-8 细胞中总RNA。 根据试剂盒说明书方法采用SYBR PreMix Ex Taq 试剂盒将RNA 反向转录为cDNA,采用SYBR PreMix Ex TaqTM Ⅱ试剂盒进行RT-qPCR反应。引物序列:STMN1上游引物5′-AGAACCGAGAGGCACAAATG-3′, STMN1 下游引 物 5′-AGTCAGCAGGGTCTTTGGATT-3′;GAPDH 上游引物5′-AGAAGGTGGTGAAGCAGGCGTC-3′,GAPDH 下游引物 5′-AAAGGTGGAGGAGTGGGTGTCG3′,以GAPDH 为内参,采用2—∆∆Ct法计算2 组研究对象胎盘组织和各组HTR-8 细胞中STMN1 mRNA 表达水平。
1.9 Western blotting 检测2 组研究对象和各组HTR-8 细胞中STMN1、E-cadherin 和N-cadherin蛋白表达水平采用RIPA 裂解缓冲液提取2 组研究对象胎盘组织和各组HTR-8 细胞总蛋白,BCA试剂盒检测蛋白浓度。取约30 μg 等量蛋白样品于10% SDS-PAGE 凝胶中电泳分离,将蛋白条带转移至PVDF 膜上,5%脱脂奶粉在室温下封闭抗体2 h 后,4 ℃下加入一抗:STMN1 (1∶500)、E-cadherin (1∶800)、 N-cadherin (1∶800) 和GADPH(1∶1 000),4 ℃下孵育过夜,然后加入辣根过氧化物酶标记的二抗(1∶2 000),室温下孵育2 h,最后加入ECL 试剂盒在凝胶成像系统中显示蛋白条带。以GAPDH为内参,采用FusionCapt Advance Fx5 软件采集图像,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。实验单独重复3 次。
1.10 统计学分析采用GraphPad Prism 7.0 统计软件进行统计学分析。2 组研究对象胎盘组织中STMN1 mRNA 和蛋白表达水平、各组HTR-8 细胞中STMN1 mRNA 和蛋白表达水平、细胞增殖率、细胞迁移率、侵袭细胞数和细胞中E-cadherin和N-cadherin 蛋白表达水平均符合正态分布,以xˉ±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用Dunnett’s 事后检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 2 组研究对象一般资料与对照组比较,PE 组患者收缩压、舒张压和尿蛋白水平均明显升高(P<0.01),新生儿体质量增加(P<0.05)。见表1。
表1 2 组研究对象一般资料Tab. 1 General data of subjects in two groups(±s)

表1 2 组研究对象一般资料Tab. 1 General data of subjects in two groups(±s)
*P<0.05,**P<0.01 vs control group.
?
2.2 2 组研究对象胎盘组织中STMN1 和EMT 相关蛋白表达强度与对照组比较,PE 组患者胎盘绒毛组织中 STMN1 蛋白表达强度增大,E-cadherin 蛋白表达强度增大,N-cadherin 蛋白表达强度减小。见图1 和2。
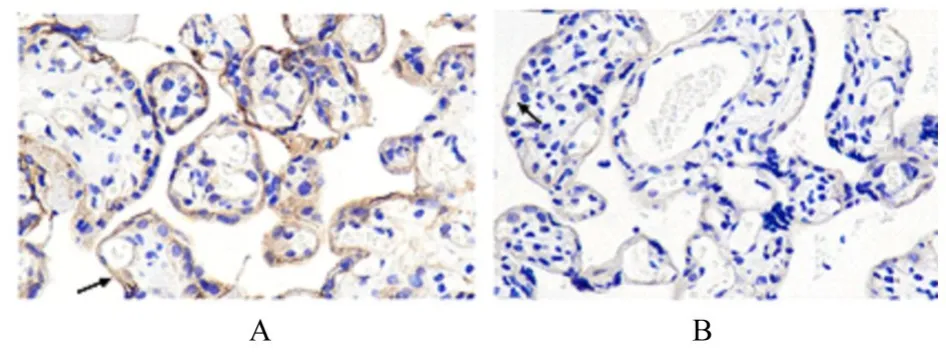
图1 IHC 染色观察2 组研究对象胎盘组织中STMN1 蛋白表达强度(×400)Fig. 1 Expression intensities of STMN1 protein in placenta tissue of subjects in two groups observed by IHC staining (×400)
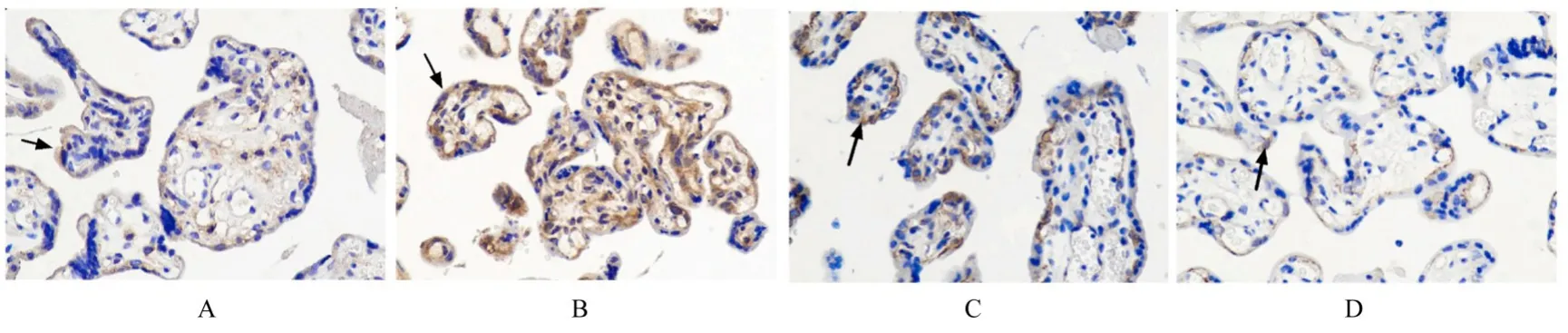
图2 IHC 染色观察2 组研究对象胎盘组织中E-cadherin 和N-cadherin 蛋白表达情况(×400)Fig. 2 Expressions of E-cadherin and N-cadherin proteins in placenta tissue of subjects in two groups observed by IHC staining (×400)
2.3 各组HTR-8 细胞增殖率与siRNA-NC 组比较,接种48 和72 h 时,siRNA-STMN1 组HTR-8细胞增殖率降低(P<0.05)。与pcDNA3.1-NC 组比较,接种48 和72 h 时,pcDNA3.1-STMN1 组HTR-8 细胞增殖率升高(P<0.05)。见图3。
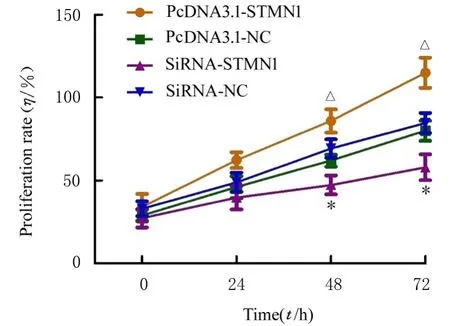
图3 CCK-8 法检测各组HTR-8 细胞增殖率Fig. 3 Proliferation rates of HTR-8 cells in various groups detected by CCK-8 method
2.4 各组HTR-8 细胞迁移率与siRNA-NC 组(22.23%±7.41%) 比 较, siRNA-STMN1 组HTR-8 细胞迁移率(10.05%±4.82%)降低(P<0.05)。与pcDNA3.1-NC组(24.07%±6.68%)比较, pcDNA3.1-STMN1 组HTR-8 细胞迁移率(38.88%±11.59%)升高(P<0.05)。见图4。
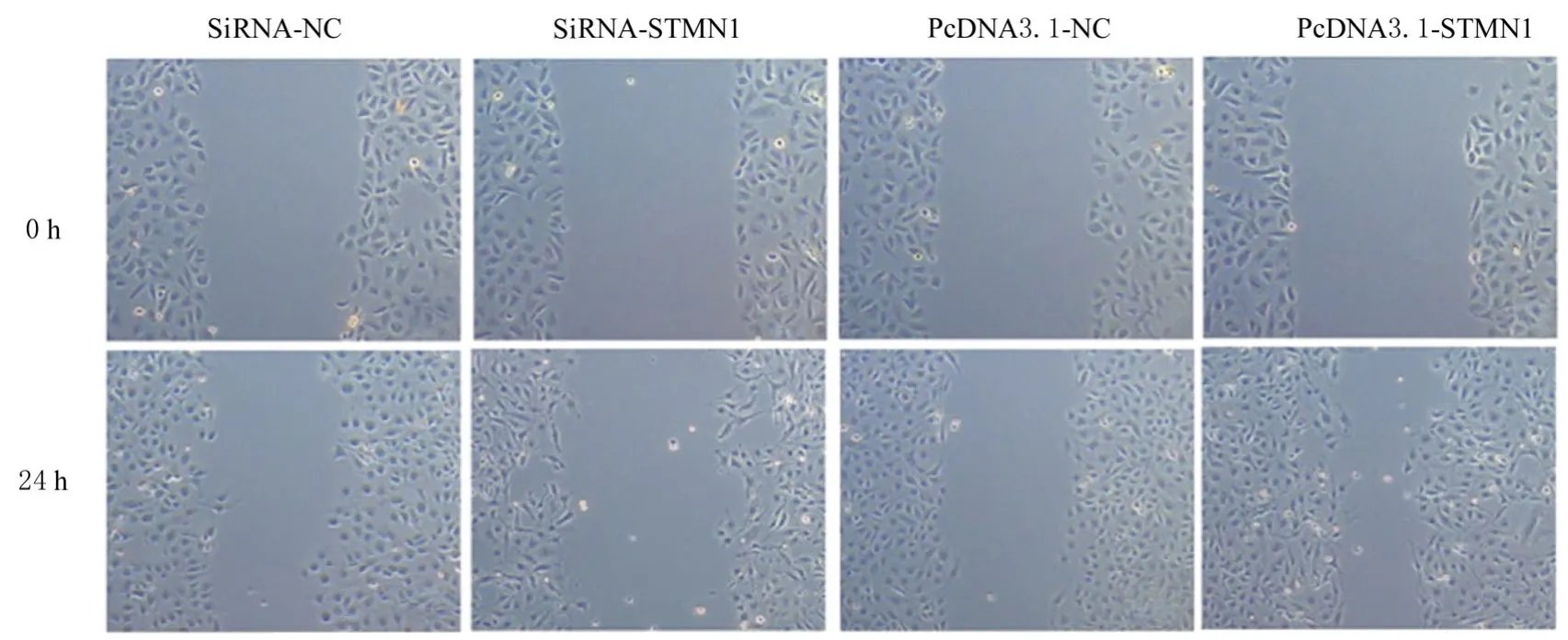
图4 细胞划痕实验检测各组HTR-8 细胞迁移能力(×100)Fig. 4 Migration abilities of HTR-8 cells in various groups observed by cell scratch healing assay(×100)
2.5 各组HTR-8细胞侵袭细胞数与siRNA-NC组(98.67 个±21.11 个)比较,siRNA-STMN1 组侵袭细胞数(45.00 个±17.90 个) 明显减少(P<0.01)。与pcDNA3.1-NC组(109.35个±26.75 个)比 较, pcDNA3.1-STMN1 组 侵 袭 细 胞 数(244.00 个±32.33 个) 明显增加(P<0.01)。见图5。
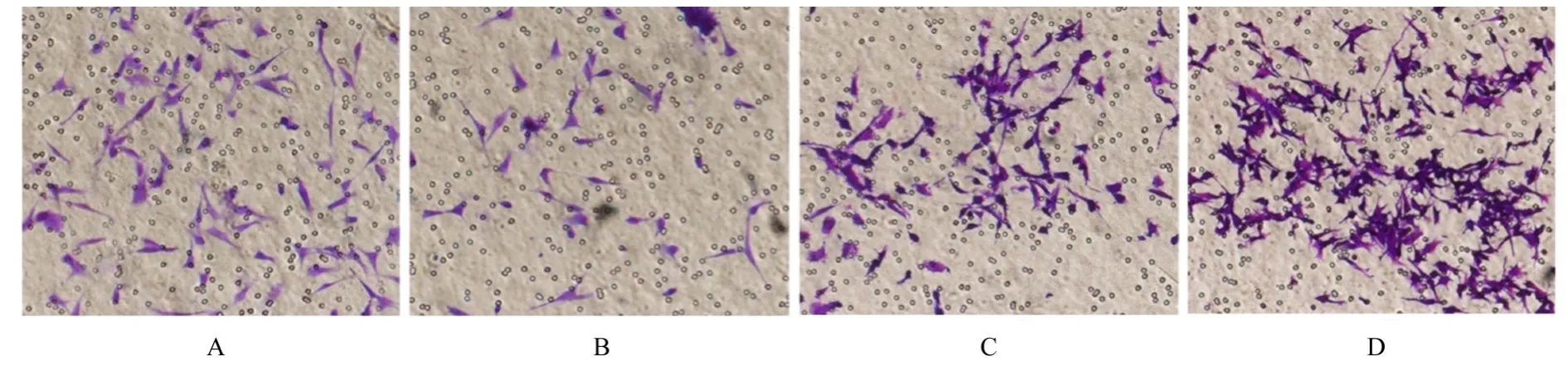
图5 Transwell 小室实验检测各组HTR-8 细胞侵袭能力(结晶紫,×200)Fig. 5 Invasion abilities of HTR-8 cells in various groups detected by Transwell chamber experiment (Crystal violet,×200)
2.6 2 组研究对象胎盘组织和各组HTR-8 细胞中STMN1 mRNA 表达水平与对照组(1.03±0.09) 比较, PE 组患者胎盘组织中STMN1 mRNA 表达水平 (0.33±0.14) 降低(P<0.05)。与siRNA-NC 组比较,siRNA-STMN1 组HTR-8 细胞中STMN1 mRNA 表达水平明显降低(P<0.01)。与pcDNA3.1-NC 组比较,pcDNA3.1-STMN1 组HTR8 细胞中STMN1 mRNA 表达水平明显升高(P<0.01)。siRNA-NC 组和pcDNA3.1-NC 组HTR-8 细胞中STMN1 mRNA 表达水平比较差异无统计学意义(P>0.05)。见图6。
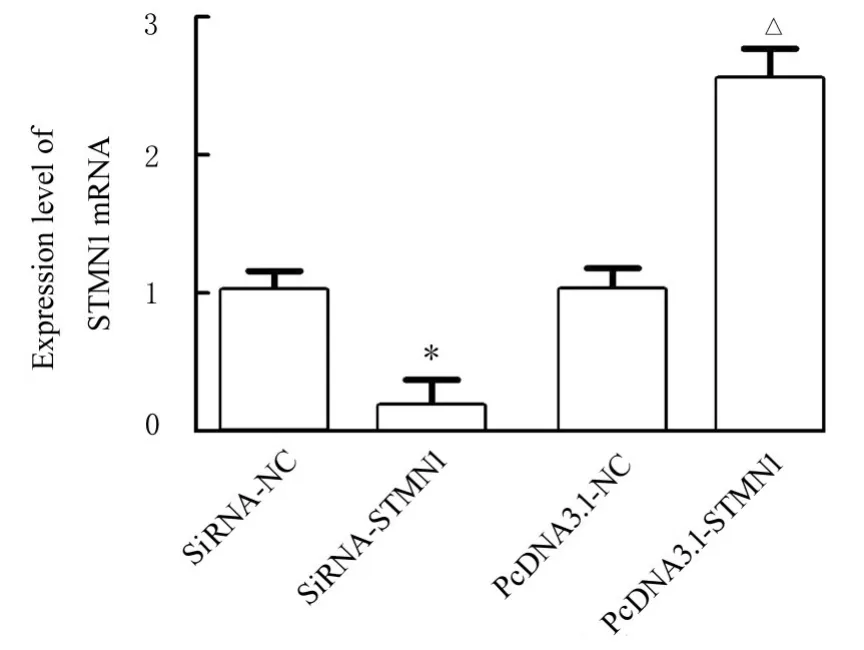
图6 RT-qPCR 法检测各组HTR-8 细胞中STMN1 mRNA 表达水平Fig. 6 Expression levels of STMN1 mRNA in HTR-8 cells in various groups detected by RT-qPCR method
2.7 2 组研究对象胎盘组织和各组HTR-8 细胞中STMN1、E-cadherin 和N-cadherin 蛋白表达水平与对照组(0.78±0.12) 比较,PE 组患者胎盘组织中STMN1 蛋白表达水平(0.21±0.09)降低(P<0.05)。 与siRNA-NC 组比较, siRNASTMN1 组 HTR-8 细 胞 中 STMN1 和N-cadherin 蛋白表达水平降低 (P<0.05),E-cadherin 蛋白表达水平升高(P<0.05)。 与pcDNA3.1-NC 组比较,pcDNA3.1-STMN1 组HTR-8 细胞中STMN1 和N-cadherin 蛋白表达水平升高(P<0.05),E-cadherin 蛋白表达水平降低(P<0.05)。见图7 和8。
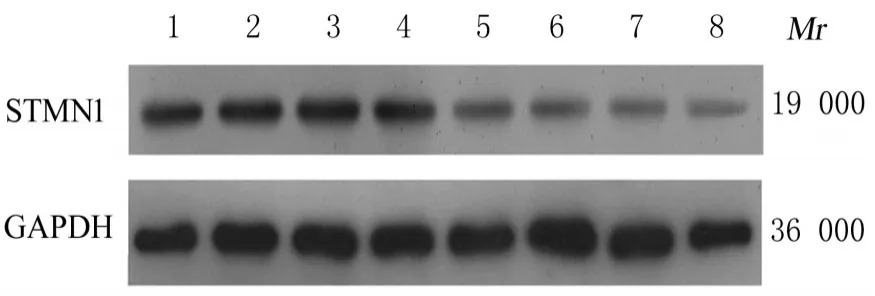
图7 Western blotting 法检测2 组研究对象胎盘组织中STMN1 蛋白表达电泳图Fig. 7 Electrophoregram of expression of STMN1 protein in placenta tissue of patients in two groups detected by Western blotting method
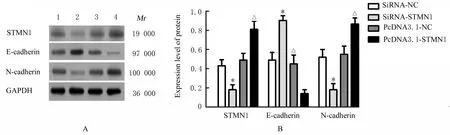
图8 Western blotting 法检测各组HTR-8 细胞中STMN1、E-cadherin 和N-cadherin 蛋白表达电泳图(A)和直条图(B)Fig. 8 Electrophoregram(A) and histogram(B) of expressions of STMN1, E-cadherin, and N-cadherin proteins in HTR-8 cells in various groups detected by Western blotting method
3 讨 论
PE 严重影响母婴健康,是妊娠女性和胎儿死亡的主要原因[1]。而在PE 发生发展的多种因素中,滋养层细胞侵袭功能的不足被认为是PE 发病机制的根本原因[1-2,12]。STMN1 是一种可调节微管动力学的胞质磷酸蛋白,研究[8]显示:STMN1 可广泛参与肿瘤的发生发展,STMN1 在肝癌组织中的表达水平明显高于癌旁正常组织。研究[13]显示:在肝癌HepG2 和SNU-398 细胞中,上调STMN1表达可通过激活Yes 相关蛋白1 信号通路促进细胞增殖和侵袭。在卵巢癌组织中,STMN1 表达呈异常上调,且STMN1 表达水平与患者国际妇产科联合会(Federation International of Gynecology and Obstetrics,FIGO) 分期和肿瘤的分化程度有关。STMN1 还可促进卵巢癌细胞的增殖和迁移,提示STMN1 可能是卵巢癌治疗的生物靶点[14]。本研究结果显示:与对照组比较,PE 组患者胎盘组织中STMN1 表达水平明显降低,且在滋养层细胞中敲低或过表达STMN1 可抑制或促进细胞的增殖和侵袭,提示STMN1 可能通过调节滋养层细胞的EMT 过程中E-cadherin 与N-cadherin 表达参与影响滋养层细胞的迁移和侵袭。
EMT 是胚胎发育与胎盘的形成过程中的关键环节。在EMT 过程中,绒毛滋养细胞进一步分化为绒毛外细胞滋养细胞,并获得细胞迁移和侵袭能力[15-17]。在膀胱癌组织中,STMN1参与了长链非编码RNA (long non-coding RNA, lncRNA) ST6 GALNAC6/微小RNA(micro RNA,miR)-200a-3p轴调控的肿瘤细胞EMT 和转移过程[18]。在间变性甲状腺癌组织中,血液和神经系统表达1(hematological and neurological expressed 1,HN1)蛋白的高表达可通过上调STMN1 mRNA 表达水平,降低α-微管蛋白的乙酰化以促进肿瘤细胞和裸鼠移植瘤的EMT 进程[19]。本研究结果显示:滋养层细胞STMN1 可影响细胞中EMT 特异性标志物E-cadherin 和N-cadherin 的表达,进而调控滋养层细胞的迁移和侵袭。这与上述研究[18-19]结果一致,提示STMN1 可通过参与调控EMT 过程而影响细胞迁移和侵袭。此外,本研究结果显示:PE 患者胎盘组织中STMN1 表达下调与滋养层细胞中E-cadherin 和N-cadherin 表达下调有关联,表明STMN1 通过调节EMT 过程而在细胞迁移和侵袭中发挥重要作用。
然而,关于STMN1 在妊娠早期胎盘形成过程中的作用,GOU 等[20]发现:STMN1 表达在假妊娠中无明显变化,但胚胎着床的激活或蜕膜化的诱导可使其表达明显增加,而沉默STMN1 明显抑制细胞蜕膜化,提示STMN1 可能是参与胚胎植入的潜在调控因子,其可能在细胞蜕膜化中起关键作用。
综上所述,STMN1 可能在调节滋养层侵袭过程中起关键作用,STMN1 可能通过调控细胞的EMT 进程进而参与PE 的发生发展。
