局部脉冲振动刺激对兔前交叉韧带重建后本体感觉恢复的影响
2024-01-05张新强冯会成
张新强, 王 博, 冯会成
(1. 解放军总医院第八医学中心骨科,北京 100091;2. 河北北方学院研究生学院外科,河北 张家口 075051)
前交叉韧带(anterior cruciate ligament,ACL)的主要功能是阻止胫骨前移,并为膝关节提供前向和旋转稳定性。ACL 断裂常见于年轻人和体育爱好者,主要由非接触性减速、跳跃或剪切运动造成损伤,出现患侧膝关节不稳和疼痛等症状,对患者日常生活及运动造成严重影响。ACL 断裂后行ACL 重建(ACL reconstruction,ACLR) 是治疗的首选,ACLR 可提供良好的膝关节稳定性[1]。ACL 损伤的患者如不进行有效处理,其患膝骨性关节炎的可能性是健康者的3~5 倍[2]。尽管ACL的结构可以从根本上重建,但部分患者术后早期感觉膝关节不稳定,这是由于重建的ACL 本体感觉并未恢复[3]。刘晓磊等[4]研究显示:ACL 损伤患者ACLR 术后双下肢的本体感觉和姿势控制能力均降低。ACL 损伤患者术前本体感觉丧失,ACLR术后以本体感觉训练为主的康复方案对膝关节本体感觉和功能状态有显著改善效果[5]。ACLR 术后有效的康复训练对于ACL 损伤患者较为重要,ACLR 术后康复可促进患者的活动水平和膝关节功能恢复至受伤前[6]。张晓宇等[7]发现:ACLR 术后进行早期康复对膝关节功能恢复可能存在优势。陈鹏等[8]认为:全身振动训练可以改善ACLR 术后患者的本体感觉和平衡。目前尚未完全阐明ACLR 术后患者振动刺激治疗的振幅强度、振动频率和作用时间的统一标准。本研究构建ACL 损伤兔模型,使用不同振幅强度、振动频率和作用时间对其进行振动刺激治疗,探讨不同局部脉冲振动刺激治疗条件对ACLR 术后本体感觉恢复的影响,为临床实践提供参考。
1 材料与方法
1.1 实验动物、主要试剂和仪器选取健康新西兰大白兔45 只,雌雄不限,体质量2.0~2.5 kg,动物生产合格证号:SCXK(京)2016-0003,由北京市海淀区兴隆实验动物养殖厂提供,动物使用许可证号:SYXK(军)2012-0016。鼠抗兔 S-100 单克隆抗体、 多聚体抗小鼠免疫球蛋白 G(immunoglobulin G, IgG) - 辣根过氧化物酶(horseradish peroxidase,HRP)试剂盒、内源性过氧化物酶阻断剂、4%多聚甲醛和磷酸盐缓冲液(phosphate buffered saline,PBS)购自武汉博士德生物工程有限公司,HE 染色液购自珠海贝索生物技术有限公司。切片机、脱水机和包埋机购自武汉俊杰电子有限公司,显微镜购自日本奥林巴斯公司,扫描仪购自德国Leica 公司,多功能酶标仪购自美国BioTek 公司,PCR 仪购自美国Applied Biosystems 公司。
1.2 实验动物造模和分组按参照文献[9]的方法,选取15 只兔用于提供同种异体移植肌腱的制备。兔麻醉成功后,将其仰卧位固定于实验台,严格遵守无菌操作,将兔双侧趾长伸肌腱切下,进行脱细胞去除免疫源性后,置于深低温冰箱中逐步降温至-80 ℃保存备用。2 周后将制备好并储存于-80 ℃冰箱中的同种异体移植肌腱解冻,将取出的肌腱置于40 ℃、生理盐水注射液中融化15 min,当肌腱恢复弹性后,置于40 000 U·100 mL-1庆大霉素注射液漂洗5~10 min,再经生理盐水注射液冲洗,肌腱两端分别采用不吸收线编制缝合后,置入生理盐水注射液中备用。
选取30 只兔右膝关节制备ACL 模型,左膝关节不做处理。兔麻醉成功后,膝关节术区备皮消毒铺无菌单,切开膝关节,显露ACL,于韧带上、下止点处切断ACL,分别于胫骨和股骨ACL 附着处钻骨隧道。将同种异体肌腱移植物穿过骨道,于屈膝45°状态下拉紧肌腱移植物,两端缝线固定,查前抽屉实验和Lachman 实验阴性后,重建韧带有效,固定牢靠,缝合切口,敷料包扎。术后每只兔均以单独兔笼喂养,术前和术后每只兔注射抗生素预防感染,切口换药,术后10 d 所有兔伤口均愈合,未发生切口感染或延迟愈合等情况。术后将30 只兔随机分为对照组和9 个振动刺激治疗组(振动刺激治疗1~9 组),每组3 只。对照组兔常规喂养,振动刺激治疗组兔于术后10 d 开始行局部脉冲振动刺激治疗,将局部脉冲振动刺激装置置于兔膝部进行治疗,每2 d 治疗1 次,共治疗12 周。
1.3 正交实验设计振动刺激治疗参数采用“三因素三水平”正交实验设计振动刺激治疗参数,将振幅强度(A)、振动频率(B) 和作用时间(C)作为治疗因素,每个因素设定3 个水平,分别为振幅强度:2、3和4 mm,振动频率:25、35 和45 Hz,作用时间:10、20和30 min。振动刺激治疗1~9 组依据振动刺激治疗参数划分,振动刺激治疗1 组参数为振幅强度4 mm(赋值为3)、振动频率35 Hz(赋值为2)和作用时间30 min(赋值为3),振动刺激参数代码:A3B2C3,振动刺激治疗2~8 组进行参数赋值。见表1 和2。

表1 正交实验设计治疗因素和水平Tab.1 Treatment factors and levels designed by orthogonal experiment

表2 正交实验设计振动刺激治疗参数Tab.2 Vibratory stimulation treatment parameters designed by orthogonal experiment
1.4 ACL 样本采集和处理干预治疗12 周后将30 只兔采用空气栓塞法处死,快速暴露并取材ACL,将切取的1/2 韧带组织置于4%多聚甲醛固定24 h。将另外1/2 韧带采用无RNA 酶的生理盐水洗涤,置入5 mL 冻存管并快速投入液氮中,再放入-80 ℃冰箱中保存备用。
1.5 HE 染色观察各组兔ACL 本体感受器形态表现更换容器中4%多聚甲醛,浸泡2 h。PBS 缓冲液浸泡清洗15 min,3 次。二甲苯脱水透明,石蜡浸蜡,包埋机包埋。冷冻台放置10 min 后取下蜡块。采用切片机切片,厚度为3 μm。石蜡切片脱蜡至水,烘干,苏木素和伊红染色,100%酒精脱水2 s,烘干后中性树胶封片。光学显微镜下观察各组兔ACL 本体感受器形态表现并拍照。
1.6 S100 免疫组织化学染色观察各组兔ACL 本体感受器分型兔ACL 样本切片常规脱蜡至水。将内源性过氧化物酶阻断剂滴加于组织上,室温孵育10 min,双蒸水清洗灭活。滴加 5% BSA 封闭液,37 ℃孵育30 min。甩去多余液体,不洗涤。一抗孵育4 ℃过夜。取出后 37 ℃复温30 min,PBS 缓冲液洗涤3 次,每次5 min。滴加聚合 HRP 抗兔/小鼠IgG,37 ℃孵育30 min。PBS 缓冲液洗涤3 次,每次5 min。滴加DAB 显色液显色,显微镜下观察并控制反应时间。水洗后复染,滴加苏木素, 室温孵育1 min,PBS 缓冲液清洗,碱性溶液返蓝,中性树胶封片。显微镜下观察并拍照。
1.7 计数各组兔ACL 本体感受器细胞数采用参考文献[10]中ACL 本体感受器分型方法,光学微镜下观察各组兔ACL 本体感受器HE 染色切片和S100 免疫组织化学染色切片,于ACL 胫骨和股骨端分别取2 张切片,中间取1 张切片,分别记录S100 免疫组织化学染色切片中类Ruffini 小体数、类Pacinian 小体数和类Golgi 腱器官数,计算各组兔ACL 本体感受器细胞数。由3 名相关专业知识人员经过培训后进行计数,取平均值。ACL 本体感受器细胞数=类Ruffini 小体数+类Pacinian 小体数+类Golgi 腱器官数。
1.8 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测各组兔ACL 组织中生长相关蛋白43(growth associated protein-43,GAP-43)mRNA 表达水平提取各组兔ACL 组织中总RNA,反转录为cDNA 后进行RT-qPCR 法检测。引物序列见表3。反应条件:95 ℃预变性2 min,95 ℃变性15 s,63 ℃退火30 s,60 ℃延伸30 s,共40 个循环。以GAPDH 为内参,采用2-△△Ct法计算各组兔ACL 组织中GAP-43 mRNA 表达水平。
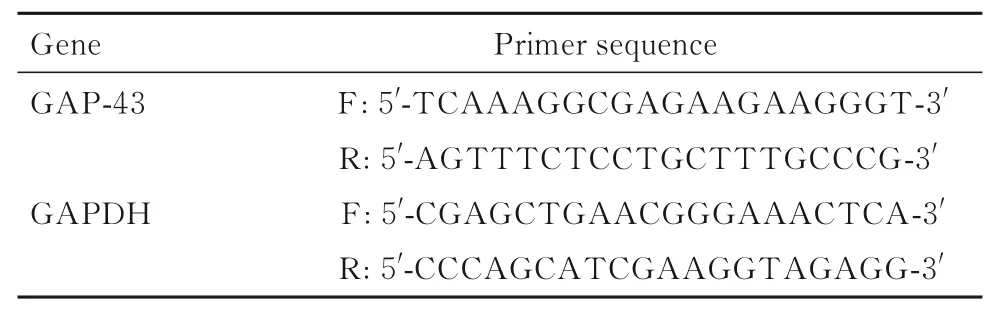
表3 PCR 引物序列Tab.3 Primer sequences of PCR
1.9 正交分析法筛选ACLR 术后康复振动刺激治疗最优参数计算振动刺激治疗1~9 组兔ACL 本体感受器细胞数和GAP-43 mRNA 表达水平的平均值,建立正交分析表,计算K 值和R 值,判定振幅强度、振动频率和作用时间3 个影响因素的顺序和相应因素的最优参数。K 值为相应因素三水平对应的各组兔ACL 本体感受器细胞数和GAP43 mRNA表达水平的平均值,R 值为相应因素中K 值的极差。K1:振幅强度2 mm、振动频率25 Hz 和作用时间10 min;K2:振幅强度3 mm、振动频率35 Hz 和作用时间20 min;K3:振幅强度4 mm、振动频率45 Hz 和作用时间30 min。同组中K 值越大,相应参数下该指标的治疗效果越好;R 值越大,相应因素对该指标的影响越大。根据无空白列有重复正交实验进行方差分析,F 值越大,则相应因素对实验结果的影响越大。
1.10 统计学分析采用 SPSS 26.0 统计软件进行统计学分析。各组兔ACL 本体感受器细胞数和ACL 组织中GAP-43 mRNA 表达水平均呈正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 ACL 模型鉴定兔模型中可见移植物张力尚可,无松弛状态,前抽屉实验和Lachman 实验结果均为阴性。治疗后取ACL 组织,可见移植物连续性存在,与胫骨和股骨腱骨愈合。见图1 和2。
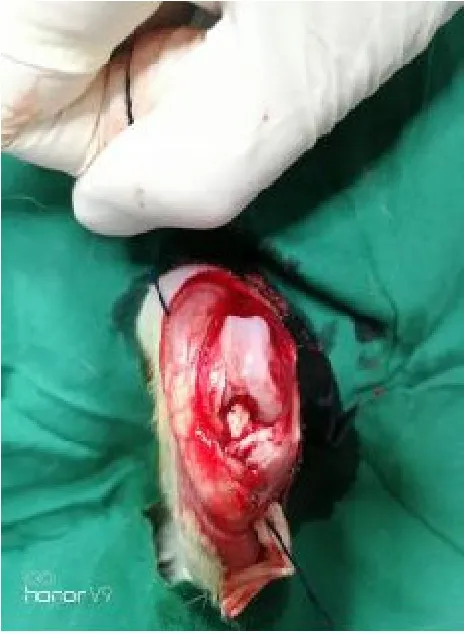
图1 移植的ACL 组织Fig. 1 Transplanted ACL tissue
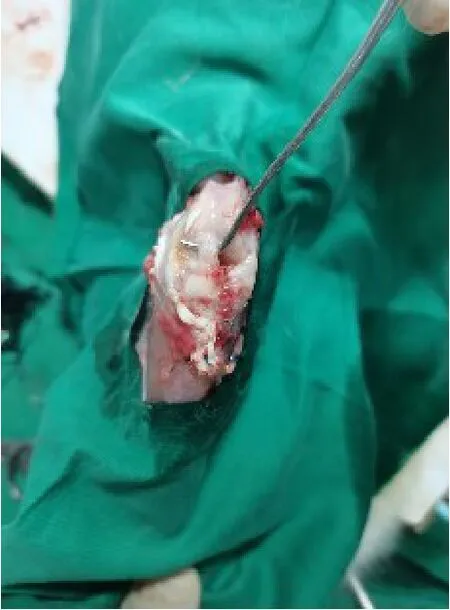
图2 移植后ACL 组织愈合情况Fig. 2 Healing of ACL tissue after transplantation
2.2 各组兔ACL 本体感受器形态表现和分型ACL 本体感受器中可见Ruffini 小体为卵圆形或树突状形态,直径25~330 μm;Pacinian 小体为圆形或椭圆形感受器,直径40~220 μm;Golgi 腱器官感受器呈梭形,直径140~900 μm;游离神经末梢为无髓鞘神经末梢,长度0.5~1.5 μm。移植ACL中本体感受器主要分布于ACL 的胫骨和股骨附着点,主要为类Ruffini 小体和类Pacinian 小体,无典型的类Golgi 腱器官。见图3 和4。
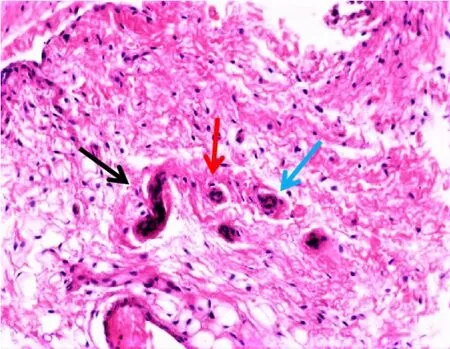
图3 兔正常ACL 中本体感受器(HE,×200)Fig. 3 Proprioceptors in normal ACL of rabbits (HE,×200)
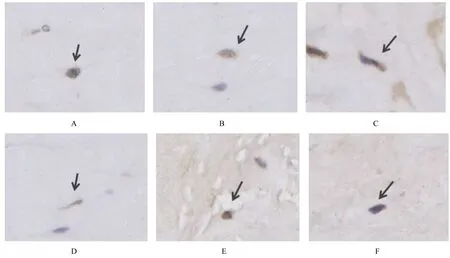
图4 各组兔ACL 本体感受器分型(S100 免疫组织化学,×400)Fig. 4 ACL proprioceptor types of rabbits in various groups (S100 immunohistochemstry,×400)
2.3 各组兔ACL 本体感受器细胞数与对照组比较,振动刺激治疗3、振动刺激治疗5 和振动刺激治疗7 组兔ACL 本体感受器细胞数明显增加(F=28.49,P<0.01)。见表4。
表4 各组兔ACL 本体感受器细胞数Tab. 4 Number of ACL proprioceptor cells of rabbits in various groups(n=3,±s)
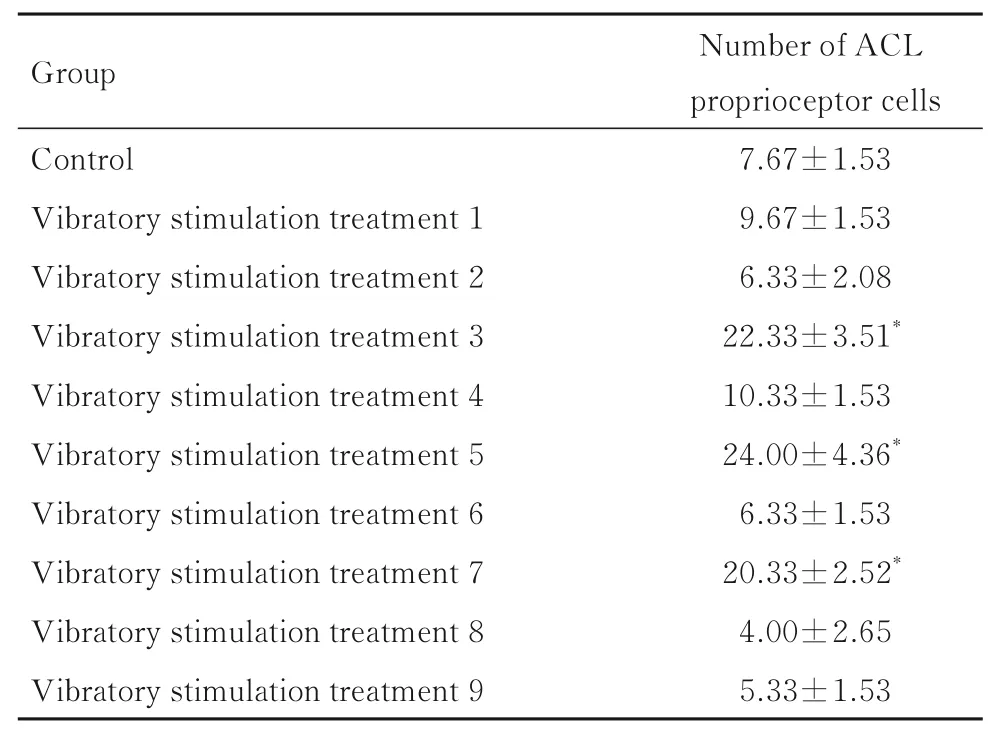
表4 各组兔ACL 本体感受器细胞数Tab. 4 Number of ACL proprioceptor cells of rabbits in various groups(n=3,±s)
*P<0.01 compared with control group.
?
2.4 各组兔ACL 组织中GAP-43 mRNA 表达水平各组兔ACL 组织中GAP-43 mRNA 表达水平比较差异无统计学意义(F=0.83,P>0.05)。见表5。
表5 各组大白兔ACL 组织中GAP- 43 mRNA 表达水平Tab. 5 Expression levels of GAP- 43 mRNA in ACL tissue of rabbits in various groups(n=3,±s)
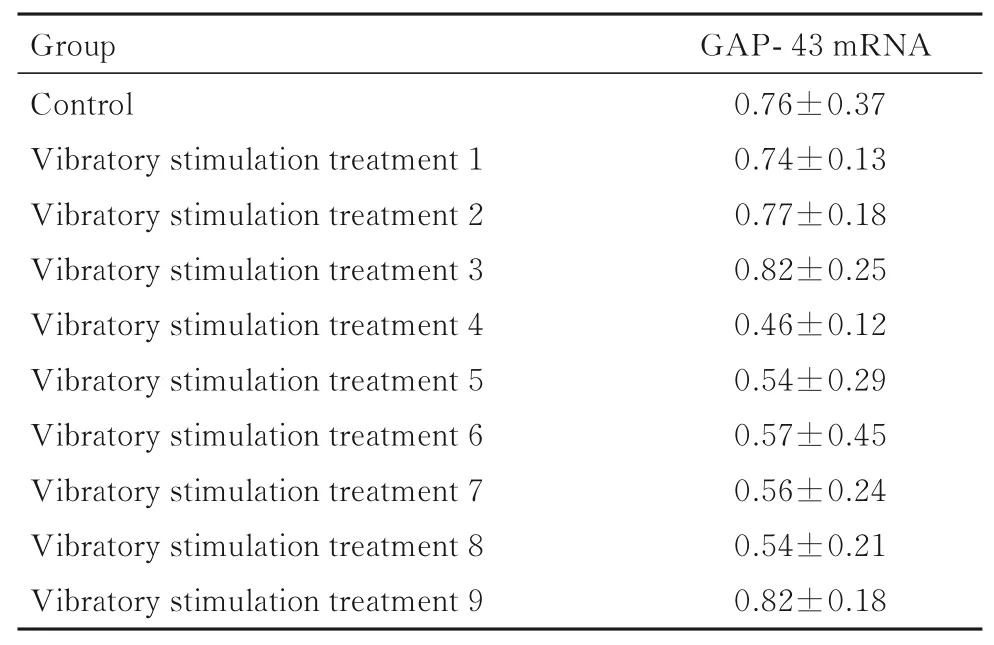
表5 各组大白兔ACL 组织中GAP- 43 mRNA 表达水平Tab. 5 Expression levels of GAP- 43 mRNA in ACL tissue of rabbits in various groups(n=3,±s)
?
2.5 不同振动刺激参数下兔ACL 本体感受器数振幅强度、振动频率和作用时间对局部脉冲振动刺激治疗ACLR 术后本体感受器数均存在较大影响,影响程度(以F值计)为振幅强度>作用时间>振动频率。不同振幅强度治疗条件下,ACL 本体感受器细胞数排序为3 mm>2 mm>4 mm,最优振幅强度为3 mm;不同振动频率治疗条件下,ACL本体感受器细胞数排序为25 Hz>35 Hz>45 Hz,最优振动频率为25 Hz;不同作用时间下,ACL 本体感受器细胞数排序为10 min>30 min>20 min,最佳作用时间为10 min。见表6 和7。

表6 ACL 本体感受器细胞数方差分析Tab.6 Variance analysis on number of ACL proprioceptor cells
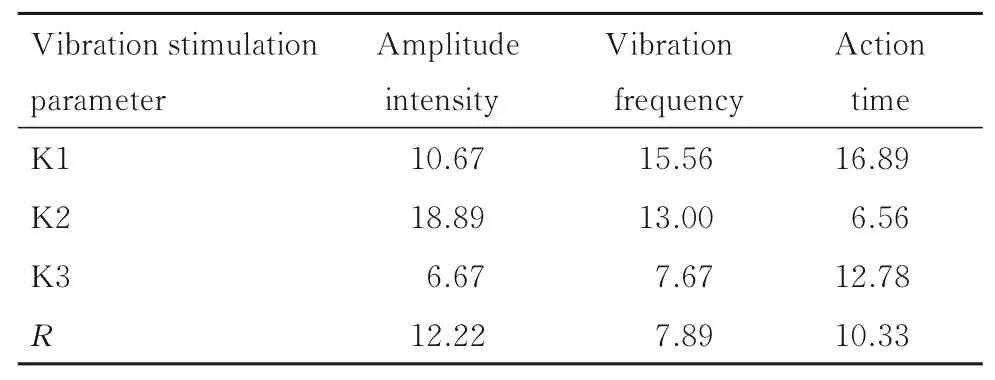
表7 不同振动刺激参数下ACL 本体感受器细胞数正交分析Tab.7 Orthogonal analysis on number of ACL proprioceptor cells under different vibratory stimulation parameters
2.6 不同振动刺激参数下兔ACL 组织中GAP-43 mRNA 表达水平振幅强度、振动频率和作用时间对局部脉冲振动刺激治疗ACLR 术后兔ACL 组织中GAP-43 mRNA表达水平均无明显影响(以F值计)。2、3 和4 mm 振幅强度作用后,ACLR 术后兔ACL 组织中GAP-43 mRNA 表达水平无明显变化;25、35 和45 Hz 振动频率作用后,ACLR 术后兔ACL 组织中GAP-43 mRNA 表达水平无明显变化;作用10、20 和30 min 后,ACLR 术后兔ACL组织中GAP-43 mRNA 表达水平无明显变化。见表8 和9。
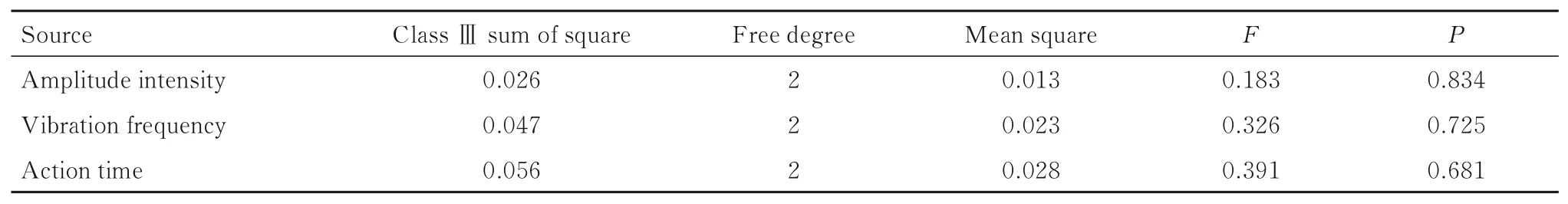
表8 兔ACL 组织中GAP- 43 mRNA 表达水平方差分析Tab.8 ANOVA on expression levels of GAP- 43 mRNA in ACL tissue of rabbits
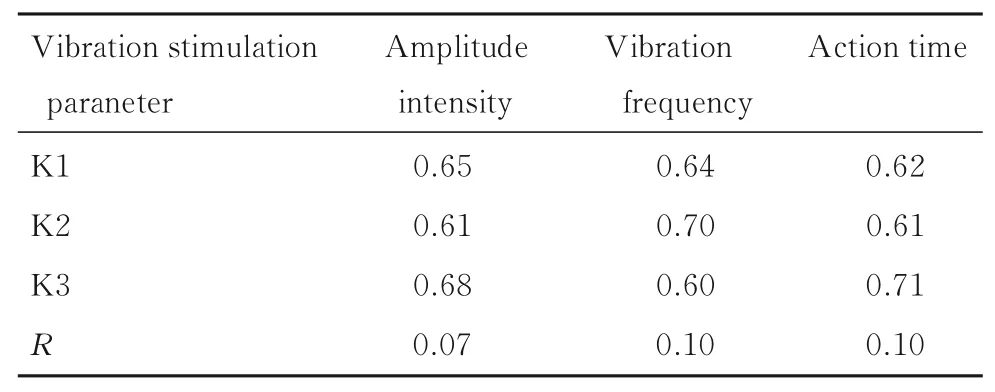
表9 不同振动刺激参数下兔ACL 组织中GAP- 43 mRNA表达水平正交分析Tab. 9 Orthogonal analysis on expression levels of GAP- 43 mRNA in ACL tissue of rabbits under different vibration stimulation parameters
3 讨 论
ACL 中包括Ruffini 小体、 Pacinian 小体、Golgi 腱器官和游离神经末梢等重要的膝关节本体感觉结构[11]。其主要位于韧带的胫骨和股骨附着点,分别参与意识静态状态下关节位置觉、检测关节运动/加速度和调节反射性肌肉收缩,向中枢神经系统提供有膝关节位置和运动及力和力的感觉传入反馈[12-14]。振动刺激治疗是ACLR 术后康复的重要部分,可激活本体感觉发生反射,使肌肉受到振动刺激后不自主收缩进而得到迅速康复。
研究[15]显示:振动可刺激人体多个生物系统,可引起包括皮肤感受器、关节本体感受器、前庭系统变化和神经递质和激素浓度变化。研究[16]显示:低振幅机械噪声振动刺激治疗对ACLR 术后患者的本体感觉恢复有积极作用,可提高本体感觉敏锐度。本研究结果显示:合适条件下的局部脉冲振动刺激治疗可明显增加模型兔的本体感受器细胞数,提示局部脉冲振动刺激治疗可促进ACLR 术后兔本体感觉恢复,达到加快兔ACLR 术后康复的目的。
振动刺激治疗可改善ACLR 术后患者的本体感觉恢复,但振动刺激参数与治疗效果的关系尚未完全阐明。研究[17]显示:振动频率在26~44 Hz 时可提高肌肉力量,振动频率<20 Hz 仅引起肌肉放松,>50 Hz 将引起肌肉损伤。HAN 等[18]发现:在20 Hz 振动频率下ACL 感受器细胞的增殖活性较对照组升高20%。本研究结果显示:局部脉冲振动刺激治疗最主要的影响参数是振幅强度,而振幅强度为3 mm、振动频率为25 Hz 和作用时间为10 min 是ACL 本体感受器细胞增殖的最优参数。因此,临床上对ACLR 术后患者行局部脉冲振动刺激治疗时,可以通过降低振幅强度、降低振动频率和缩短治疗时间以提高治疗效果。
GAP-43 是一种神经系统特异性生长相关蛋白,在神经发育和再生过程中表达。研究[19]显示:当ACL 损伤时,本体感受器中GAP-43 被激活,GAP-43 表达水平升高。本研究结果显示:振幅强度、振动频率和作用时间对局部脉冲振动刺激治疗ACLR 术后ACL 组织中GAP-43 mRNA 表达水平均无明显影响,考虑为本研究实验持续时间较短,需行进一步实验证实。
综上所述,局部脉冲振动刺激治疗可促进兔ACLR 术后ACL 本体感受器恢复。振幅强度、振动频率和作用时间是局部脉冲振动刺激治疗ACLR术后本体感觉恢复的影响因素,其中振幅强度是最主要的影响因素。可采用低振幅、低振动频率和短时间的局部脉冲振动刺激治疗加快ACLR 术后兔本体感觉恢复。
