SOX17 过表达慢病毒载体和稳定转染细胞系的构建
2024-01-05黄少婷吴钊淳何嘉文廖科棋李胜男
黄少婷, 李 友, 吴钊淳, 何嘉文, 廖科棋, 李胜男
(1. 广东医科大学 广东省衰老相关心脑疾病重点实验室, 广东 湛江 524002;2. 广东医科大学附属医院神经病学研究所, 广东 湛江 524002)
动脉粥样硬化是临床常见的心脑血管疾病,其病变基础是脂质代谢障碍,可驱动脂质导致慢性炎症性疾病的发生。颅内动脉粥样硬化是全身动脉粥样硬化的一部分。研究[16]表明:长链非编码基因WDR59(long noncoding RNA WDR59,lncWDR59)表达可上调SOX17 表达,激活β-连接蛋白(β-catenin),减轻氧化修饰的低密度脂蛋白(oxidized-low density lipoprotein,ox-LDL)对内皮细胞的损伤。lncWDR59 可减轻敲除载脂蛋白E(apolipoprotein E,ApoE) 小鼠动脉粥样硬化和ox-LDL 诱导的内皮细胞DNA 损伤,促进内皮细胞增殖。本研究构建SOX17 过表达慢病毒载体并包装为慢病毒,使用SOX17 过表达慢病毒感染PC12 细胞并构建稳定过表达SOX17 的细胞系,为探讨SOX17 在颅内动脉粥样硬化中的作用机制提供参考。
1 材料与方法
1.1 细胞、病毒、主要试剂和仪器大鼠肾上腺嗜铬细胞瘤PC12 细胞购自武汉普诺赛生命科技有限公司,人胚肾HEK 293T 细胞购自中国科学院上海细胞所。 慢病毒载体质粒GV492 (Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin)、辅助质粒Helper 1.0 和辅助质粒Helper 2.0 均由上海吉凯基因公司提供。 大肠杆菌菌株DH5α 购自北京Solarbio 公司,限制性核酸内切酶BamHⅠ和AgeⅠ购自美国NEB 公司,Taq 聚合酶购自北京SinoBio公司,一步法克隆试剂盒(含DNA 连接酶)购自美国Vazyme 公司,HS 聚合酶和反转录试剂盒购自北京Takara Bio 公司,Lipofectamine 2000 和TRIzol 试剂购自美国Invitrogen 公司,实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR) 染料预混液购自北京GenStar 公司,BCA 蛋白定量试剂盒购自美国Thermo Scientific 公司,DMEM、RPMI-1640 和Opti-MEM 培养基购自美国Gibco 公司,胶回收试剂盒、50×TAE 和质粒抽提试剂盒由北京TIANGEN 公司提供,胰蛋白酶、琼脂糖粉、酵母提取物和氯化钠购自美国Vetec 公司,抗SOX17 抗体和抗GAPDH 抗体购自英国Abcam 公司,所用引物均由生工生物工程(上海)股份有限公司提供。倒置光学显微镜和倒置荧光显微镜购自日本Olympus 公司,RT-qPCR仪购自瑞士Roche 公司,电泳仪购自美国Bio-Rad公司,化学发光检测仪购自美国Azure Biosystems公司。
1.2 细胞培养HEK 293T 细胞和PC12 细胞分别常规培养于含10% 胎牛血清和1% 青-链霉素DMEM 和RPMI-1640 培养基中, 置于37 ℃、5%CO2培养箱中培养,隔2~3 d 传代1 次,细胞状态良好及密度大于90%时采用0.25%胰蛋白酶消化传代。
1.3 PCR 引物设计和合成NCBI 数据库搜索SOX17(Gene ID:64321) 序列,结合引物设计原则和载体GV492 阅读框克隆位点,设计引物。引物序列:SOX17 上游引物 5′-AGGTCGACTCTAGAGGATCCCGCCACCATGAGCAGCCCGGA TGCGGGATAC-3′;SOX17 下游引物 5′-TCCTTGTAGTCCATACCGATGTCAGGGTAGTTGC AGTAGTAG-3′。设计并合成SOX17 PCR 鉴定引物: SOX17 上游引物5′-GCACATGGGCGCCCACTACC-3′; SOX17 下游引物 5′-CCTTATAGTCCTTATCATCGTC-3′。 设 计 并 合 成SOX17 RT-qPCR 引物:SOX17 上游引物5′-GTATAAGCCGGAGATGGGT-3′;SOX17 下游引物5′-CCGTCAGATGTCAGGGTAG-3′。 所有引物均由生工生物工程(上海)股份有限公司合成。将合成的基因引物通过PCR 扩增后得到DNA 片段,PCR 反应体系(50 μL):10 μmol·L-1上、下游引物各1 μL,DNA 模板1 μL,2.5 mmol·L-1dNTP 4 μL,5×酶缓冲液10 μ L,HS 聚合酶 0.5 μL,加ddH2O 至50 μL。PCR 反应条件:98 ℃变性5 min,98 ℃、10 s,55 ℃、10 s,72 ℃、90 s,30 个循环;72 ℃继续延伸8 min,4 ℃保存。
1.4 SOX17 慢病毒载体构建采用BamH Ⅰ和AgeⅠ限制性内切酶对GV492 进行双酶切,酶切体系(50 μL):10×酶缓冲液 5 μL,1 g·L-1GV492 DNA 2 μL,BamH Ⅰ 1 μL,AgeⅠ 1 μL, 加ddH2O 至总体积为50 μL。吹打混匀离心后,置于37 ℃反应3 h 或过夜。采用酶切回收试剂盒初胶回收GV492 载体质粒。
采用一步法克隆试剂盒将PCR 扩增的SOX17产物连接至携gcGFP/Puromycin 的慢病毒GV492载体,重组后载体见图1。反应体系(10 μL):5×酶缓冲液 2 μL,酶切后GV492 DNA 2.5 μL,纯化后PCR 产物片段1 μL,DNA 连接酶 1 μL,加入ddH2O 至总体积为10 μL。该反应体系于冰水浴中配制,吹打混匀离心后,37 ℃反应30 min,冰浴冷却5 min。
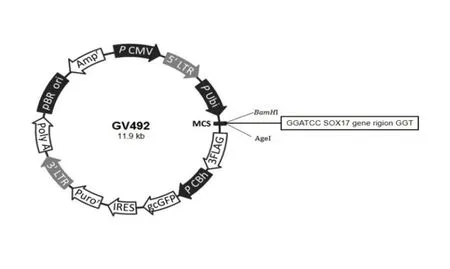
图1 SOX17 过表达慢病毒载体构建图Fig. 1 Diagram of construction of SOX17 over-expression lentiviral vector
将10 μL GV492 空载质粒和GV492-SOX17 过表达重组质粒分别加入至100 μL 感受态细胞DH5α中混匀,冰上反应30 min 后,42 ℃热激1.5 min,冰浴2 min。加入500 μL LB 培养基,37 ℃摇床振荡培养60 min。取适量培养后菌液,将其均匀涂布于含100 mg·L-1氨苄青霉素的LB 培养平板上,倒置平板于37 ℃恒温培养箱中培养12~16 h。次日待平板上长出菌落,挑取适量菌落于3 mL 含100 mg·L-1氨苄青霉素的LB 培养基中,37 ℃摇床振荡过夜,吸取适量菌液采用甘油保菌,剩余菌液进行PCR 和琼脂糖凝胶电泳鉴定。鉴定体系(20 μL):Taq 聚合酶 10 μL,10 μmol·L-1PCR上、下游引物各0.4 μL,适量甘油菌液,加入ddH2O 至总体积为20 μL。PCR 反应条件:94 ℃变性3 min,94 ℃、30 s,55 ℃、30 s,72 ℃、30 s,22 个循环,72 ℃延伸5 min,于4 ℃保存。于基因片段长度为744 bp 附近出现目的条带,提示该重组子为携带GV492-SOX17 过表达重组质粒的阳性菌。鉴定阳性菌经克隆后由生工生物工程(上海)股份有限公司测序,测序成功的阳性菌通过质粒抽提试剂盒提取质粒,所得质粒即可用于后续实验。
1.5 SOX17 慢病毒包装和滴度测定转染前1 d,将生长状态良好的HEK 293T 细胞铺至100 mm 细胞培养皿中,37 ℃、5%CO2培养箱中培养,细胞密度生长至80%~90% 时进行转染。转染体系:Mixture A,GV492 空载质粒或GV492-SOX17 过表达重组质粒 10 μ g, Helper 1.0 型 5 μg,Helper 2.0 型5 μg,Opti-MEM 750 μL;Mixture B,Lipofactamine 2000 15 μL,Opti-MEM 750 μL。分别混匀Mixtue A 和Mixtue B 体系,避光室温静置5 min,后将二者混匀,避光室温孵育20 min。将Mixtue A 和Mixtue B 混合液加入至含3 mL Opti-MEM 的100 mm 培养皿中,37 ℃细胞培养箱内转染4~6 h,后更换为正常生长培养基继续培养48 h。荧光显微镜下观察转染效率约为90%时,收集培养皿上清液,采用0.45 μm 滤膜过滤,低温超高速离心后弃上清液,磷酸盐缓冲液(phosphate buffer saline,PBS)溶解病毒沉淀。转染GV492 空载质粒后收集的慢病毒为GV492 对照慢病毒,转染GV492-SOX17 过表达重组质粒后收集的慢病毒即为GV492-SOX17 过表达慢病毒。
表2所示数据是在混合汽修正过程中截取的,发动机运行一段时间后,混合汽很快就修正到表1所示的数据。在笔者进行学习值清除后,混合汽长期修正值和短期修正值又都归零,喷油时间变成了1ms,但氧传感器λ值居然变成了0.6,此时发动机抖动加剧。但是,很快ECU又开始参与混合汽修正,短期修正值从0变成了-25%,同时喷油脉宽也变成了0.8ms,氧传感器λ值变成了0.8,此时,虽然发动机仍然有些抖动,但比之前要平稳了许多。随后,ECU继续对混合汽进行修正,长期修正值也开始从0逐渐变成了-35%,喷油脉宽变为0.6ms,发动机运转趋于基本平稳,此时调节过程已达到极限,氧传感器λ值维持在0.99。
慢病毒滴度测定前1 d,将HEK 293T 细胞分为101μL 病毒溶液、100μL 病毒溶液和10-1μL 病毒溶液组,以每孔4×104个的细胞密度接种至96 孔细胞培养板中。弃培养基,各组分别加入相应浓度病毒溶液,37 ℃培养24 h 后,加入100 μL完全培养基,待4 d 后于荧光显微镜下观察各组病毒荧光表达情况。
1.6 PC12 细胞感染和细胞系构建将PC12 细胞铺于12 孔细胞培养板中,待细胞密度达到70%~80%时,按最佳感染复数100 取相应病毒量进行慢病毒感染实验。将PC12 细胞分为将空白组、GV492 对照组和GV492-SOX17 组,空白组不作处理,GV492 对照组和GV492-SOX17 组分别采用GV492 对照慢病毒和GV492-SOX17 过表达慢病毒感染PC12 细胞,慢病毒感染24 h 后换液,继续培养48 h,加入10 mg·L-1嘌呤霉素筛选,1 d 后换液,后维持嘌呤霉素浓度于5 mg·L-12 周。荧光显微镜下观察,若PC12 细胞生长状态良好且表达绿色荧光,则提示细胞系构建成功。
1.7 RT-qPCR 法检测各组PC12 细胞中SOX17 mRNA 表达水平采用TRIzol 法提取各组RNA,逆转录合成cDNA,进行RT-qPCR 法检测。反应体系(10 μL):染料预混液5 μL,10 μmol·L-1PCR 上、下游引物各0.2 μL,cDNA 1 μL,加入ddH2O 至10 μL。PCR 扩增条件:95 ℃、10 s,55 ℃、20 s,72 ℃、15 s,共40 个循环,PCR 熔解条件:65 ℃、60 s,95 ℃、1 s。以GAPDH 为内参,采用2-△△Ct法计算目的基因表达水平。
1.8 Western blotting 法检测各组PC12 细胞中SOX17 蛋白表达水平收集各组细胞,采用BCA蛋白定量法进行蛋白定量,恒压60 V、30 min 和恒压100 V、90 min 电泳,湿转法转模,快速封闭液封闭30 min,30 min 后TBST 缓冲液洗膜3 次,每次10 min。加入对应一抗,4 ℃孵育过夜,回收后洗膜3 次,室温孵育二抗60 min,洗膜3 次,采用化学发光剂使条带显影。以GAPDH 为内参,采用Image J 软件分析条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.9 统计学分析采用Graphpad Prism 6.0 统计软件进行统计学分析。各组细胞中SOX17 mRNA和蛋白表达水平均符合正态分布,以xˉ±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 SOX17 过表达慢病毒载体的鉴定结果GV492-SOX17 过表达重组质粒的基因片段长度约为744 bp,与预期一致。见图2。将测序成功的GV492-SOX17 质粒DNA 序列与设计的SOX17序列比较,二者DNA 序列完全匹配,表明SOX17序列成功连接至GV492 载体中,PCR 产物鉴定和测序结果提示成功构建GV492-SOX17 慢病毒载体。见图3。
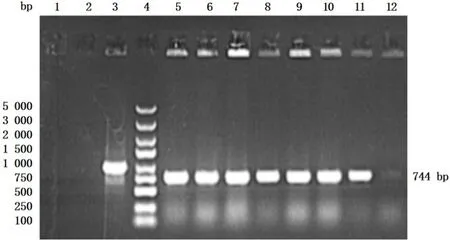
图2 GV492-SOX17 过表达重组质粒鉴定电泳图Fig. 2 Electrophoregram of identification of GV492-SOX17 over-expression recombinant plasmids
2.2 SOX17 过表达慢病毒感染PC12 细胞鉴定结果细胞转染48 h 后观察可见荧光表达强烈,生长状态良好,慢病毒包装成功。GV492 对照慢病毒和GV492-SOX17 过表达慢病毒滴度均为2.5×108TU·mL-1。荧光显微镜下观察结果显示PC12细胞生长状态良好且表达绿色荧光,表明稳定细胞系初步构建成功。见图4。
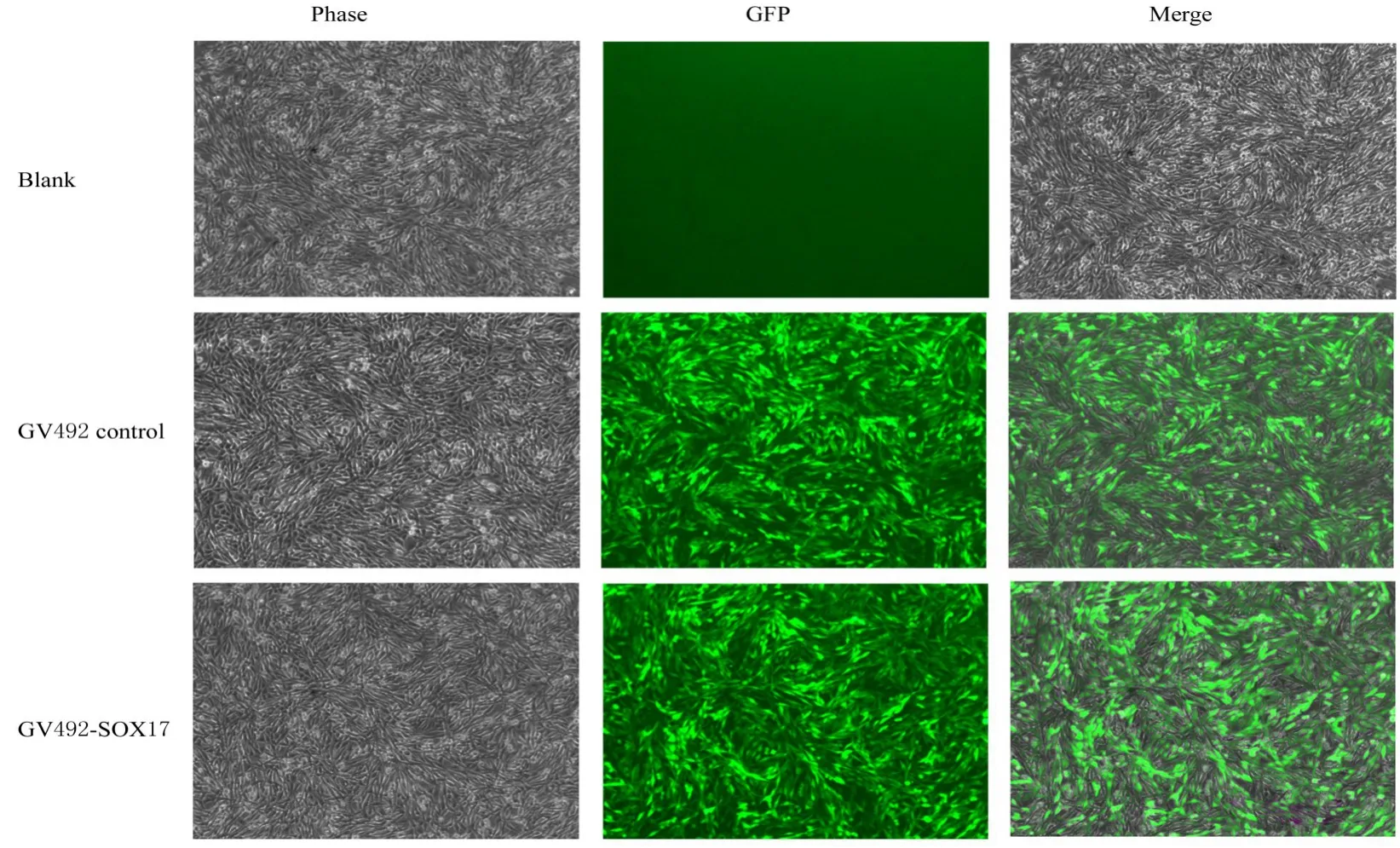
图4 荧光显微镜观察慢病毒感染PC12 细胞中荧光表达情况(×4)Fig. 4 Expression of fluorescence in PC12 cells infected with lentivirus observed by fluorescence microscope(×4)
2.3 各组PC12 细胞中SOX17 mRNA 表达水平与空白组(1.174±0.124) 和GV492 对照组(2.635±0.370) 比较,GV492-SOX17 组PC12 细胞中SOX17 mRNA 表达水平(6.525±0.277) 明显升高(P<0.01)。
2.4 各组PC12 细胞中SOX17 蛋白表达水平各组细胞在相对分子质量44 000 处出现特异性条带,提示PC12 细胞中SOX17 蛋白成功表达。与空白组(1.000±0.065) 和 GV492 对照组 (1.571±0.088) 比较, GV492-SOX17 组PC12 细胞中SOX17 蛋白表达水平(2.078±0.140)升高(P<0.05)。见图5。
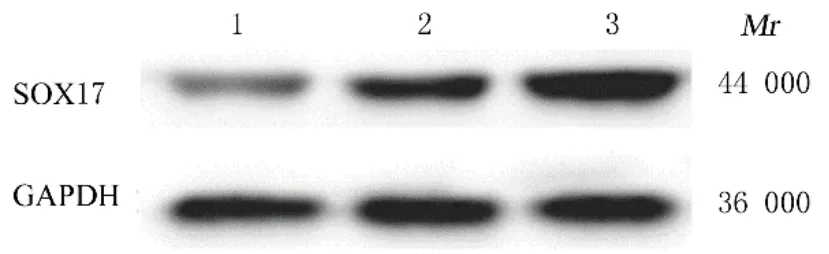
图5 各组PC12 细胞中SOX17 蛋白表达电泳图Fig. 5 Electrophoregram of expression of SOX17 protein in PC12 cells in various groups
3 讨 论
颅内动脉粥样硬化是全身动脉粥样硬化的一部分,可引起暂时性脑缺血发作、脑卒中和血管性痴呆等脑血管疾病。尽管不同部位的动脉粥样硬化病变程度并不平行,但晚期颅内动脉粥样硬化的病变程度与颅外动脉粥样硬化的病变程度较为相似[17]。研究[18]显示:电负性低密度脂蛋白(low density lipoprotein,LDL)可通过促进炎症反应、诱导细胞凋亡、促进血栓形成和刺激LDL 颗粒的聚集融合等方式促进动脉粥样硬化的发生发展。电负性LDL 由L1~L5 共分为5 个亚组分,其中L5 是带负电最多的亚组分。研究[19]显示:L5 对神经元样PC12 细胞具有直接细胞毒性。此外,动脉粥样硬化的发生发展还与Wnt/β-catenin 和Notch 信号通路炎症反应相关通路的激活及内皮功能障碍有关[20-23]。
SOX17 可维持血管稳态,与Wnt/β-catenin 和Notch 信号通路存在调控关系。研究[7-8]显示:SOX17 作为SOX 家族的一员,参与血管的发育。研究[8,12]显示:SOX17 可通过Wnt/β-catenin 和Notch信号通路维持血管稳定性。NATARELLI等[16]研究显示:lncWDR59 通过Notch1 介导的SOX17表达激活β-catenin。经ox-LDL 处理的主动脉内皮细胞中SOX17 的表达下调,但lncWDR59 可促进SOX17 的表达,促进Notch1 激活和增加β-catenin活性,通过减少细胞周期蛋白依赖性激酶抑制剂2α调整细胞周期和修复DNA 损伤,减少微核DNA 损伤[16]。lncWDR59 可减轻ApoE 小鼠动脉粥样硬化和ox-LDL 诱导的内皮细胞DNA 损伤,促进内皮细胞增殖[16]。提示SOX17 在颅内动脉粥样硬化的形成过程中发挥重要作用。
PC12 细胞是具有神经细胞特性的细胞,生长繁殖速度快,被广泛用于神经系统疾病研究。本研究结果显示:GV492-SOX17 慢病毒表达载体成功构建,感染PC12 细胞后可在荧光显微镜下观察到荧光表达,并证实PC12 细胞中SOX17 mRNA 和蛋白成功表达。
综上所述,本研究成功构建了GV492-SOX17慢病毒表达载体, 建立了稳定过表达GV492-SOX17 的PC12 细胞, 为进一步探讨SOX17 在颅内动脉粥样硬化中的作用机制提供参考。
