头部针刺对局灶性脑缺血大鼠神经功能和脑组织中HIF-1α 及VEGFR2 表达的影响及其机制
2024-01-05周秀玲丛德毓张红石
周秀玲, 丛德毓, 张 野, 张红石
(1. 长春中医药大学护理学院,吉林 长春 130117;2. 吉林省中医院推拿科,吉林 长春 130021)
缺血性脑卒中(ischemic stroke,IS) 是常见的脑血管疾病,其发病率占全部脑卒中患者的60%~80%[1]。IS 的发病机制较为复杂,主要是由于脑血管栓塞导致血氧供应不足进而引起脑组织缺血性损伤,导致行为和感知等功能的缺损及障碍。脑血管内皮细胞凋亡和重构在IS 发生发展过程中起重要作用,而缺氧诱导因子(hypoxia inducible factor,HIF)-1α 是上游通路中的关键因子[2]。
头部针刺是基于《灵枢经》中“头有气街”的理论,采用头部针刺的方法对IS 进行治疗。“街”是指人体各部位中气血聚集和通行的道路,也可称为“气街”,人体的胸、腹、头和胫皆有气街,因此《灵枢经》 动输篇中有“四街者,气之路径也”[3]。头部的气血与身体各经脉有密切关联,《灵枢经》邪气脏腑病形篇中记载“十二经脉,三百六十五络,其气血皆上行于面而走空窍”,表明人体头部气血的正常运行与身体各项机能有密切关联。头部针刺理论将头部划分为顶区、顶前区、额区、枕区、枕下区、颞区和项区7 个治疗分区,治疗脑卒中主要选取顶区、顶前区和额区,并以头部的重要经脉督脉作为纵向维度基准,结合头部分区理论并兼顾通督调神理念的头部针刺疗法,目前针灸在临床脑卒中的治疗过程中被广泛应用[4]。本研究探讨头部针刺对局灶性脑缺血大鼠模型神经功能的影响,并阐明HIF-1α 和血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)促血管再生的机制,为头部针刺治疗脑卒中的应用提供实验依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器40 只SPF 级SD大鼠购自吉林省长春市亿斯实验动物技术有限公司,雌雄各半,实验动物生产许可证号:SCXK(吉)-2018-0007,体质量220~230 g,于长春中医药大学SPF 级实验动物中心饲养。饲养间保持23 ℃、12 h/12 h 光照周期,湿度(55±10)%,并自由饮水。实验过程符合实验动物伦理要求,由长春中医药大学伦理委员会审批(20190151)。大鼠HIF-1α 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(中国南京建成生物工程研究所)。华佗牌一次性针灸针(0.25×13 mm,苏州医疗用品有限公司),Morris水迷宫视频跟踪分析系统和视频分析系统(型号Tracking Master V3.0,北京众实迪创科技发展责任有限公司), 组织匀浆器(美国KONTES KIMBLE 公司),低温高速离心机(德国Eprendorf公司),Biotek Synergy HTX 多功能微孔板检测仪(美国宝特伯腾公司)。
1.2 大鼠局灶性脑缺血模型制备和实验分组采用改良大脑中动脉栓塞法(middle cerebral artery occlusion,MCAO)造模[5]。40 只大鼠术前24 h 禁食但自由饮水,麻醉大鼠,大鼠仰卧位固定并于颈部正中剃毛和消毒。以手术刀纵向切口,止血钳钝性分离组织,玻璃分针分离左侧颈内动脉和颈外动脉,分别挂线备用,结扎颈外动脉和颈总动脉,夹闭颈内动脉。于颈总动脉上距离分叉2 mm 处剪1 个斜口,插入线栓,松开颈内动脉血管夹后迅速轻提挂颈内动脉上的缝合线以防止出血过多,将线栓沿颈内动脉穿过颅骨直至手下有明显阻力时,实现大脑中动脉阻塞,导致脑缺血。结扎切口并固定线栓,剪断多余部分缝合线和线栓,缝合伤口,注射20 万单位青霉素,防止感染,并置于加热垫上维持体温恒定。术后采用《Zea-longa 评分标准》[6]对大鼠神经功能进行评定,判定大鼠局灶性脑缺血模型制备是否成功。无异常症状为0 分,鼠尾提起时前肢无法正常伸展为1 分,行走时偏向一侧为2 分,行走困难且倾斜严重为3 分,有意识障碍且无法自发行走为 4 分,1~4 分视为造模成功。将术中意外死亡和造模未成功大鼠剔除实验,并随机选取大鼠补充。选取造模成功的20 只大鼠随机分为模型组和治疗组,每组10 只;另取10 只SD 大鼠作为假手术组,造模结束后次日,治疗组大鼠进行头部针刺治疗;模型组大鼠同样捆绑固定,但不进行治疗;假手术组大鼠同样麻醉后捆绑、分离颈部血管和结扎相应血管,但不进行造模和治疗,其余步骤与另外2 组相同。造模后24 h 后观察并记录各组大鼠神经功能评分。
1.3 头部针刺操作方法头部针刺干预前大鼠麻醉固定,结合《大鼠穴位图谱》[7],在顶骨正中的百会穴及旁开5 mm 处进行定位取穴。头部针刺治疗先取百会穴,以0.25×13 mm 针灸针向前斜刺10 mm,再于百会穴两侧旁开约5 mm 处沿皮朝鼻尖向前斜刺10 mm,进针后以捻转方式快速行针30 s,以5 mm×10 mm 小块医用胶布固定,采用丛刺法和长留针的方式,将大鼠放入无垫料笼中,配合带针运动,留针6~8 h,每日1次,每周针刺7 次,持续2 周。
1.4 Morris 水迷宫实验检测各组大鼠学习记忆功能Morris 水迷宫试验用于测试大鼠的复杂记忆和空间定位能力[8]。Morris 水迷宫由1 个直径为160 cm 的圆形水池和图像采集分析系统构成,周围有遮光布,减少外界干扰。清水高度为距离站台台面约2 cm,将每只大鼠抓住尾巴头朝池壁,分别由站台对面象限放入水池,记录各组大鼠寻找平台时间,每次时间限制为120 s,若120 s 内未找到站台则诱导其在站台上站立15 s,每只大鼠4 次训练结束,毛巾擦干水分。以各组大鼠寻找平台时间代表大鼠的学习记忆功能。
1.5 ELISA 法检测各组大鼠血清和脑组织中HIF-1α水平在治疗周期结束后,分别将各组大鼠麻醉,剪开腹腔,腹主动脉取血5 mL,并将血液样本于2 000 g、4 ℃离心15 min,离心后获取上层血清。大鼠处于麻醉状态,取血后断头处死,立即剥离脑组织,脑样本按质量体积比1 g :9 mL 的比例加入9 倍体积pH 7.4 的磷酸盐缓冲液,手工或匀浆器充分匀浆,2 000 g、4 ℃离心15 min,收集上清液备用。实验均严格按照试剂盒说明书进行,检测各组大鼠血清和脑组织中HIF-1α 水平。
1.6 Western blotting 法检测各组大鼠脑组织中HIF-1α 和VEGFR2 蛋白表达水平剪取脑组织约0.1 g,加入细胞裂解液1 000 μL,离心5 min,取上清液,将蛋白样品按1∶4 加入蛋白上样缓冲液,每孔加10 μL 样品,90 V 浓缩30 min, 120 V 分离1 h,转膜并封闭,参考一抗说明书配制一抗稀释液,室温下孵育2 h, TBST 缓冲液洗涤3 次,每次5 min,参考二抗说明书配制二抗稀释液,室温孵育1.5 h,TBST 缓冲液洗涤3 次,每次5 min,采用ECL 发光底物试剂盒检测蛋白条带,采用Image J 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 统计学分析采用SPSS 24.0 和GraphPad Prism 8 统计软件进行统计学分析。各组大鼠神经功能评分、寻找平台时间、血清和脑组织中HIF-1α水平及各组大鼠脑组织中HIF-1α 和VEGFR2 蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠术后神经功能评分假手术组大鼠未见神经功能缺陷。与假手术组比较,模型组和治疗组大鼠神经功能评分升高(P<0.05)。模型组和治疗组大鼠神经功能评分比较差异无统计学意义(P>0.05)。见表1。

表1 各组大鼠神经功能评分Tab. 1 Neural function scores of rats in various groups(n=10,x±s)
2.2 各组大鼠学习记忆功能与假手术组比较,模型组大鼠寻找平台时间增加(P<0.05)。与模型组比较,治疗组大鼠寻找平台时间减少(P<0.05)。见表2。
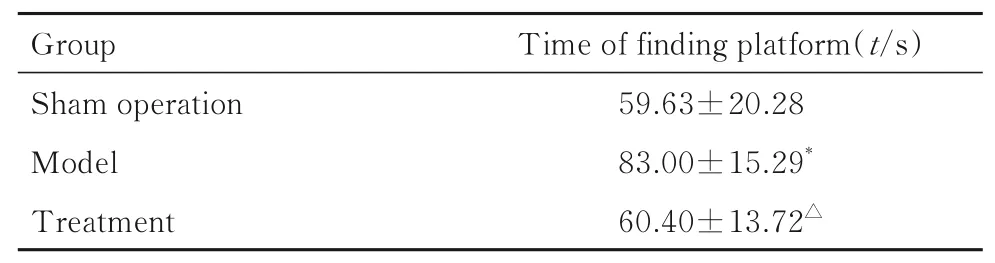
表2 各组大鼠寻找平台时间Tab. 2 Time of finding platform of rats in various groups(n=10,x±s)
2.3 各组大鼠血清和脑组织中HIF-1α 水平与假手术组比较,模型组大鼠血清和脑组织中HIF-1α水平均升高(P<0.05)。与模型组比较,治疗组大鼠血清和脑组织中HIF-1α 水平均升高(P<0.05)。见表3。

表3 各组大鼠血清和脑组织中HIF-1α 水平Tab. 3 Levels of HIF-1α in serum and brain tissue of rats in various groups [n=10,x±s,ρB/(ng·L-1)]
2.4 各组大鼠脑组织中HIF-1α 和VEGFR2 蛋白表达水平与假手术组比较,模型组大鼠脑组织中HIF-1α 和VEGFR2 蛋白表达水平均升高(P<0.05)。与模型组比较,治疗组大鼠脑组织中HIF-1α 和VEGFR2 蛋白表达水平均升高(P<0.05)。见图1 和表4。
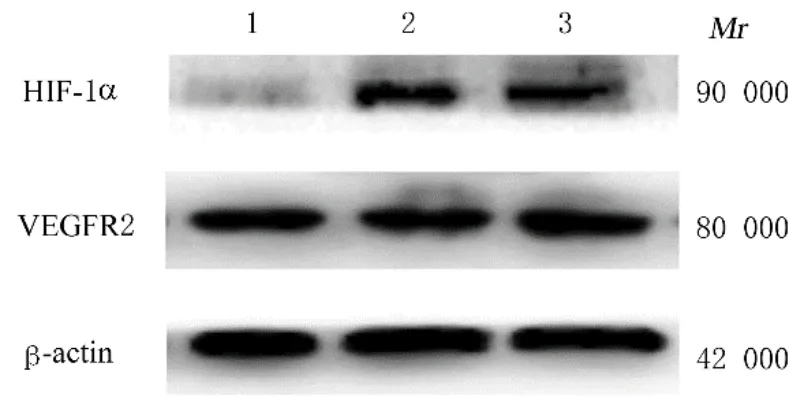
图1 Western blotting 法检测各组大鼠脑组织中HIF-1α 和VEGFR2 蛋白表达电泳图Fig. 1 Electrophoregram of expressions of HIF-1α and VEGFR2 proteins in brain tissue of rats in various groups detected by Western blotting method

表4 各组大鼠血脑组织中HIF-1α 和VEGFR2 蛋白表达水平Tab. 4 Expression levels of HIF-1α and VEGFR2 proteins in brain tissue of rats in various groups(n=3,x±s)
3 讨 论
局灶性脑缺血是一种严重威胁人类生命和健康的疾病,其发病迅速且预后极差,可能会造成认知障碍或肢体痉挛等严重后果,在临床治疗过程中,头部针刺疗法安全可靠且无不良反应,在脑卒中的治疗中具有良好的效果[9]。
HIF-1α 是受缺氧条件诱导的细胞因子,多在哺乳动物体内表达,随着体内氧浓度变化而合成分泌。研究[10-11]显示:缺氧状态诱导生成的HIF-1α可通过促红细胞生成素(erythropoietin,EPO)或血管内皮生长因子(vascular endothelial growth factor, VEGF) 等促进血管生成, 并可影响Notch、Wnt 和Shh 等通路向机体组织供氧。研究[12]显示:脑卒中患者在供氧量不足时,HIF-1α水平变化较为明显,其与脑卒中的发展及患者预后有密切关联。缺氧诱导HIF-1α 水平变化的具体机制尚未完全阐明。AMINOVA 等[13]认为:大鼠海马细胞中HIF-1α 水平对于不同程度的刺激损伤表现出促进细胞活性和促进细胞凋亡的双重作用。HIF-1α 水平升高可能反映脑组织损伤加重。研究[14]显示:脑卒中大鼠模型中血脑屏障的通透性增加或发生脑水肿时,HIF-1α 水平升高。在头部针刺治疗脑卒中急性期患者,即使及时治疗也存在部分症状继续加重,表明在应激栓塞初期一段时间内,脑动脉细胞和神经的坏死会持续发生[15]。本研究结果显示:造模后模型组大鼠血清和脑组织中HIF-1α 水平升高,而经过治疗后,治疗组大鼠脑组织中HIF-1α 水平继续升高,与上述研究结论一致。HIF-1α 对脑组织损伤具有修复作用,研究[16-17]显示:HIF-1α 抑制剂2-甲氧基雌二醇(2-methoxyestradiol,2ME2) 在降低脑缺血大鼠HIF-1α 水平的同时降低了神经元的存活率,表明HIF-1α 可调节神经元活性。BARANOVA 等[18]将小鼠神经元中HIF 基因特异性敲除,加重脑缺血模型中脑组织损伤,并降低细胞存活率。急性脑缺血通过HIF-1α 上调激活内源性组织型纤溶酶原激活物,从而破坏血脑屏障[19]。HIF-1α 水平升高可促进VEGF 表达升高, VEGF 主要通过作用于VEGFR2 促进血管内皮细胞的迁移并在缺氧缺血的区域增殖分化,进而发挥促进血管再生的功能。研究[20]显示:HIF/VEGFR2 通路在局灶性脑缺血后血氧不足条件下表达增加,从而减少脑梗死面积和保护神经功能。HIF-1α 在N-乙酰半胱氨酸介导的神经保护中起重要作用,并为抗氧化剂在IS 的神经保护作用提供分子机制[21]。本研究结果显示:造模后模型组和治疗组大鼠脑组织中VEGFR2 蛋白表达水平均升高,HIF-1α 对血管内皮再生激活和脑组织损伤后修复起关键作用,而头部针刺促进脑组织中HIF-1α 水平升高,增强脑组织损伤后的修复。
综上所述,头部针刺可能通过调控脑组织中HIF-1α 和VEGFR2 水平升高激活HIF/VEGFR2 血管再生通路,修复局灶性脑缺血大鼠脑组织功能,为进一步研究头部针刺对局灶性脑缺血的血管内皮再生机制提供参考。
