松萝酸对增生性瘢痕成纤维细胞生物学行为及JNK/MAPK信号通路的影响
2024-01-05王晓妮罗启云关立锋
王晓妮, 郭 涛, 罗启云, 关立锋
(宁夏医科大学总医院烧伤整形美容科,宁夏 银川 750004)
增生性瘢痕是皮肤发生损伤后出现的病理性改变,在细菌感染和过度炎症反应等因素的调控下,增生性瘢痕成纤维细胞 (hypertrophic scar fibroblasts,HSFBs) 大量增殖,胶原合成与分解平衡被打破,细胞外基质大量沉积,从而造成瘢痕增生,影响患者美观程度,严重者会并发局部溃烂甚至癌变,给患者带来巨大的心理压力和精神痛苦[1-3]。松萝酸具有抗氧化、抗炎和抗病毒等多种药理学活性,可促进创面愈合和控制创面瘢痕过度增生[4-6]。松萝酸可抑制兔耳增生性瘢痕内血管生成,从而抑制增生性瘢痕的形成[7]。c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK) 属于丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)亚族,JNK 相关信号通路在细胞增殖、分化和凋亡过程中具有重要作用[8]。研究[9]显示:A 型肉毒素通过激活JNK 信号通路可诱导成纤维细胞凋亡和抑制成纤维细胞增殖。松萝酸在创面愈合过程中对病理性瘢痕形成的影响和JNK 信号通路的作用尚未完全阐明。本研究探讨松萝酸对HSFBs增殖、凋亡、迁移和侵袭的影响,阐明其对JNK/MAPK 信号通路的调节作用。
1 材料与方法
1.1 细胞、主要试剂和仪器HSFBs 购自美国ATCC 公司。松萝酸(纯度>98%) 购自美国Sigma 公司, 噻唑蓝 (methylthiazolyldiphenyltetrazolium bromide,MTT)试剂盒和细胞凋亡检测试剂盒购自上海碧云天生物科技有限公司,DMEM 培养基和胎牛血清购自美国Gibco 公司,磷酸化JNK (phosphorylated JNK,p-JNK)、JNK、B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X 蛋白(Bcl-2 associated X protein,Bax) 和GAPDH 抗体购自美国Abcam 公司。CytoFLEX 型流式细胞仪购自美国Beckman Coulter 公司,680 型全自动酶标仪购自美国Bio-Rad 公司。
1.2 细胞培养和实验分组将HSFBs 培养于含10%胎牛血清和1%青-链霉素的DMEM 培养基中,置于37 ℃、5%CO2培养箱中培养,光学显微镜下观察细胞融合度,待细胞融合度达80%以上时进行细胞传代。取第4 代对数生长期细胞,制成单细胞悬液,以每孔2×103个细胞的密度接种于96 孔细胞培养板,置于培养箱中培养,细胞贴壁生长后,将细胞分为对照组、10 μmol·L-1松萝酸组、20 μmol·L-1松萝酸组和50 μmol·L-1松萝酸组,对照组细胞更换新鲜培养液,各浓度松萝酸组细胞更换含不同浓度松萝酸培养液,培养24 h 后用于实验。
1.3 MTT 法检测各组细胞存活率取各组处理后细胞,每孔加入10 μL 0.5 g·L-1MTT 溶液继续孵育4 h,加入200 μL 二甲基亚砜,培养箱中孵育15 min,采用酶标仪于波长490 nm 处测定吸光度(A)值,计算各组细胞存活率。细胞存活率=(实验组A 值-空白组A 值)/(对照组A 值-空白组A 值)×100%。
1.4 流式细胞术检测各组细胞凋亡率取各组处理后细胞,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗2 次,加入500 μL PBS 结合缓冲液重悬细胞,分别加入5 μL Annexin Ⅴ-FITC 和PI,轻轻震荡混匀,室温下避光孵育10 min,流式细胞仪检测凋亡细胞数,计算各组细胞凋亡率。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.5 Transwell 小室实验检测细胞侵袭和迁移能力取各组处理后细胞,将Matrigel 与DMEM 培养基按1∶9 稀释,Transwell 小室中加入稀释后基质胶,培养箱中静置30 min。将细胞制成1×105mL-1细胞悬液,取100 μL 细胞悬液置于Transwell 小室的上室中,Transwell 小室的下室中加入500 μL含5%胎牛血清的DMEM 培养基,培养箱中培养24 h,取出小室,4%多聚甲醛固定,结晶紫染色,PBS 缓冲液清洗,显微镜下观察并拍照,计数各组侵袭细胞数。另取处理后细胞,除上室中不加Matrigel 外,其余操作步骤同上。结晶紫染色后,显微镜下观察并拍照,并计数各组迁移细胞数。以侵袭和迁移细胞数代表各组细胞侵袭和迁移能力。
1.6 Western blotting 法检测细胞中p-JNK、JNK、Bcl-2 和Bax 蛋白表达水平取各组处理后细胞,裂解液裂解,离心取上清液,BCA 试剂盒测定蛋白浓度,取蛋白25 μg 进行聚丙烯酰胺凝胶电泳,分离蛋白质,并转移至PVDF 膜上,室温封闭1 h,一抗p-JNK、JNK、Bcl-2 和Bax 抗体(1∶1 000)4 ℃孵育过夜,二抗(1∶5 000) 室温孵育2 h,ECL 法显色,采用Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组细胞存活率、细胞凋亡率、迁移和侵袭细胞数及细胞中p-JNK、JNK、Bcl-2 和Bax蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组细胞存活率和细胞凋亡率与对照组比较,10、20 和50 μmol·L-1松萝酸组细胞存活率均降低(P<0.05),细胞凋亡率均升高(P<0.05)。与10 μmol·L-1松萝酸组比较,20 和50 μmol·L-1松萝酸组细胞存活率均降低(P<0.05),细胞凋亡率均升高(P<0.05)。与20 μmol·L-1松萝酸组比较,50 μmol·L-1松萝酸组细胞存活率降低(P<0.05),细胞凋亡率升高(P<0.05)。见图1 和表1。
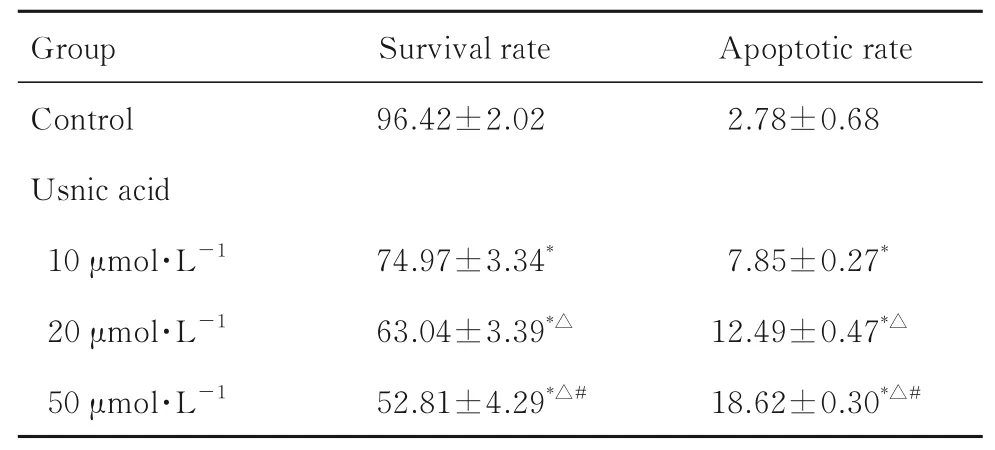
表1 各组细胞存活率和细胞凋亡率Tab. 1 Survival rates and apoptotic rates of cells in various groups(n=3,x±s,η/%)
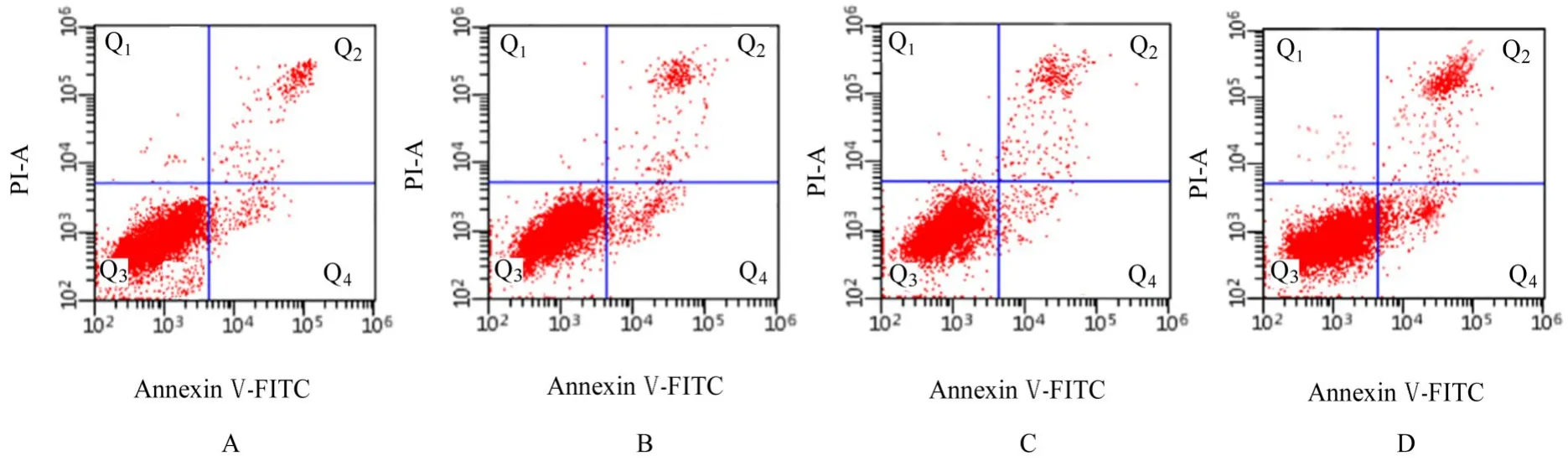
图1 流式细胞术检测各组细胞凋亡率Fig. 1 Apoptotic rates of cells in various groups detected by flow cytometry
2.2 各组侵袭细胞数与对照组比较,10、20 和50 μmol·L-1松萝酸组侵袭细胞数均减少(P<0.05)。与10 μmol·L-1松萝酸组比较, 20 和50 μmol·L-1松萝酸组侵袭细胞数均减少(P<0.05)。与20 μmol·L-1松萝酸组比较,50 μmol·L-1松萝酸组侵袭细胞数减少(P<0.05)。见图2和表2。
表2 各组侵袭细胞数和迁移细胞数Tab. 2 Numbers of invasion cells and migration cells in various groups(n=3,±s)

表2 各组侵袭细胞数和迁移细胞数Tab. 2 Numbers of invasion cells and migration cells in various groups(n=3,±s)
*P<0.05 compared with control group; △P<0.05 compared with 10 μmol·L-1 usnic acid group; #P<0.05 compared with 20 μmol·L-1 usnic acid group.
?
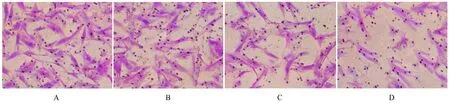
图2 结晶紫染色观察各组侵袭细胞数(×400)Fig. 2 Number of invasion cells in various groups observed by crystal violet staining(×400)
2.3 各组迁移细胞数与对照组比较,10、20 和50 μmol·L-1松萝酸组迁移细胞数均减少(P<0.05)。与10 μ mol·L-1松萝酸组比较, 20 和50 μmol·L-1松萝酸组迁移细胞数均减少(P<0.05)。与20 μmol·L-1松萝酸组比较,50 μmol·L-1松萝酸组迁移细胞数减少(P<0.05)。见图3 和表2。
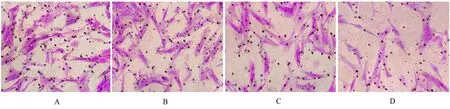
图3 结晶紫染色观察各组迁移细胞数(×400)Fig. 3 Number of migration cells in various groups observed by crystal violet staining(×400)
2.4 各组细胞中JNK、p-JNK、Bcl-2 和Bax 蛋白表达水平与对照组比较,10、20 和50 μmol·L-1松萝酸组细胞中Bcl-2 蛋白表达水平均降低(P<0.05),Bax 和p-JNK 蛋白表达水平均升高(P<0.05)。与10 μ mol·L-1松萝酸组比较,20 和50 μmol·L-1松萝酸组细胞中Bcl-2 蛋白表达水平均降低(P<0.05),Bax 和p-JNK 蛋白表达水平均升高(P<0.05)。与20 μ mol·L-1松萝酸组比较,50 μmol·L-1松萝酸组细胞中Bcl-2 蛋白表达水平降低(P<0.05),Bax 和p-JNK 蛋白表达水平均升高(P<0.05)。各组JNK 蛋白表达水平比较差异无统计学意义(P>0.05)。见图4 和表3。
表3 各组细胞中p-JNK、JNK、Bcl-2 和Bax 蛋白表达水平Tab. 3 Expression levels of p-JNK, JNK, Bcl-2, and Bax proteins in cells in various groups(n=3,±s)
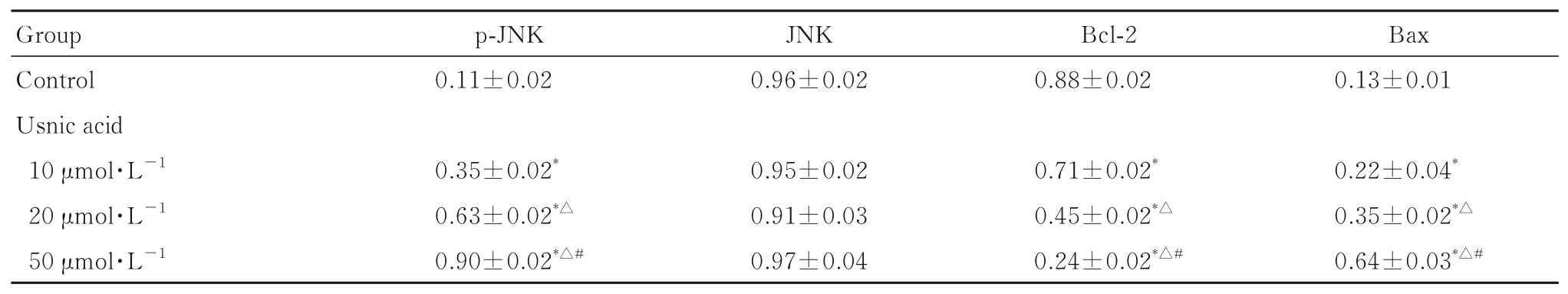
表3 各组细胞中p-JNK、JNK、Bcl-2 和Bax 蛋白表达水平Tab. 3 Expression levels of p-JNK, JNK, Bcl-2, and Bax proteins in cells in various groups(n=3,±s)
*P<0.05 compared with control group; △P<0.05 compared with 10 μmol·L-1 usnic acid group; #P<0.05 compared with 20 μmol·L-1 usnic acid group.
?

图4 各组细胞中p-JNK、JNK、Bcl-2 和Bax 蛋白表达电泳图Fig. 4 Electrophoregram of expressions of p-JNK,JNK, Bcl-2, and Bax proteins in cells in various groups
3 讨 论
临床上治疗瘢痕的方法主要包括压迫、冷冻、激光手术等,但由于其各自的局限性和副作用,较难获得理想的治疗效果,因此需要开发新型治疗增生性疤痕药物[10-11]。厚朴酚和山柰酚等中药可通过抑制HSFBs 的增殖活性发挥抗瘢痕增生的作用[12-13]。松萝酸在低等地衣植物中含量较高,是一种具有独特二苯并呋喃骨架的次生代谢产物,具有抑制细胞增殖、迁移和侵袭的作用。研究[14-15]显示:松萝酸可抑制乳腺癌和结肠癌细胞增殖。但目前关于松萝酸在HSFBs 增殖、迁移和侵袭中的研究较少。本研究结果显示:与对照组比较,10、20 和50 μmol·L-1松萝酸组细胞存活率均降低,而细胞凋亡率均升高,且呈剂量依赖性,提示松萝酸可抑制HSFBs 增殖和诱导HSFBs 凋亡。
研究[16]证实:松萝酸具有诱导宫颈癌细胞凋亡的作用。松萝酸可阻滞细胞周期、抑制细胞DNA 合成和产生细胞毒性,抑制细胞的恶性增殖,并诱导细胞凋亡。本研究结果显示:与对照组比较,10、20 和50 μmol·L-1松萝酸组侵袭细胞数和迁移细胞数均减少,且随松萝酸浓度的升高细胞数逐渐递减,提示松萝酸可增强细胞间的黏附性,使细胞不易处于游离状态,抑制HSFBs 迁移和侵袭。
MAPK 信号通路参与多种病理生理过程,是真核细胞调控和介导细胞内信号转导的重要系统,而JNK 是MAPK 信号通路中的重要支路[17]。研究[18]显示:同源盒B9 通过激活MAPK 信号通路促进增生性瘢痕的形成。激活MAPK 信号通路可降低脂多糖刺激的类增生性瘢痕成纤维细胞活性[19]。本研究结果显示:与对照组比较,10、20和50 μmol·L-1松萝酸组细胞中p-JNK 蛋白表达水平升高,且呈剂量依赖性,提示松萝酸可上调JNK 磷酸化,激活JNK/MAPK 信号通路。
细胞凋亡是多种基因共同作用的结果,Bcl-2家族在调控细胞凋亡中具有重要作用,该家族主要包括抗凋亡蛋白Bcl-2 和促凋亡蛋白Bax,当细胞受损或增殖受到抑制时,Bax 和Bcl-2 的表达失衡,Bax蛋白表达水平升高,Bcl-2 蛋白表达水平降低,从而增加线粒体膜通透性,启动细胞凋亡级联反应[19-23]。本研究结果显示:与对照组比较,10、20和50 μmol·L-1松萝酸组细胞中Bcl-2 蛋白表达水平均降低,Bax 蛋白表达水平均升高,且呈剂量依赖性,提示松萝酸可调节凋亡相关蛋白表达并诱导HSFBs 凋亡。与DERICI 等[24]的研究结果一致。
综上所述,松萝酸可抑制HSFBs 增殖、侵袭和迁移,诱导细胞凋亡,同时可促进JNK 磷酸化,激活MAPK/JNK 信号通路。
