辣木籽ACE抑制肽的分离纯化、结构鉴定及其体外活性评价
2024-01-03钟玉旺徐万莉范尧珠黎依艳王雪峰
钟玉旺,徐万莉,范尧珠,黎依艳,王雪峰,
(1.云南农业大学食品科学技术学院,云南 昆明 650201;2.丽江职业技术学院,云南 丽江 674100;3.资阳环境科技职业学院,四川 资阳 641300)
高血压为常见的慢性心血管疾病,是诱发脑梗死、肾衰竭、心肌梗死等疾病的危险因素之一,据统计心血管疾病导致死亡的原因占人类死亡原因的30%[1]。目前,常见的降压药物如沙坦类、平地类、普利类等虽然具有显著的降压效果,但长期服用降压药容易引起肾衰竭、心衰竭等慢性疾病的发生[2]。寻找低副作用高降压效果的替代品已迫在眉睫。研究报道天然来源的血管紧张素转换酶(angiotensin-converting enzyme,ACE)抑制肽与人工合成药物相比无副作用且获取来源较广,现已发现玉米[3]、核桃[4]、龙须菜[5-6]、南瓜籽[7]、辣木叶[8]等都含有ACE抑制肽。近年来,我国多肽类降压食品、药品商品化过程正在推进,天然食品中的ACE抑制肽活性高、安全好,没有降压药物的毒副作用。天然来源ACE抑制肽将成为未来多肽类降压食品的主力军,同样也是研究降压药物极好的切入点。因此,筛选出降压活性强、安全性高、稳定性好的ACE抑制肽,充分发挥其低毒高效的生物利用度,成为未来主要的研究方向。
辣木(Moringa oleifera)主要分布在热带与亚热带地区,目前在我国台湾、海南、云南等地均有种植,云南种植面积达到全国的70%[9]。辣木除了“三高”(高蛋白质、高钙、高维生素),还富含多种氨基酸、矿物质、维生素等人体必需营养成分[10]。其中,辣木籽富含蛋白质(37.8%)、油脂、维生素、多糖、矿质元素等营养成分,其食用功能和药用价值使辣木籽成为极具开发前景的食品资源[11]。在辣木籽研究方面,国内外进行了较为深入的研究,且主要集中在黄酮、多糖、蛋白和辣木籽油的提取及其在抗氧化、抗菌、抗肿瘤、抗炎、降脂和改善糖尿病等方面的功效[12-14]。其中陈冰冰等[15]通过优化酶解工艺从富硒辣木籽中发现其中含有较强ACE抑制活性的肽组分;Aderinola等[16]使用胰蛋白酶水解辣木籽蛋白,也产生具有潜在抗高血压特性的肽组分,但两者均未对该类肽组分进行分离鉴定和体外活性评价。
本实验前期以辣木籽蛋白为原料,通过超声波辅助酶法获得了具有较好ACE抑制率的酶解产物[17]。本研究将以该酶解产物为研究对象,以ACE抑制率为评价指标,通过膜分离技术、强阴离子交换层析分离蛋白肽成分,通过高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLCMS/MS)结合生物信息学鉴定筛选出潜在的ACE抑制肽,利用分子对接进一步分析ACE抑制肽的作用机制,解析其二级结构特征及体外活性,旨在为辣木籽降压肽产品或相关功能性食品的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
辣木籽由云南天佑科技开发有限公司提供。
三羟甲基氨基甲烷、碱性蛋白酶(200 U/mL)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(N-[3-(2-furyl)acryloyl]-Phe-Gly-Gly,FAPGG)、ACE上海源叶生物科技有限公司;甲醇、乙腈(均为分析纯)默克股份两合公司;盐酸 川东化工有限公司;乙酸乙酯 天津市风船化学试剂科技有限公司;三氟乙酸(纯度99.5%)山东西亚化学股份有限公司;四甲基偶氮噻唑蓝(3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide,MTT)、Q-琼脂糖凝胶FF北京索莱宝科技有限公司;DMEM(Dulbecco’s modified eagle medium)缓冲液培养基、二甲基亚砜(dimethyl sulfoxide,DMSO)、胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)美国Sigma公司。
1.2 仪器与设备
L580R高速冷冻离心机 上海安亭科学仪器厂;SCIENTZ-18N真空冷冻干燥机 宁波新芝生物科技股份有限公司;LC20020985手持pH计 上海力辰邦西仪器科技有限公司;R-BIOPHARMWEL1酶标仪、Easy-nLC 1200 HPLC仪、Q Exactive高分辨质谱仪、色谱柱Trap column RP-C18(100 μm×20 mm,5 μm)美国赛默飞世尔科技公司;DBS-100全自动部分收集器上海沪西分析仪器厂有限公司;1200 HPLC仪 美国安捷伦公司;Scientz-50 C多功能恒温超声波萃取仪 宁波新芝生物科技股份有限公司;UFSC40001搅拌式超滤装置红衫设备厂。
1.3 方法
1.3.1 辣木籽蛋白提取
根据前期实验[14]提取辣木籽蛋白。
1.3.2 辣木蛋白酶解液的制备
采用实验前期的超声波辅助酶法制备辣木籽蛋白酶解液[14],最佳制备条件为超声功率500 W、超声酶解时间1.7 h、超声酶解温度55 ℃、辣木籽粉与0.3 mol/L氯化钠溶液料液比1∶45(g/mL)、pH 9。
1.3.3 辣木籽酶解液的膜分离
采用截留分子质量分别为3、5、10 kDa的超滤膜对辣木籽蛋白酶解液进行超滤分离,收集截留液,冷冻干燥后,测定其ACE抑制率并收集抑制率较高的截留组分[17]。
1.3.4 ACE抑制活性的测定
参照Yang Yijie等[18]的方法,使用pH 8.2、80 mmol/L HEPES缓冲液配制1 mmol/L的FAPGG溶液和0.1 U/mL的ACE溶液和样品溶液,按照表1在96 孔板中加入各试剂,在37 ℃预热5 min后在340 nm波长处借助酶标仪测定样品孔和空白孔的吸光度A1和B1,37 ℃恒温反应30 min后再次测定吸光度A2和B2。ACE抑制率计算如式(1)所示:

表1 ACE抑制率体外检测反应体系组成Table 1 Composition of reaction system for in vitro assay of ACE inhibitor activity
式中:ΔA(ΔA=A1-A2)为样品孔溶液在340 nm波长处的吸光度减少值;ΔB(ΔB=B1-B2)为空白孔溶液在340 nm波长处的吸光度减少值。
1.3.5 强阴离子交换柱层析
参考李亚会等[19]的方法,将ACE抑制率最高的超滤截留组分用pH 9.5、0.05 mol/L的Tris-HCl缓冲溶液配成5 mg/mL的样品溶液。用缓冲液平衡强阴离子交换12 h后上样30 mL,在检测波长214 nm处分别以0.07、0.018、1 mol/L的NaCl溶液进行梯度洗脱,收集各洗脱组分后冷冻干燥,测定其ACE抑制率。
1.3.6 HPLC-MS/MS鉴定
参考石径[20]的方法,采用HPLC法分析检测超滤组分中多肽的组成。
HPLC条件:A液为0.1%甲酸-水溶液,B液为0.1%甲酸-乙腈溶液。色谱柱Trap column RP-C18(100 μm×20 mm,5 μm)以100%的A液平衡,流速为300 nL/min,洗脱时间30 min。
MS条件:检测方式:使用前经标准校正液校正,母离子扫描范围:m/z350~2 000,质谱扫描方式为信息依赖的采集工作模式下,每次全扫描后采集最强的20 个碎片图谱,碎裂方式:高能碰撞解离,归一化碰撞能量28,动态排除时间25 s。MS1在m/z200时分辨率70 000,自动增益控制目标设置为3×106,最大注射时间100 ms,MS2分辨率设置为17 500,AGC target设置为1×105,最大注射时间50 ms。利用PEAKS Studio软件分析活性肽序列并对比数据库(PeptideRanker、lamu gene pep+uniprotlamu)筛选潜在的ACE抑制肽。
1.3.7 分子对接技术
参照管骁等[21]方法,从PDB数据库(https://www.rcsb.org/)获得ACE天然晶体的3D结构(PDB ID:1O8A)作为受体,使用HPEPDOCK将筛选所得的肽与ACE天然晶体结构对接以研究它们的结合模式。使用Pymol 2.3.0删除其3D晶体结构中的水分子和杂原子,保留Zn2+和Cl-。将蛋白结构导入LIGPLOT(v2.2.4)进行加氢、计算电荷、分配电荷、指定原子类型。以Zn原子为活性中心,定义活性坐标(X:38.977;Y:38.645;Z:50.183),对接半径为0.375 Å。其余参数设置为默认值。挑选出最低结合能的复合物为最有利的结合方式,并采用 Pymol 2.3.0将对接结果可视化。将确定的氨基酸序列委托安徽国平药业有限公司采用固相法合成ACE抑制肽(纯度>95%)。
1.3.8 傅里叶变换红外光谱测定辣木籽ACE抑制肽的二级结构
采在1 mg冷冻干燥的合成肽粉末中加入100 mg的溴化钾,使用玛瑙研钵研磨15~20 min后压制成1~2 mm的薄片,在14 kg的压力下保持1 min,迅速放入傅里叶变换红外光谱仪光路中进行扫描。设置扫描波数谱段范围400~4 000 cm-1,分辨率4 cm-1空气作为背景,在波数精度0.01 cm-1条件下扫描64 次。利用PeakFit V4.12软件分析谱图,采用Gauss峰形进行拟合后估算出子峰的位置和个数,根据各子峰与二级结构对应关系,利用积分面积计算各二级结构的相对含量。
1.3.9 酶抑制动力学分析
对合成肽的半抑制浓度(IC50)进行测定,参照He Rong等[22]的方法对辣木籽ACE抑制动力学进行分析。将ACE的底物抑制剂(FAPGG)等比配制为1、0.5、0.25、0.125、0.062 5 mmol/L的浓度。按照1.3.4节体外活性测定方法进行测定,以酶促反应速率(1/V)倒数为纵坐标与底物浓度倒数(1/S)为横坐标制作作Lineweaver-Burk双倒数图,计算米氏常数Km和最大酶促反应速率Vmax。
1.3.10 MTT实验
参考姚兴梅等[23]的方法稍作修改,测定辣木籽ACE抑制肽对人肝癌细胞(HepG2)的抑制作用。将对数生长期的HepG2细胞倾去培养液,加入5 mL磷酸盐缓冲进行清洗,使用l mL胰蛋白酶-EDTA消化3 min,加人2 mL无血清的DMEM(缓冲液培养基)终止消化反应。以1 500 r/min的转速离心3 min,去除上清液,调整为5×104个/mL的细胞悬液,接于96 孔板中(每孔200 μL)。细胞完全贴壁后,实验组加入100 μL的辣木籽ACE抑制肽溶液(0.01、0.05、0.1、0.5、1 mg/mL),放入培养箱中培养24 h后取出,在避光环境下每孔加入20 μL MTT(5 mg/mL)试剂,于培养箱中培养4 h,弃上清液,最后在每孔中加入150 μL的DMSO溶液,37 ℃以600 r/min的速率振摇10 min,使用酶标仪在25 ℃、490 nm波长处测定吸光度,细胞存活率计算公式如下:
1.4 数据分析
采用Excel 2015软件对数据进行整理,Origin 2018对数据进行处理分析,使用Adobe Illustrator CS6处理图像,所有实验均重复3 次,数据表示为。
2 结果与分析
2.1 辣木籽蛋白水解物膜分离组分的活性测定
由图1A可知,酶解液与4 个超滤组分均具有一定的ACE抑制率,在质量浓度为0.25~4 mg/mL范围内,各超滤组分的ACE抑制能力随质量浓度的上升而增强,且相同质量浓度下<3 kDa的超滤组分具有最高的ACE抑制率,>10 kDa的超滤组分ACE抑制率最低,这与Abdelhedi[24]、Li Meiqing[25]等发现酶解物中低分子质量肽组分具有更高ACE抑制活性的结果一致。由图1B可知,<3 kDa的超滤组分与其他组分相比,其IC50值更低,可能原因是低分子质量肽组分氨基酸链较短、空间位阻小,更易进入ACE活性口袋而改变ACE的催化活性[26]。

图1 不同截留分子质量的辣木籽ACE抑制肽的活性抑制率(A)和IC50值(B)Fig.1 ACE inhibitory rates (A) and IC50 values (B) of peptides derived from M.oleifera seeds
2.2 强阴离子交换柱层析分离组分活性测定
离子交换层析法根据离子交换能力的不同分离目标化合物,已被广泛应用于分离蛋白质水解物中的肽段。本研究将分子质量<3 kDa肽组分在214 nm检测波长下,洗脱体积为70~240、270~320、380~430、590~730 mL的条件下进行检测,分析该组分的洗脱峰个数及其ACE抑制率和IC50值,结果如图2所示。

图2 强阴离子交换柱层析图(A)及不同洗脱峰的辣木籽ACE抑制肽的活性抑制率(B)和IC50值(C)Fig.2 Strong anion exchange column chromatogram of peptide fraction less than 3 kDa shown in Fig.1 (A),and ACE inhibitory rates (B) and IC50 values (C) of its subfractions
由图2A可知,从<3 kDa超滤组分中获得了4 个洗脱峰F-a~d。图2B显示F-a、F-b、F-c组分在质量浓度0.25~4 mg/mL范围内,ACE抑制率随质量浓度的上升而增强,其中以F-b组分的ACE抑制率最高,F-d组分几乎没有活性抑制能力。图2C表明F-b组分的IC50值(0.037 mg/mL)低于F-a和F-c组分,且明显低于<3 kDa的超滤组分(0.65 mg/mL),说明柱层析分离纯化效果显著,其活性要优于耿雪冉[27]从三色雷蘑中分离纯化得到的ACE抑制肽组分(IC50=1.64 mg/mL)。
2.3 HPLC-MS/MS鉴定
由表2可知,从ACE抑制活性最好的F-b组分中共鉴定到11 条肽序列,利用在线数据库PeptideRanker(http://bioware.ucd.ie/~compass/biowareweb/)、Toxin Pred(http://web.expasy.org/protparam/)、Expasy-Compute(https://web.expasy.org/compute)和Pepdraw(http://www.tulane.edu/~biochem/WW/PepDraw)分别预测了11 条肽的分子质量、溶解性、毒性和疏水性比例。研究表明良好水溶性ACE抑制肽有利于肠道吸收[28]。根据溶解性分析发现QGPRPQ、PPKKKFRTGV、DPNNFT具有较好的水溶性,证明它们在水溶液中较稳定,能够被肠道快速吸收,其可能具有较高的ACE抑制率,其二级质谱图如图3所示,化学结构式如图4所示。

图3 肽QGPRPQ、PPKKKFRTGV、DPNNFT二级质谱图Fig.3 Secondary mass spectra and structures of peptides QGPRPQ,PPKKKFRTGV and DPNNFT

图4 肽QGPRPQ、PPKKKFRTGV、DPNNFT结构图Fig.4 Structural formulae of peptides QGPRPQ,PPKKKFRTGV and DPNNFT

表2 F-b组中具有ACE抑制活性的肽段部分理化性质Table 2 Selected physicochemical properties of peptides with ACE inhibitory peptide F-b shown in Fig.2
2.4 分子对接
为进一步从鉴定到的3 条肽中筛选出潜在的ACE抑制肽,采用分子对接技术研究QGPRPQ、PPKKKFRTGV、DPNNFT(配体)分别与1O8A(受体蛋白)之间的结合模式和结合力,其对接构象图如图5所示。

图5 肽QGPRPQ(A)、PPKKKFRTGV(B)、DPNNFT(C)与ACE对接构象图Fig.5 Conformation diagrams of peptides QGPRPQ (A),PPKKKFRTGV (B),DPNNFT (C) docking with ACE
由表3可知,QGPRPQ、PPKKKFRTGV、DPNNFT与1O8A的对接打分值分别为-176.353、-236.175、-174.517,均低于缪雨露[29]的四肽打分值(-12.12)。一般受体与配体结合打分值越低,则结合能力越强[29],表明肽QGPRPQ、PPKKKFRTGV、DPNNFT能与ACE结合。ACE的活性中心由S1(Ala354、Glu384和Tyr523)、S2(Gln281、His353、Lys511、His513和Tyr520)和S′(Glu162)活性口袋构成,往往活性肽与ACE活性中心残基Trp279、Gln281、His353、Ala354、Ser355、Ala356、His383、Glu384、Glu411、Asp415、Lys454、Phe457、Lys511、His513、Tyr520、Tyr523形成氢键可以产生高ACE抑制活性,而疏水作用又与两者结合的稳定性密切相关[30-32]。本研究中,肽QGPRPQ与ACE残基His387、Tyr394、Asp358、Val399、Arg402、Glu403、Tyr360、Tyr523、Glu411、His383可形成10 个氢键,其中对活性位点的关键氨基酸残基Tyr523形成氢键作用力,表明QGPRPQ能与S1活性口袋紧密结合而显示较好的ACE抑制活性,这与俞君杰等[33]研究的肽TTW结果一致。同时QGPRPQ与ACE的14 个氨基酸残基具有疏水作用,则有利于提高复合物的稳定性。另外,肽PPKKKFRTGV与ACE残基Val518、Tyr213、Glu225、Lys118、Val119、Asn66、Asp358、Val399可形成8 个氢键,但未与ACE活性中心的3 个活性口袋形成氢键,表明其ACE抑制活性较差。而肽DPNNFT与ACE残基Tyr360、Ala356、Asn70、Glu143、Leu139、Ser516、Asn66则形成了7 个氢键,其中与活性中心残基Ala356形成了氢键作用力,表明DPNNFT能与S1活性口袋紧密结合形成较好的ACE抑制活性,且可与ACE的7 个残基形成疏水作用。一般来说,活性肽与ACE形成氢键和疏水作用的氨基酸残基数越多,其ACE抑制活性越高,更具结合稳定性[34]。此外,肽段的长度和内部空间结构可能会影响活性口袋中的特征性氨基酸形成氢键和疏水作用。因此,肽QGPRPQ表现出更好的ACE抑制活性和结合稳定性。
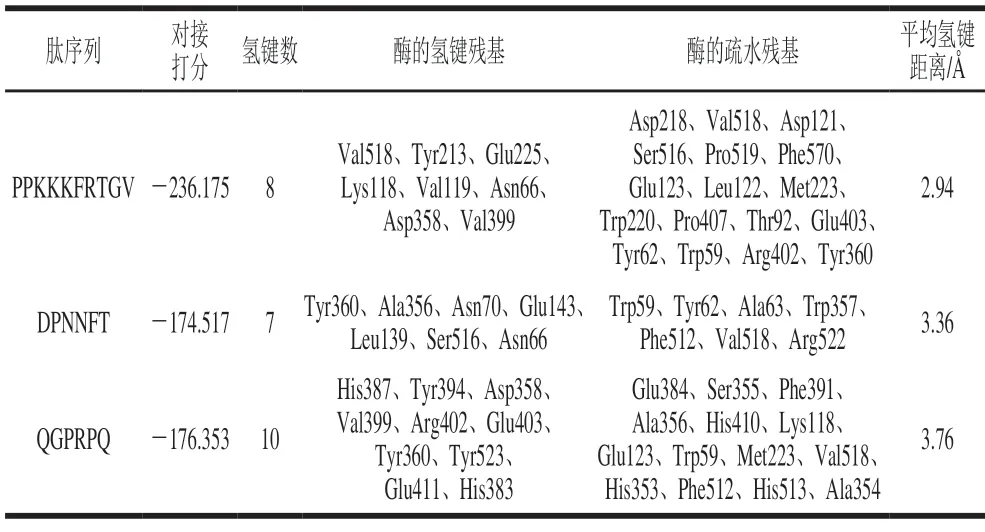
表3 肽PPKKKFRTGV、DPNNFT、QGPRPQ与1O8A蛋白的分子对接分析Table 3 Molecular docking analysis of peptides PPKKFRTGV,DPNNFT and QGPRPQ with 1O8A protein
为进一步明确肽QGPRPQ 的体外ACE 抑制活性,采用固相合成法进行化学合成,该合成肽的HPLC图和一级质谱图如图6所示,测定其IC50值为(1.15±0.3)mmol/L,低于Guo Yuxing等[35]从乳清蛋白酶解物中鉴定到的二肽KA(IC50=(24±0.01)mmol/L)、EN(IC50=(1.43±0.04)mmol/L)和三肽DIS(IC50=(1.59±0.27)mmol/L)、EVD(IC50=(1.32±0.05)mmol/L)、LF(IC50=1.60±0.39)mmol/L)、AIV(IC50=(2.66±0.02)mmol/L)、VFK(IC50=(11.76±0.09)mmol/L),但高于汤海霞[36]从绵羊乳酪蛋白酶解物中鉴定到的肽LFRQFY(IC50值为(7.9±1.7)μmol/L),说明肽QGPRPQ是一种潜在的ACE抑制肽。

图6 肽QGPRPQ的HPLC图(A)和一级质谱图(B)Fig.6 HPLC (A) and primary mass spectrum (B) of peptide QGPRPQ
2.5 肽QGPRPQ的二级结构解析
傅里叶变换红外光谱在测定蛋白质二级结构时蛋白内部不同的官能团结构会选择性吸收不同的红外波长,产生不同的特征吸收峰。通常利用酰胺I带分析蛋白质二级结构,酰胺I带与蛋白肽链骨架的有序程度紧密相关,酰胺I带吸收峰波数越大,蛋白质结构有序度越高[37]。通过PeakFit v4.12软件拟合肽QGPRPQ的原始光谱(图7),在酰胺I带范围内,拟合了7 个子峰。通过对吸收峰面积变化计算蛋白质二级结构相对含量,得出该肽由22.8%α-螺旋、33.3%β-折叠和43.9%β-转角构成。研究发现,通常肽二级结构中β-转角中含有较多的氢键是较有序、规则的结构[38],表明肽QGPRPQ结构较为稳定。

图7 肽QGPRPQ酰胺I带(1 600~1 700 cm-1)谱图Fig.7 Infrared spectra of amide I band of peptide QGPRPQ (1 600–1 700 cm-1)
2.6 肽QGPRPQ的酶抑制动力学分析
通过Lineweaver-Burk双倒数图探究肽QGPRPQ抑制ACE的动力学模式。如图8和表4所示,Vmax和Km值都随着抑制肽浓度的增加而降低。研究表明,Lineweaver-Burk的双倒数作图若随着抑制物浓度的增加,其Vmax减小、Km增大或减小,则该抑制物的抑制类型属于混合型抑制[39]。另外,混合型ACE抑制肽可以与ACE的活性和非活性位点结合,从而降低了血管紧张素转换酶的催化活性[40]。由此表明,肽QGPRPQ的抑制类型为混合型抑制,这与汤海霞等[36]从绵羊乳酪蛋白筛选出的肽LFRQFY和Zarei等[41]从棕榈仁蛋糕分离出的肽YLLLK、WAFS和GVQEGAGHYALL都属于相同的酶抑制类型。

图8 肽QGPRPQ对ACE的Lineweaver-Burk图Fig.8 Lineweaver-Burk plot for ACE inhibition by peptide QGPRPQ

表4 肽QGPRPQ不同浓度Vmax和Km值Table 4 Vmax and Km values of peptide QGPRPQ at different concentrations
2.7 肽QGPRPQ对HepG2的抑制作用
采用MTT法测定肽QGPRPQ对HepG2细胞的毒性作用,结果如图9所示。随着肽QGPRPQ质量浓度的增加,HepG2细胞的存活率显示下降趋势;当肽质量浓度低于0.01 mg/mL时,HepG2细胞存活率几乎为100%;而当肽QGPRPQ质量浓度达到0.05 mg/mL以上时,细胞存活率均低于90%,表明肽QGPRPQ已明显抑制了HepG2细胞的增殖。综上所述,肽QGPRPQ在质量浓度低于0.01 mg/mL时,对HepG2细胞无毒性作用。

图9 肽QGPRPQ对人肝癌细胞的抑制作用Fig.9 Inhibitory effect of peptide QGPRPQ on human hepatoma cells
3 结论
从辣木籽蛋白酶解产物中分离鉴定到11 条肽序列,其中肽QGPRPQ、PPKKKFRTGV、DPNNFT均具有较好的水溶性,分子对接显示肽QGPRPQ与ACE的S1活性口袋的氨基酸残基紧密结合,与ACE活性中心残基形成氢键和疏水键作用,可以较好地抑制ACE活性,是潜在的ACE抑制肽,其IC50值为(1.15±0.3)mmol/L。该ACE抑制肽的二级结构由α-螺旋(22.8%)、β-折叠(33.3%)和β-转角(43.9%)结构组成,酶抑制模型为混合型抑制,且在质量浓度低于0.01 mg/mL时对HepG2细胞无细胞毒性。本研究为辣木籽蛋白源降压肽的开发利用提供重要的理论参考,但仍需进一步明确不同液体条件下该ACE抑制肽的构效关系,并开展体内降压效果评价。
