负载鳙鱼肽的壳聚糖/三聚磷酸钠和壳聚糖/亚麻籽胶复合纳米颗粒的稳定性和生物相容性评价
2024-01-03郑昌亮陈梦婷曲映红施文正郭晓嘉吴文锦杨玉平
郑昌亮,陈梦婷,汪 兰,曲映红,施文正,石 柳,陈 胜,乔 宇,李 新,郭晓嘉,吴文锦,,杨玉平
(1.湖北省农业科学院农产品加工与核农技术研究所,农业农村部农产品冷链物流技术重点实验室,湖北 武汉 430064;2.上海海洋大学食品学院,上海 201306;3.武汉药品医疗器械检验所,湖北 武汉 430075)
近年来,多肽类药物因其靶向性和治疗效果优于化学药物且副作用少而备受关注[1]。多肽类药物常以口服的形式进入体内。然而,多肽的渗透效率有限,口服后生物利用度低,严重阻碍了多肽的利用[2]。为解决这些问题,人们开发了各种纳米和微米尺度的多肽递送体系。近年来用于多肽递送的主要有聚合物型[3-4]、脂质体型[5-6]、乳液型[7-8]、无机颗粒型[9-10]、蛋白纳米颗粒型[11]等。壳聚糖是一种阳离子天然多糖,由于壳聚糖(chitosan,CS)存在带正电荷的氨基,其酸溶性溶液富含阳离子电荷,因此可以与带负电的交联剂、多糖、蛋白质等物质发生分子间静电吸引,用以包埋递送一些生物活性成分[12]。
封装生物活性的纳米颗粒在食品加工中不可避免地暴露在不同的环境条件下,除了一些本征参数外,离子强度、pH值、贮藏时间对纳米颗粒也有一定的影响[13]。一般认为纳米颗粒的Zeta电位绝对值大于30 mV便可认为具有优异的稳定性[14],在长时间储藏中不会发生解聚等现象;pH值会影响CS的质子化程度,进而对纳米颗粒的稳定性有一定的影响,为了确保溶液中聚阴离子与聚阳离子足够多,pH值应控制在两种聚合物的pKa之间[15];盐的存在会减弱静电作用的强度。Costalat等[16]提出了一种通过调节体系中盐浓度制备CS聚合物的新型可控组装工艺,高浓度NaCl用于溶解聚电解质溶液,当混合两种聚电解质溶液时,由于电解质的静电吸引力作用而没有发生络合。随后利用透析缓慢消除NaCl后,两个对应物之间的静电相互作用逐渐恢复,并形成络合物。
制备负载多肽的CS纳米颗粒必须通过胃肠道进行转运吸收,因此纳米颗粒必须进行细胞毒性实验以评估纳米颗粒的安全性;其次,肠道的转运、渗透、内化量也是评估纳米颗粒性能的重要指标。纳米颗粒的Zeta电位和粒径与渗透吸收密切相关,纳米颗粒粒径越小越容易通过肠细胞黏液层;其次,Zeta电位值越大更易与带负电荷的黏蛋白糖基发生静电相互作用而黏附在上皮细胞上,延长它们在吸收位点的停留时间以增加其生物利用度[17]。Caco-2细胞是一种人克隆结肠腺癌细胞,具有与分化小肠上皮细胞类似的结构和功能,包括微绒毛以及小肠刷状缘上皮相关的酶系,因此在进行体外细胞实验时可以用来模拟体内肠转运现象。除此之外,HT-29细胞也常作为研究纳米颗粒体内渗透的模型。Kim等[18]采用Caco-2和HT-29共同评价CS纳米颗粒的跨细胞转运能力,发现采用高分子质量的交联剂所制得的纳米颗粒具有较高的黏附性和跨细胞渗透性。
本研究主要探究离子强度、pH值、模拟消化和贮藏时间对制备的负载鳙鱼肽(bighead peptides,BCP)壳聚糖/三聚磷酸钠(chitosan/sodium tripolyphosphate-bighead peptides,CS/TPP-BCP)和壳聚糖/亚麻籽胶(chitosan/flaxseed gum-bighead peptides,CS/FG-BCP)纳米颗粒的影响,并以Caco-2细胞为模型,评估CS纳米颗粒处理的胞外乳酸脱氢酶(lactatedehydrogenase,LDH)的含量、体内抗氧化能力和细胞摄取度,以期为多肽类食品药物的工业化应用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
Caco-2细胞 尚恩生物技术有限公司;血清 德国Pan Biotech公司;DMEM培养基 赛默飞世尔科技(中国)有限公司;CS(脱乙酰度≥85%)上海麦克林生化科技有限公司;三聚磷酸钠(sodium tripolyphosphate,TPP)(分析纯)南京化学试剂有限公司;BCP(分子质量<5 kDa)、亚麻籽胶(flaxseed gum,FG)为实验室自制;活性氧(reactive oxygen species,ROS)检测试剂盒、LDH细胞毒性检测试剂盒 上海碧云天生物技术有限公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)北京博奥森生物科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)莫纳生物科技有限公司。
1.2 仪器与设备
Mastersizer 2000激光粒度仪 英国Malvern公司;IX81荧光显微镜 日本Olympus公司;Infinite M200 Pro多功能酶标仪 瑞士Tecan公司;FORMA 371二氧化碳培养箱 美国Thermo Fisher公司;LSM700激光扫描共聚焦显微镜 德国蔡司公司。
1.3 方法
1.3.1 CS纳米颗粒的制备
1.3.1.1 CS/TPP纳米颗粒的制备
根据实验室前期优化的结果制备[19],将CS溶于质量分数为1%的冰醋酸中,搅拌过夜得到CS溶液。用浓度为1 mol/L的NaOH溶液将CS溶液的pH值调整为4,并匀速滴加质量浓度为2 mg/mL的BCP,使CS与BCP质量比为1∶1。然后在磁力搅拌下以CS与TPP质量比为6∶1匀速滴加质量浓度为0.8 mg/mL的TPP溶液,并调整前后pH值使其保持一致,室温下继续磁力搅拌30 min,获得BCP的CS纳米颗粒悬浮液。
1.3.1.2 CS/FG纳米颗粒的制备
参考Rajabi等[20]制备CS/阿拉伯胶纳米颗粒的方法简要修改,将20 mL 0.5 mg/mL CS溶液置于烧杯中,在磁力搅拌下将BCP以1∶1(m/m)的比例加入CS溶液中搅拌,然后加入40 mL 0.5 mg/mL FG溶液,搅拌15 min,以制备负载BCP的CS/FG纳米颗粒。
1.3.2 物理稳定性分析
1.3.2.1 pH值稳定性
用1 mol/L的HCl和NaOH溶液将制备的两种CS纳米颗粒悬浮液的pH值分别调整到1.5、2、3、3.5、4、5、6、7,室温放置过夜后测量纳米颗粒的Zeta电位值、粒径和浊度并观察外观形貌。
1.3.2.2 离子强度稳定性
将制备好的两种CS纳米颗粒的悬浮液和BCP溶液与等体积不同浓度的NaCl溶液混合,最终使得NaCl溶液的浓度分别为0、50、100、150 mmol/L和200 mmol/L,过夜后测量纳米颗粒的Zeta电位和粒径值。
1.3.2.3 模拟消化稳定性
参考栾晓旭等[21]制备模拟消化工作液的方法并简要修改。取稀盐酸16.4 mL,加去离子水800 mL,加入胃蛋白酶10 g,摇匀后加水稀释成1 000 mL即得模拟胃液。取磷酸二氢钾6.8 g,加水500 mL溶解,用0.1 mol/L NaOH溶液调节pH值至6.8。另取胰蛋白酶10 g,加水溶解后将两液混合,然后稀释至1 000 mL即为模拟肠液。将模拟胃液和肠液与纳米颗粒和多肽等体积混合后分别置于37 ℃水浴振荡,固定时间取样1 mL测Zeta电位值和粒径值。
1.3.2.4 贮藏稳定性
将制备好的两种CS纳米颗粒悬浮液和多肽溶液置于室温放置,分别在第0、7、14、21、28天测量Zeta电位值和粒径值。
1.3.3 细胞实验
1.3.3.1 LDH活力检测
将Caco-2细胞培养于96 孔板(5×104个/孔)中,在37 ℃下孵育4 h,取每孔0.5 mL,1×105个/mL的细胞悬液接种于12 孔板中,在5% CO2、37 ℃和95%相对湿度的培养箱中培养24 h后,根据实验分组的情况进行处理和培养。培养结束后收集细胞培养的上清液,根据试剂盒的操作步骤进行LDH活力的检测[22]。
1.3.3.2 细胞内ROS含量检测
调整细胞悬液浓度至1×105个/mL,每孔1 mL接种于12 孔板中,于37 ℃、5% CO2细胞培养箱中培养24 h,根据实验分组情况(空白对照、H2O2处理、CS/TPP-BCP+H2O2处理、CS/FG-BCP+H2O2处理、CS/TPP-BCP处理、CS/FG-BCP处理)进行处理和培养。培养完成后,弃上清液,用PBS洗2 遍,每孔加入100 μL胰酶于培养箱中消化2 min,加入1mL培养基吹打收集细胞,2 000 r/min离心3 min,去上清液,再用PBS洗2 遍,加入200 μL 10 μmol/L 2,7-二氯荧光素二乙酸酯溶液37 ℃避光反应30 min,2 000 r/min离心5 min后弃上清液,PBS洗2 遍,用500 μL PBS重悬细胞,最后用倒置荧光显微镜观察细胞中的荧光强度,激发波长为488 nm,发射波长为525 nm。
1.3.3.3 细胞内化能力检测
使用与1.3.1.1和1.3.1.2节中相同的方法制备FITC标记的CS纳米颗粒,不同的是采用FITC标记肽,参考ZhaoYuanhui等[23]的方法进行标记。
以5×105个/孔的密度培养Caco-2细胞,将纳米颗粒孵育2 h。取出样品,然后用预热的PBS洗涤细胞。将洗涤后的细胞固定在4%多聚甲醛溶液中,并用碘化丙啶(propidium iodide,PI)复染后使用LSM700激光扫描共聚焦显微镜检查细胞。其中,激发波长为488 nm,发射波长为525 nm。
1.3.4 粒径、电位的测定
参考Butstraen等[24]的方法并简要修改。通过基于动态光散射方法对BCP的CS纳米颗粒进行表征。测量前将BCP的CS纳米颗粒悬浮液用去离子水稀释10 倍,取0.8 mL样品于25 ℃下使用粒径电位仪测量电位。取未稀释的悬浮液1 mL测量粒径和多分散性指数(polydispersity index,PDI),平衡时间为60 s。
1.3.5 浊度的测定
取1.3.2.1节中不同pH值的纳米颗粒悬浮液2 mL,使用紫外-可见分光光度计在500 nm波长处测量溶液的浊度,评价样品溶液的分散稳定性。
1.4 数据处理
所有处理均重复3 次,使用SPSS程序进行方差分析确定各组之间的差异显著性,并使用Origin 2018软件进行绘图。
2 结果与分析
2.1 pH值稳定性分析
如图1a所示,随着pH值的升高,纳米颗粒的浊度呈现增长的趋势,这一变化也体现在外观图1b中。当pH值升高到6时出现絮凝现象,pH值为7时絮凝现象更严重,同时由图1c可知,在pH值为6和7时粒径增大至1 774.3 nm和2 145.7 nm。出现这种现象的原因与CS的质子化有关。当pH值在6~7时,接近CS的等电点(≈6.5),其质子化程度低,粒子间聚集作用增强导致粒子析出[25]。Zeta电位值反映了纳米颗粒的稳定性,从图1d可以发现,在较低pH值下纳米颗粒的Zeta电位绝对值均在30 mV以上,说明纳米颗粒稳定,不会出现聚集絮凝等现象。随着pH值的逐渐升高,Zeta电位逐渐变小,当pH值为7时出现负值。从Zeta电位值的变化趋势也可以看出在接近中性环境下纳米颗粒稳定性较差。
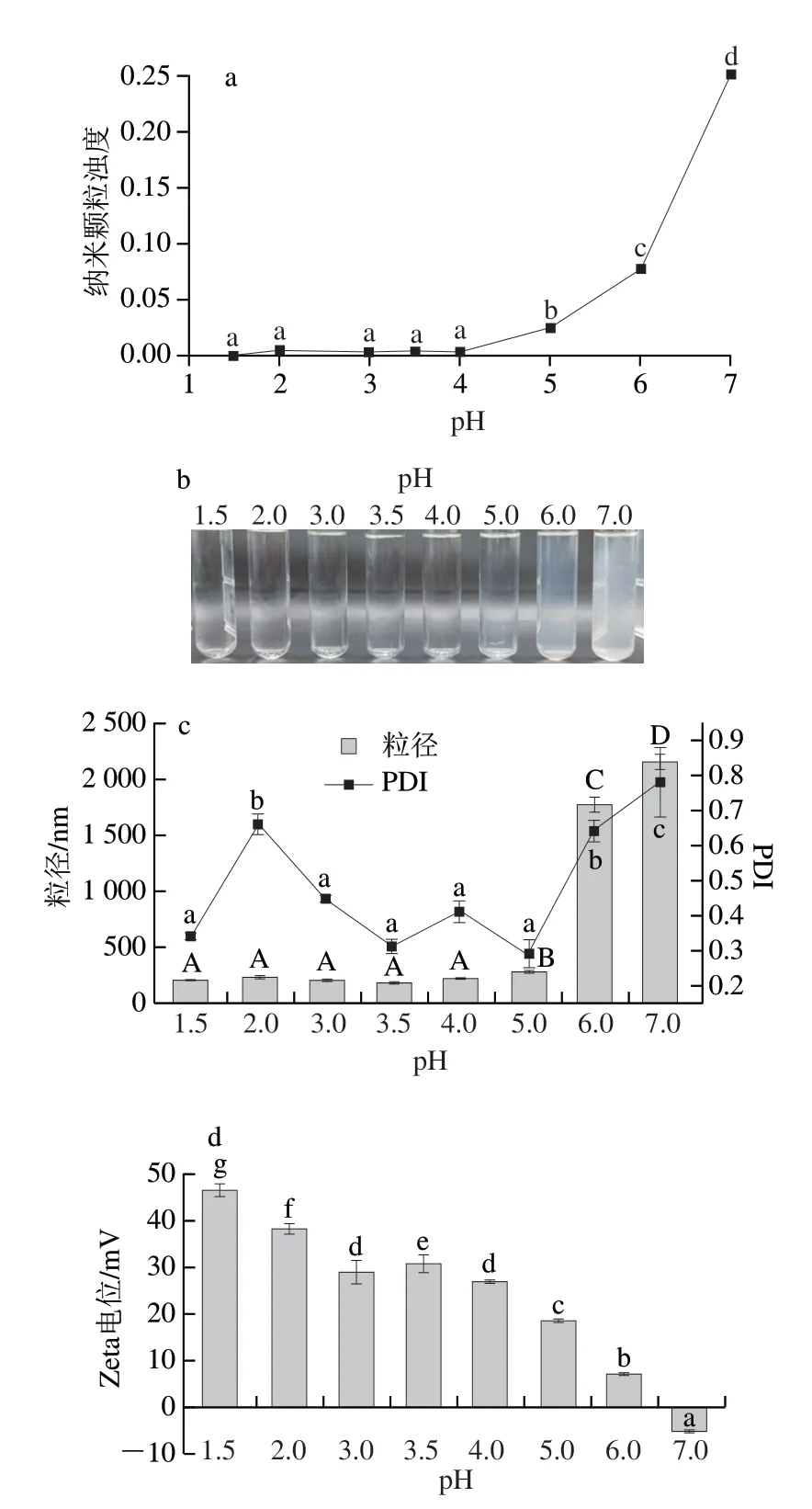
图1 pH值对CS/TPP纳米颗粒浊度(a)、外观(b)、粒径(c)和Zeta电位(d)的影响Fig.1 Effect of pH on turbidity (a),appearance (b),particle size (c) and zeta potential (d) of chitosan/sodium tripolyphosphate nanoparticles
由图2a可知,与CS/TPP-BCP纳米颗粒相同的是随着pH值的升高浊度也呈现上升趋势。但是在pH值为3时CS/FG-BCP纳米颗粒就出现轻微的混浊(图2b),可能原因是FG的等电点比CS低。在较低pH值下,羧基会首先质子化,从而降低了FG的溶解度,导致纳米颗粒析出[13]。图2c表明粒径也随着pH值的升高而增大。从图2d发现,pH值小于3时的Zeta电位值均比pH值大于3时高,说明CS/FG-BCP纳米颗粒在极酸性条件下比在中性条件下更稳定。
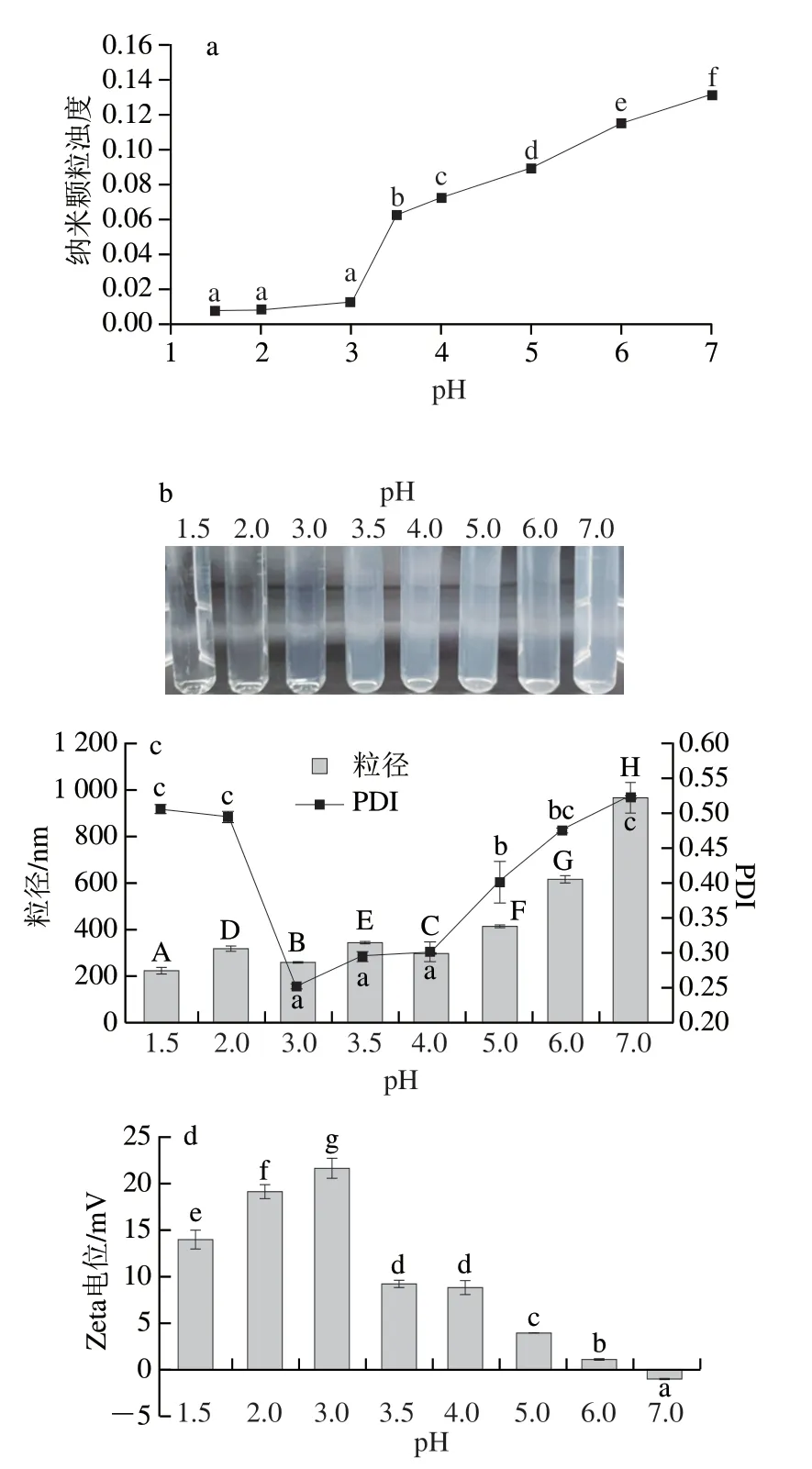
图2 pH值对CS/FG纳米颗粒浊度(a)、外观(b)、粒径(c)和Zeta电位(d)的影响Fig.2 Effect of pH on turbidity (a),appearance (b),particle size (c) and zeta potential (d) of chitosan/flaxseed gum nanoparticles
2.2 离子强度稳定性分析
离子强度对纳米颗粒的影响如图3所示,BCP、CS/TPP-BCP和CS/FG-BCP纳米颗粒的初始粒径值分别为510.2、152.1 nm和136 nm,且粒径值均随着NaCl浓度的增加而升高,当NaCl浓度增加至200 mmol/L时,粒径分别增加至1 013.5、239.5 nm和440.7 nm。溶液中存在的反离子(Na+和Cl-)会中和纳米颗粒上的电荷,削弱液滴之间的静电排斥,引发粒子间聚集[26]。与CS/FG-BCP纳米颗粒相比,CS与TPP之间的交联较强,受离子强度的影响较小,在NaCl浓度从50 mmol/L增加到200 mmol/L过程中粒径没有显著变化。BCP Zeta电位值对NaCl浓度变化不敏感。两种CS纳米颗粒的Zeta电位绝对值均随着浓度的增加而降低,Zhu Yiqing等[27]研究NaCl浓度对负载含硒肽黄原胶/溶菌酶纳米颗粒稳定性的影响时得出与此相同的结论。Zeta电位绝对值的降低也证实了液滴间静电排斥减弱,随着NaCl浓度增加,CS/TPP-BCP纳米颗粒的电位绝对值始终高于CS/FG-BCP纳米颗粒,这也印证了CS与TPP之间的静电作用强于FG。
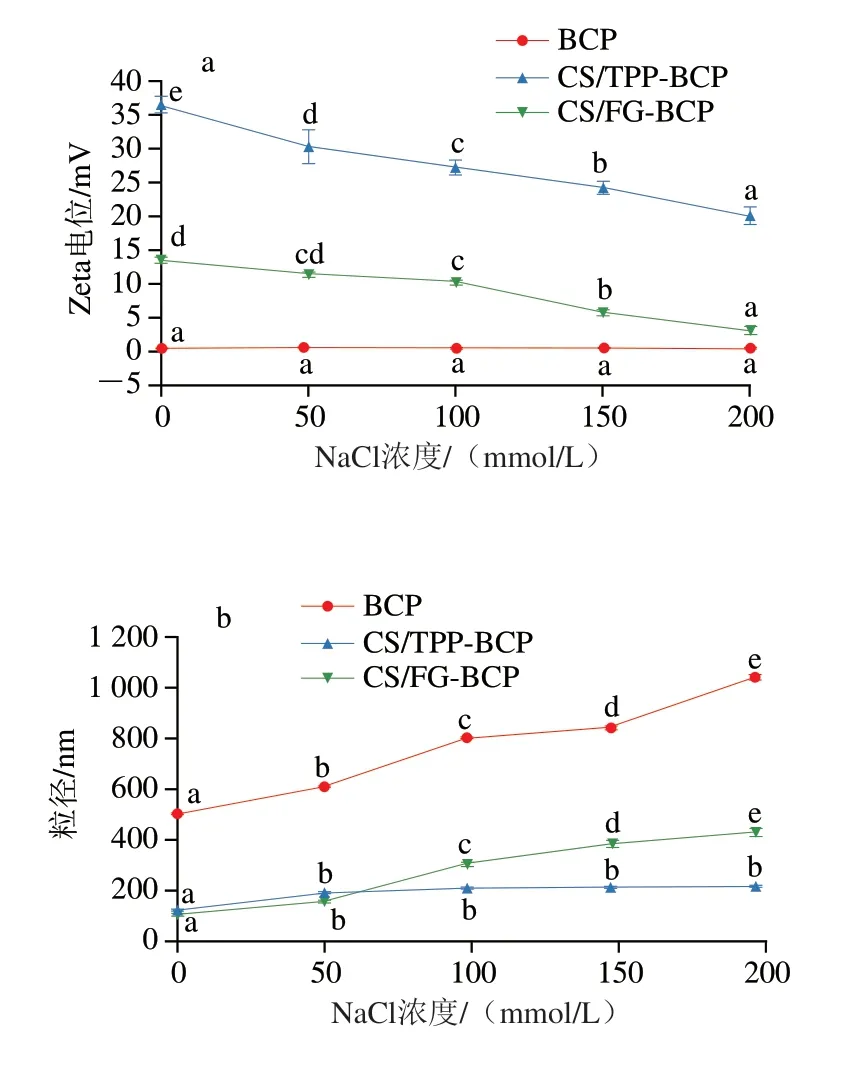
图3 NaCl浓度对CS纳米颗粒Zeta电位(a)和粒径(b)的影响Fig.3 Effect of NaCl concentration on zeta potential (a) and particle size (b) of chitosan nanoparticles
2.3 模拟消化稳定性分析
利用体外模拟消化体系对BCP和两种CS纳米颗粒的稳定性进行了评估。如图4所示,CS/TPP-BCP和CS/FGBCP纳米颗粒的Zeta电位值在模拟消化过程中均显著下降(P<0.05),证明模拟消化对纳米颗粒的稳定性具有一定的影响。在模拟消化过程中CS/TPP-BCP纳米颗粒的Zeta电位值始终高于CS/FG-BCP纳米颗粒,且在模拟消化过程中CS/TPP-BCP纳米颗粒的粒径没有显著变化,这再次证实了CS/TPP-BCP纳米颗粒的稳定性优于CS/FG-BCP纳米颗粒,与pH值和离子强度对纳米颗粒稳定性影响的结果一致。由于CS/FG-BCP纳米颗粒的不稳定性,在胃肠的模拟消化过程中粒径呈现先增加后减小的趋势。粒径在模拟胃阶段显著增加,这与胃蛋白酶介导的水解从而降低了纳米颗粒表面的静电排斥有关[28]。进入模拟肠液后粒径显著性降低,且在4 h内没有显著性变化,这与模拟肠液中胰蛋白酶的存在促进了胶体间结构的形成有关[29]。Liu Qianyuan等[26]探究模拟消化对玉米醇溶蛋白/褐藻糖胶基纳米颗粒的影响时得出与此相同的结论。与BCP相比,纳米颗粒在模拟消化过程中具有更高的稳定性,也说明纳米颗粒在一定程度上对BCP具有保护作用。
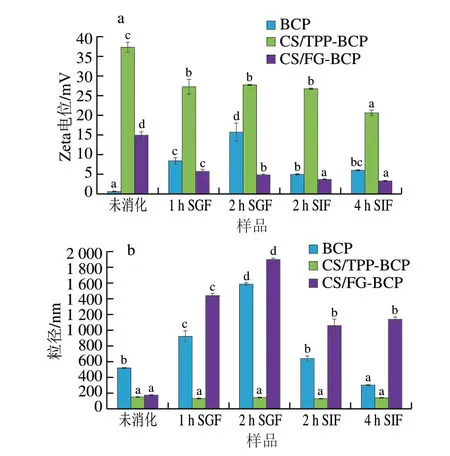
图4 模拟消化对不同样品Zeta电位(a)和粒径(b)的影响Fig.4 Effect of simulated digestion on zeta potential (a) and particle size (b) of different samples
2.4 贮藏稳定性分析
如图5所示,BCP在贮藏过程中粒径显著增加,Zhu Yiqing等[27]研究贮藏时间对含Se肽粒径的影响时得出与此相同的结论。与BCP相比,两种纳米颗粒在贮藏过程中Zeta电位值均保持在较高水平,粒径也没有显著变化,说明经两种具有相反电荷的聚合物包封后能够提高BCP的稳定性。
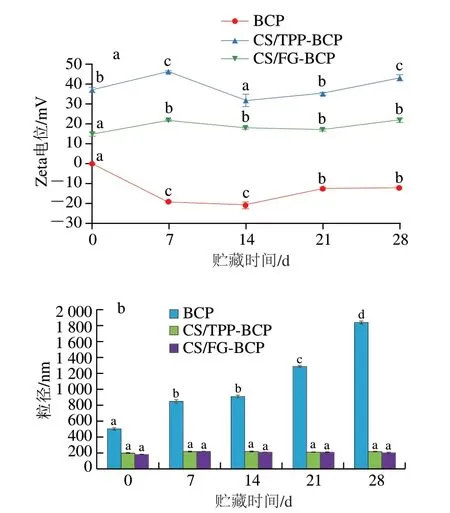
图5 贮藏时间对不同样品颗粒Zeta电位(a)和粒径(b)的影响Fig.5 Effect of storage time on zeta potential (a) and particle size (b) of different samples
2.5 LDH释放量分析
细胞培养液中LDH含量可以反映细胞膜的破损程度,当细胞膜破损时,存在于细胞质基质中的LDH就会释放到细胞培养液中,所以培养液中LDH含量越高表明细胞膜的破损程度越高。由图6可知,在较低质量浓度下,BCP和两种CS纳米颗粒处理后的上清液中LDH含量与对照组没有显著差异(P<0.05),说明在较低质量浓度下BCP和两种CS纳米颗粒不会对细胞的生长造成影响,具有较高的生物相容性。
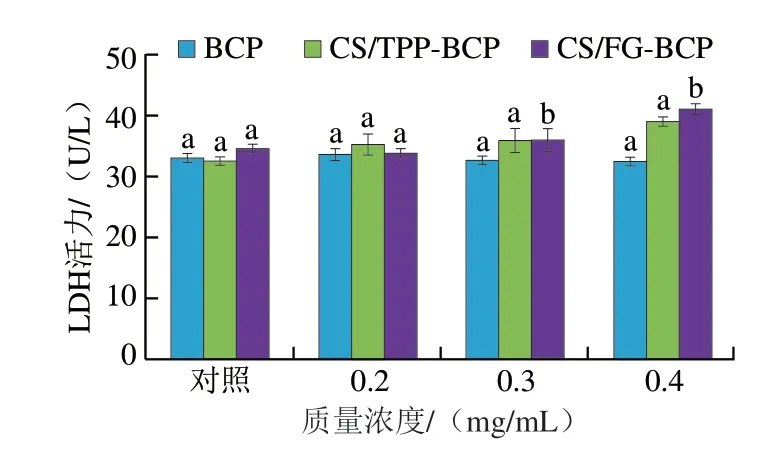
图6 Caco-2细胞上清液中LDH活力Fig.6 LDH activity of Caco-2 cell supernatant
2.6 细胞内ROS含量检测
细胞内的ROS是代谢活动的产物,当体内积累过量的ROS时会对机体造成氧化损伤。图7中绿色荧光的强度反映了细胞内ROS含量多少,由图7可知,经H2O2诱导后的细胞内产生了较强的荧光,表明细胞内存在大量的ROS。当用BCP和两种CS纳米颗粒处理后细胞内ROS的含量明显降低,表明BCP和两种CS纳米颗粒均具有抗氧化能力。与BCP相比,两种CS纳米颗粒处理的细胞内ROS含量较低,说明两种纳米颗粒的抗氧化稳定性优于BCP,这与体外抗氧化实验的数据一致。刘钱媛[30]研究负载紫檀芪的玉米醇溶蛋白-褐藻糖胶纳米颗粒时发现,经过负载后纳米颗粒的抗氧化能力优于未负载的紫檀芪,与本实验的结果类似。
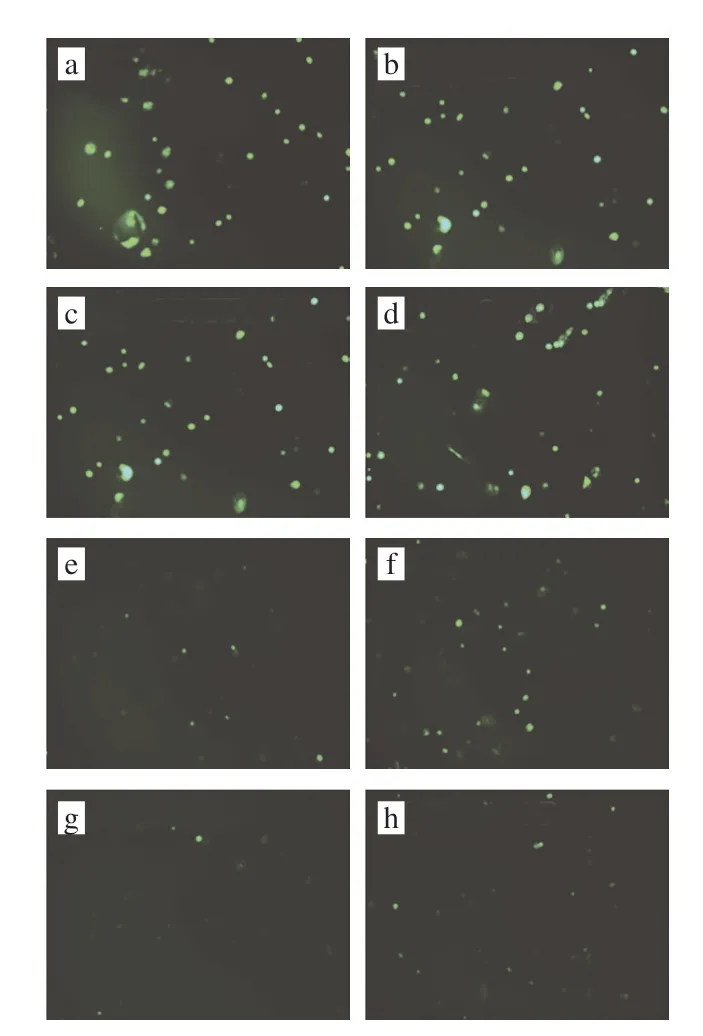
图7 BCP和CS纳米颗粒对细胞中ROS含量的影响Fig.7 Effects of BCP and chitosan nanoparticles on intracellular ROS content
2.7 细胞内化能力分析
游离肽和两种CS纳米颗粒的细胞荧光图如图8所示。与游离肽相比,经过CS纳米颗粒负载后多肽的荧光强度增加,这表明CS纳米颗粒比游离肽更容易被细胞摄取。CS/TPP-BCP纳米颗粒荧光强度强于CS/FG-BCP纳米颗粒,说明细胞对CS/TPP-BCP纳米颗粒的摄取度高于CS/FG-BCP纳米颗粒,这可能与CS/TPP-BCP的电位较高有关(37.3 mV>20.1 mV)。
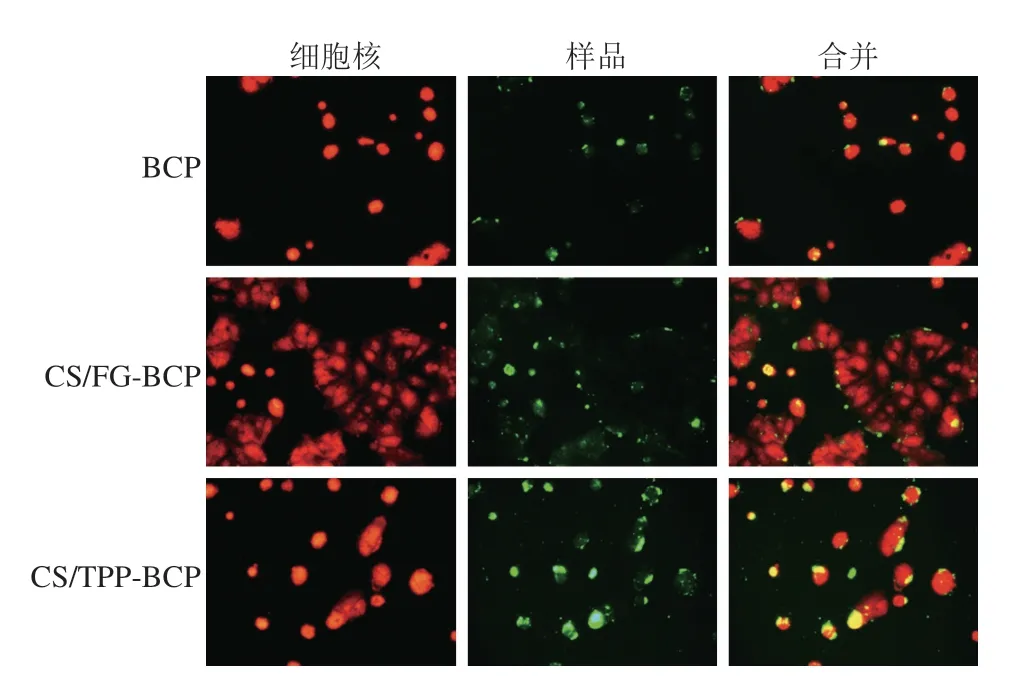
图8 游离肽和CS纳米颗粒的细胞荧光图Fig.8 Fluorescence images of free peptides and chitosan nanoparticles
3 结论
本研究分析了负载BCP的CS/TPP-BCP和CS/FG-BCP纳米颗粒在不同pH值、离子强度、模拟消化和贮藏过程中的稳定性。并以Caco-2细胞为模型,探究了两种CS纳米颗粒和BCP对细胞外LDH释放量和细胞内ROS含量的影响,并测定了细胞对两种纳米颗粒的摄取度。具体结论如下:酸性条件下两种纳米颗粒具有较高的稳定性,Na+和Cl-会削弱液滴之间的静电排斥,引发粒子间聚集,经CS纳米颗粒包封后提高了BCP的稳定性;细胞实验证实了两种纳米颗粒具有较高的生物相容性和体内抗氧化能力,增强了BCP在小肠上皮细胞的渗透性。
