氯化钙对宰后成熟期间滩羊肉能量水平及品质的影响
2024-01-03陈雪妍罗瑞明王金霞胡丽筠
陈雪妍,罗瑞明,张 倩,王金霞,李 荣,胡丽筠
(宁夏大学食品与葡萄酒学院,宁夏 银川 750000)
CaCl2能改善宰后肉的pH值、颜色、嫩度等相关性状。高永芳[1]发现CaCl2处理使宰后成熟过程中高海拔牦牛肉能量代谢水平高于低海拔西杂牛肉,同时显著加快了宰后肌肉糖酵解活动,对肉的嫩度造成影响。姜珊珊等[2]在宰后1.5 h对猪背最长肌注射肉质量5%的水及200 mmol/L CaCl2溶液。结果表明,在成熟过程中,注水及CaCl2溶液会加速糖酵解进程,降低猪背最长肌内的总色素含量,并使高铁肌红蛋白的相对百分含量升高,进而加速猪背最长肌的褪色,这对其在成熟过程中保持鲜嫩肉质及色泽不利。Wheeler等[3]在牛肉宰后24 h内以5%或10%肉质量的200 mmol/L或250 mmol/L CaCl2进行注射,比较了牛肉品质性状的变化。发现在宰后24 h内以5%肉质量注入200 mmol/L CaCl2溶液可以显著降低牛肉剪切力且不会影响零售肉的颜色、适口性和其他特性。目前,关于CaCl2对宰后鲜肉贮藏期间的品质调控已有大量研究,但对宰后成熟期间滩羊肉变化的影响鲜有报道。因此,探究CaCl2对宰后成熟期间滩羊肉能量水平和品质的影响至关重要。
本实验以滩羊后腿肉为研究对象,采用200 mmol/L CaCl2溶液进行注射,在0~4 ℃条件下成熟0、2、4、6、8 d,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)和蛋白免疫印迹法(Western blot,WB)对磷酸果糖激酶(phosphofructokinase,PFKM)蛋白表达情况进行分析,以此验证糖酵解途径是否被激活。并测定宰后成熟期间滩羊肉的pH值、糖原含量、乳酸含量、肉色、保水性、剪切力和肌原纤维小片化指数(myofibril fragmentation index,MFI)值,阐明滩羊肉成熟期间糖酵解程度与能量水平的关系,进一步探究宰后成熟期间滩羊肉能量水平的变化对肉品质的影响。
1 材料与方法
1.1 材料与试剂
饲养条件相同的阉割公滩羊(6 月龄)盐池县大夏牧场清真食品有限公司;PFKM抗体、过氧化物酶标记的羊抗鼠二抗 英国Abcam公司;糖原含量检测试剂盒、乳酸含量检测试剂盒 北京索莱宝科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;氯化镁、氯化钾、氯化钙 四川西陇化工有限公司;磷酸氢二钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)天津市大茂化学试剂厂。
1.2 仪器与设备
PHSJ-3F便携式pH计 上海精科仪器有限公司;BCD-215TDGA冰箱 上海申安医疗器械厂;YXQ-SG46-280S分析天平 上海梅特勒-托利多仪器有限公司;H-SY2L-NI6-C恒温水浴锅 北京长源试验设备厂;JXFSTPRP-24研磨仪 上海净信科技有限公司;TGL-16M型冷冻离心机 湘仪离心机仪器有限公司;UV-1200可见分光光度计 上海美谱达仪器有限公司;C300化学发光系统 美国Azure公司;WIX-EP300垂直电泳仪 北京韦克斯科技有限公司;TA-XTplus12587质构仪 英国Stable Micro System公司。
1.3 方法
1.3.1 样品采集
从宁夏盐池县的大夏牧场清真食品有限公司随机选择6 月龄、饲养条件相同的阉割公滩羊,采用传统方式宰杀后取滩羊后腿,共15 只(每个贮藏阶段需3 只羊后腿),去除脂肪、结缔组织和筋膜,将每份样品分割成250 g肉样。样品共分为3 组:处理组按肉质量的5%对肉样注射200 mmol/L CaCl2溶液,对照组注射等量的蒸馏水,空白组不注射,将其编号后放入聚乙稀薄膜包裹锡纸,于0~4 ℃条件下成熟8 d,分别于成熟0、2、4、6、8 d采样,于-80 ℃保存,以确定其能量水平和品质变化。
1.3.2 WB检测
1.3.2.1 肌肉中全蛋白提取
参考Antonella等[4]的方法并稍作改动,将10 pL磷酸酶抑制剂、1 pL蛋白酶抑制剂及10 μL 100 mmol/L PMSF溶液添加到1 mL低温裂解缓冲液,混合均匀,并在冰上冷藏备用。将100 mg固体组织放入培养皿中,切碎成3 mm×3 mm左右的小块,然后加入0.5~1 mL冷裂解缓冲液,用玻璃包浆器上下手动匀浆30~50 次,低温操作;将组织匀浆转移至经冷却的1.5 mL离心管中,4 ℃、12 000 r/min离心5 min,将上清液移入一个新的、预先冷却的离心试管,得到完整的蛋白质提取液,进行蛋白质定量分析(Bradford法、BCA法);为防止再次冻结和融化,分开于-70 ℃保存。
1.3.2.2 蛋白浓度测定
采用BCA试剂盒测定。
1.3.2.3 WB测定
参考SDS-PAGE制胶试剂盒进行制胶。配电泳液(Tris 3.028 g、甘氨酸 14.4 g、SDS 1 g,去离子水加至1 000 mL);取适量蛋白加入上样缓冲液95 ℃煮沸变性10 min;将两块胶板固定在跑胶架上,在两胶板中间倒入电泳液检漏,检查无误后,将胶板架置于电泳槽内,注入电泳液,取出梳子;第一孔放入3 μL蛋白标准品,其余孔依次放入蛋白质样本,在80 V电泳40 min,使蛋白进入分离胶后,将其设置为100 V,跑开分离胶约60 min;为了避免边缘效应,最后一孔可加废蛋白。Tris 3.3 g、甘氨酸14.42 g、甲醇200 mL,加入去离子水至1 000 mL配制转膜液,转膜完成后,取下胶板并浸泡在转膜液中,轻启胶板,按蛋白标准品的说明,切割出所需要尺寸的目标条带;将用于转膜的滤纸浸泡在循环利用的转膜液中,剪好聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,并作好标记,将准备好的PVDF膜在甲醇中浸泡5 min;用湿转的方法转膜,采用三明治法将膜夹好,将夹板放入转印槽中,加入转膜液,放入冰袋,将转印槽放入提前准备好的冰盒中,80 V转膜2 h。2 g脱脂奶粉和40 mL Tris含吐温-20缓冲盐溶液(Tris buffered saline with Tween-20,TBST)配制封闭液;将膜取出,于TBST中冲洗两次,再加入封闭液使其没过膜,在摇床上缓慢摇动封闭1 h;封闭结束后,去除封闭液,加入TBST并放置脱色摇床上振荡清洗膜表面残留的封闭液,洗膜3 次,每次10 min。最后进行孵育抗体,孵育一抗,按要求配制适当浓度的抗体,将膜孵育一抗后于4 ℃过夜;用TBST洗膜3 次,每次10 min;孵育二抗,根据要求配制合适浓度的抗体,通常是2 μL抗体和10 mL 5%的脱脂奶粉。在室温下,将洗好的膜用二抗孵育2 h后,用TBST洗5 次,每次10 min。按照说明书调配发光液,在凝胶成像仪中显色、拍照。
1.3.3 pH值测定
参考郭荣珍等[5]的方法并稍作修改,剔除样品的脂肪和结缔组织,使用标准溶液对pH计进行校正。称取5 g样品,添加45 mL去离子水,均质1 min,静置30 min,过滤,测定滤液的pH值。
1.3.4 糖原、乳酸含量的测定
取待测样品0.1 g,实验操作按照糖原、乳酸含量检测试剂盒要求进行,在620 nm波长处使用紫外分光光度计测定。
1.3.5 色泽的测定
取适量肉样,用色差仪测定L*、a*、b*值。测量前用白板校正色差仪,光源设定为D65。将肉样切成直径7 cm左右的圆形,分别在3 个不同位置做平行测定,每个样品重复测定3 次,取平均值。
1.3.6 离心损失的测定
参考刘吉娟等[6]方法并稍作修改。准确称取1 g肉样,记为m1,将其放入2 mL离心管内,4 ℃、8 000 r/min离心10 min,取出样品,用吸水纸吸干表面水分,称质量,记为m2,按照式(1)计算离心损失:
1.3.7 蒸煮损失的测定
参考李文博[7]的方法,取约20 g切除油脂的肉样,用分析天平准确对其称质量,记为m1,用蒸煮袋密封,在75 ℃水浴锅中煮至中心温度达到70 ℃时取出,待冷却至室温后,将其表面水分擦干,并将此时肉样的质量记为m2。对每个样品进行3 次测定,计算平均值。带入式(2)计算:
1.3.8 MFI值的测定
参考罗辉等[8]的方法,并稍作修改。取样品0.5 g,用缓冲液(0.02 mol/L磷酸氢二钠、0.001 mol/L氯化镁、0.001 mol/L EDTA、0.1 mol/L氯化钾,pH 7.1)按体积比1∶10稀释得到待测溶液,在4 ℃、65 Hz条件下匀浆15 s,4 ℃、3 000 r/min离心15 min,去除上清液,取沉淀重复一次。将沉淀物与5 mL缓冲液混合,将悬浊液用200 目尼龙滤网过滤,得到肌原纤维蛋白溶液。用BCA法测定所得溶液的蛋白含量,在540 nm波长处测吸光度,与之相乘200得到MFI值。
1.3.9 剪切力的测定
参考王超[9]的方法取长×宽×高不低于6 cm×3 cm×3 cm的肉样,将其放入蒸煮袋内,在1 500 W、80 ℃的恒温水浴锅中对其进行加热,当肉的中心温度达到70 ℃时,取出冷却10 min,擦干表面水分。沿肌纤维方向,用直径为1.27 cm的采样器插取样本,探头距离为25 mm,速率为60 mm/min,在与肌纤维垂直的方向上,每块肉样在剪切力仪下被剪切3~4 次。
1.4 数据分析
2 结果与分析
2.1 滩羊肉成熟期间PFKM蛋白的表达情况
PFKM是最重要的糖酵解酶之一,PFKM蛋白的聚集程度可以反映糖酵解受到激活的程度,因此,对PFKM蛋白进行WB检测验证CaCl2注射对糖酵解途径的激活作用。PFKM蛋白在成熟0、4、8 d的蛋白印迹结果如图1所示。处理组PFKM蛋白的条带最深,对照组次之,空白组的条带最浅。PFKM蛋白在成熟期间蛋白表达量如图2所示,滩羊空白组、对照组和处理组PFKM蛋白的表达量随成熟时间的延长逐渐增加,且PFKM蛋白表达量由高到低分别为处理组、对照组、空白组。表明CaCl2促进了PFKM蛋白在成熟期间聚集,有效验证了糖酵解途径被CaCl2激活。

图1 CaCl2注射对成熟期间滩羊肉糖酵解途径关键蛋白表达情况的影响Fig.1 Effect of CaCl2 injection on the expression of key proteins in the glycolysis pathway in Tan sheep meat during postmortem aging
2.2 CaCl2注射对成熟期间滩羊肉pH值的影响
从表1可以看出,在成熟期的3 组滩羊肉样的pH值都表现出了先降低后升高的趋势,在成熟期0~2 d,羊肉空白组、对照组和处理组的pH值都显著降到最低(P<0.05),分别为5.59、5.54、5.44,随后缓慢上升;成熟2~8 d期间,处理组pH值显著低于空白组和对照组(P<0.05),原因可能是肌糖原通过糖酵解过程产生乳酸,处理组的糖原分解速率比空白组和对照组快,乳酸产生量也更高[10],除此之外,三磷酸腺苷(adenosine triphosphate,ATP)水解生成的磷酸会造成酸性物质在很长时间内不能被分解和运输,从而造成pH值快速下降[11]。2 d时处理组pH值与空白组和对照组相比分别低2.76%、1.81%,成熟2 d内羊肉空白组、对照组和处理组pH值的下降率分别为5.41%、5.78%、7.34%。由此可得,CaCl2处理加速宰后滩羊肉pH值下降至最低,增加乳酸、磷酸的积累。2~8 d肌肉中的酸性物质逐渐被分解代谢,pH值开始回升。

表1 CaCl2注射对成熟期间滩羊肉pH值的影响Table 1 Effect of CaCl2 injection on pH of Tan sheep meat during postmortem aging
2.3 CaCl2注射对成熟期间滩羊肉糖原、乳酸含量的影响
在宰后成熟过程中,肌肉内正常的氧气供应被破坏,能量代谢从有氧氧化转变为无氧糖酵解。糖原和乳酸是糖酵解反应的底物和产物,二者的含量变化可以直接反映出糖酵解水平和速率[12]。由图3a可知,3 组滩羊肉样的糖原含量在宰后0~8 d逐渐下降,表明宰后滩羊肉中糖原含量逐渐减少,8 d时羊肉空白组、对照组和处理组糖原含量分别降至2.52、2.01 mg/g和1.41 mg/g。在0~4 d内,羊肉空白组、对照组和处理组的糖原含量均显著降低且下降率分别为55.44%、60.22%、80.76%(P<0.05)。处理组糖原含量在0~8 d均低于空白组和对照组。表明CaCl2可提高滩羊宰后糖酵解程度,促进糖原的分解速度;由图3b可以看出,3 组滩羊肉样的乳酸含量随成熟时间的增加均呈先升后降的趋势。在成熟4 d,羊肉空白组、对照组和处理组乳酸含量均显著上升到最高值为12.15、13.15、14.39 μmol/g(P<0.05),分别增长了5.40、8.10、8.72 μmol/g。由此可得,成熟4 d处理组乳酸含量高于空白组、对照组,CaCl2增加了宰后早期乳酸的生成,加速滩羊肉糖酵解。

图3 CaCl2注射对成熟期间滩羊肉糖原(a)和乳酸(b)含量的影响Fig.3 Effect of CaCl2 injection on glycogen (a) and lactate (b) contents of Tan sheep meat during postmortem aging
2.4 CaCl2注射对成熟期间滩羊肉色泽的影响
色泽是羊肉品质的关键指标,不仅影响羊肉的经济价值,还影响着消费者的购买欲望[13]。如表2所示,随着成熟时间的延长,3 组滩羊肉样的L*值均呈现先增大后减小的趋势。羊肉在成熟0~2 d,羊肉空白组、对照组和处理组L*值均显著上升并达到最大值,分别为51.13、53.53、45.99(P<0.05),上升率分别为24.77%、17.52%、12.78%,随后均呈下降趋势。成熟0~8 d,对照组L*值均高于空白组和处理组,2 d时处理组比空白组和对照组分别低10.05%、14.08%。成熟4~8 d,羊肉空白组、对照组和处理组L*值逐渐下降且下降率分别为6.49%、10.17%、7.83%。由此可得,注水增加了滩羊肉成熟过程的L*值,CaCl2溶液对宰后滩羊肉的L*值影响较小;3 组滩羊肉样的a*值总体呈现持续下降的趋势。与0 d相比,成熟至8 d的羊肉空白组、对照组和处理组a*值分别显著下降了16.84%、18.93%和25.37%(P<0.05),表明宰后0~8 d,CaCl2降低了滩羊肉的a*值;3 组滩羊肉样的b*值总体呈现持续上升的趋势。与0 d相比,成熟8 d的羊肉空白组、对照组和处理组b*值均显著上升至达到最大值7.84、8.16、7.96(P<0.05),上升率分别为155.37%、141.42%、162.70%,表明CaCl2处理加速了宰后滩羊肉b*值的上升。
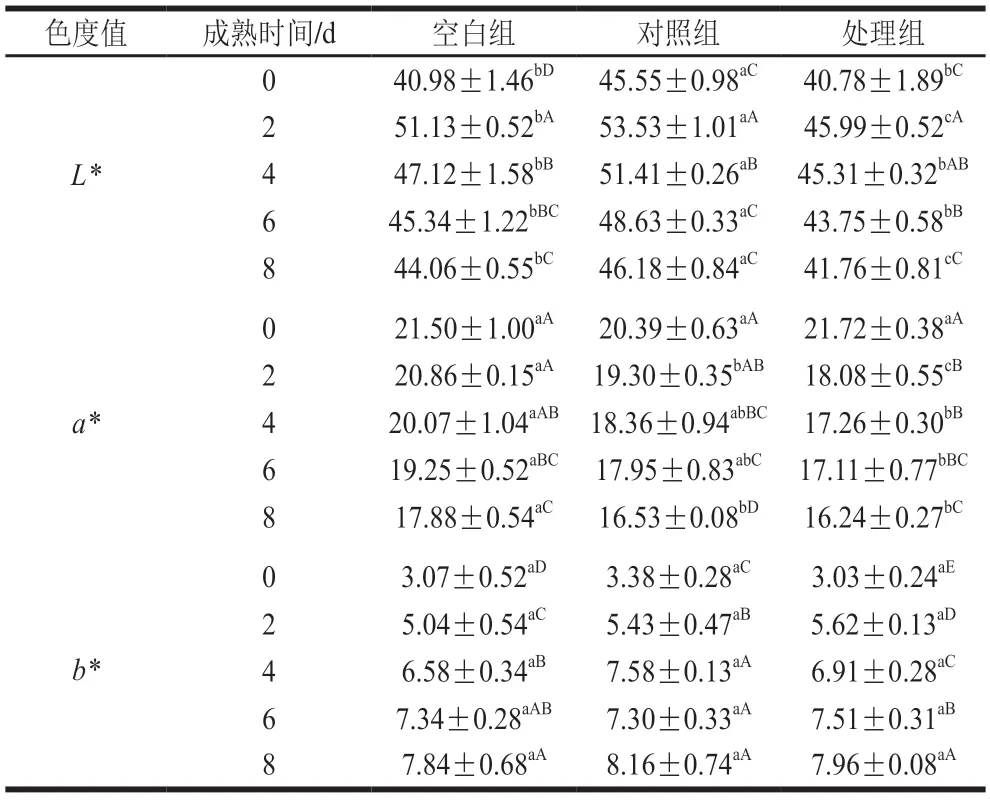
表2 CaCl2注射对成熟期间滩羊肉色泽的影响Table 2 Effect of CaCl2 injection on color of Tan sheep meat during postmortem aging
2.5 CaCl2注射对成熟期间滩羊肉保水性的影响
保水性与肉色、嫩度、口感等其他品质性状有极大关联,通常用离心损失、蒸煮损失等来体现,表示外加离心力或者蒸煮处理时鲜肉保持自身水分或添加水分的能力,离心损失、蒸煮损失越大,肌肉截留水分的能力越差[14]。宰后滩羊肉成熟过程中保水性指标的变化如表3所示。随成熟时间的延长,3 组滩羊肉的离心损失呈逐渐上升的趋势,在8 d达到最大值,处理组的离心损失于2~8 d均高于空白组和注水组;成熟期间,3 组滩羊肉的蒸煮损失呈先上升后下降的趋势,其中空白组和处理组在成熟0~4 d显著上升并达到最大值27.78%、30.68%(P<0.05),4~8 d平缓下降。对照组成熟0~2 d显著上升并达到最大值29.92%(P<0.05),2~8 d逐渐下降。处理组的蒸煮损失于2 d高于空白组8.59%,低于对照组2.77%。由此可得,注水和CaCl2溶液会增加滩羊肉成熟2 d内的蒸煮损失,加速水分的流失,降低保水性。

表3 CaCl2注射对成熟期间滩羊肉保水性的影响Table 3 Effect of CaCl2 injection on water-holding capacity of Tan sheep meat during postmortem aging
2.6 CaCl2注射对成熟期间MFI值的影响
MFI值是反映羊肉品质的重要指标,从肌原纤维的降解程度可以判断出肉的嫩度,肌原纤维蛋白降解程度越高,嫩度越好[10]。由图4所示,处理组MFI值在成熟0~8 d显著增加(P<0.05),空白组和对照组MFI值在0~2 d显著增加(P<0.05),羊肉空白组、对照组和处理组的MFI值均呈持续上升趋势且在8 d分别达到最大值109.63、120.26、140.47。同时,除了成熟期0~2 d,处理组MFI值均显著高于空白组和对照组(P<0.05),与空白组和对照组相比,8 d时处理组MFI值分别提高了28.13%、16.81%。CaCl2在成熟过程中加快羊肉肌原纤维断裂和的降解,促进肉的嫩化。

图4 CaCl2注射对成熟期间滩羊肉MFI的影响Fig.4 Effect of CaCl2 injection on MFI of Tan sheep meat during postmortem aging
2.7 CaCl2注射对成熟期间剪切力的影响
剪切力是测定肉类嫩度的方法之一,嫩度决定着肉制品适口性,剪切力与肌肉嫩度呈负相关[15]。3 组滩羊肉成熟过程中剪切力值的变化如图5所示。羊肉成熟期间,3 组滩羊肉的剪切力值都先上升后下降。成熟时间0~2 d,羊肉空白组、对照组和处理组均显著升高至最大值55.23、51.35、49.26 N(P<0.05),上升率分别为15.61%、11.53%、7.77%,随后均逐渐下降。处理组剪切力值在整个成熟期均低于空白组和对照组,8 d时处理组剪切力值比空白组和对照组分别低31.54%、15.40%。综上所述,CaCl2注射使羊肉有更低的剪切力值,因此肉的嫩度好。

图5 CaCl2注射对成熟期间滩羊肉剪切力的影响Fig.5 Effect of CaCl2 injection on shear force of Tan sheep meat during postmortem aging
3 讨论
本研究采用CaCl2溶液对宰后成熟期间的滩羊后腿肉进行处理,WB结果显示PFKM蛋白的表达量被显著提高,验证了糖酵解被激活。在宰杀后,由于肌肉内部缺血、缺氧,导致能量供给不充分,为了维持ATP含量,骨骼肌能量代谢系统将其维持在宰杀前的水平,二磷酸腺苷(adenosine diphosphate,ADP)在肌酸激酶的作用下被转换成肌酸及ATP,同时糖原经糖酵解及氧化代谢生成ATP。在无氧糖酵解条件下,肌肉中糖原的含量不断降低,同时伴随着乳酸的累积和pH值的降低。成熟时间越长,肌肉内部分酶活性就会被抑制,造成糖酵解过程变慢,使得乳酸含量降低,pH值也有所回升。除此之外,处理组在成熟初期的pH值比空白组和对照组低,且pH值下降率快,说明排酸所需时间短,pH值的快速下降可能是由于是Ca2+激活了由腺嘌呤核糖核苷酸(adenosine monophosphate,AMP)控制的磷酸化酶[16]。对照组滩羊肉的pH值、糖原和乳酸较空白组均有不同,这可能是注水使一些肌纤维的结构发生了改变,使肌肉中的渗透压发生了变化,导致线粒体受损,从而对肌肉中的能量代谢产生了一定的影响。与空白组相比,处理组的pH值下降率、糖原消耗量和乳酸产生量较高。丁大茗[17]和朱立贤等[18]研究表明成熟期pH值的下降对肉质(如嫩度、持水性和色泽)具有显著影响。因此需要进一步研究宰后成熟期间滩羊肉能量水平的变化对肉品质产生的影响。
滩羊肉的品质情况决定其食用价值和经济价值,其中肉色是反映肉品好坏最直观的指标,是消费者判断肉品新鲜度和安全度的重要依据[19]。研究表明pH值的下降对肉色a*值和b*值产生一定的影响[20]。本研究结果显示:成熟至8 d的羊肉空白组、对照组和处理组a*值均逐渐下降,处理组下降率较空白组和对照组高,降低了羊肉的红色[21]。处理组滩羊肉样的b*值上升率高于其他两组,表明CaCl2处理加速了宰后滩羊肉b*值的上升,促使羊肉变黄。这是由于成熟期间肌糖原通过糖酵解过程产生乳酸,Ca2+的加入使糖原分解速率升高,因此乳酸产生量也更高[10],此外,ATP水解过快会产生大量的磷酸,从而造成酸性物质在很长时间内不能被分解与转运,导致pH值快速下降[11],从而降低线粒体功能和耗氧量,致使线粒体膜结构破坏和氧气浓度降低,对肌红蛋白产生影响[22]。肌红蛋白是一种能够主动结合氧的肌原纤维蛋白,主要功能是在肌肉组织中形成氧气储备,在暂时缺氧时消耗。由于肌红蛋白与氧气的结合减少,致使氧合肌红蛋白减少[23],郜娜等[24]研究同样发现Ca2+抑制电子传递链介导的高铁肌红蛋白还原和烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)的产生,削弱高铁肌红蛋白的还原力,使滩羊肉不能呈现明亮的粉红色。同时Ca2+通过提高pH值的下降速率,加速肌肉系水力的下降和肌纤维的收缩,加快肌原纤维小片化进程和肌原纤维蛋白水解[25],增加肉表面对光的反射,对肉的光学性质造成影响。除此之外,这也可能是由于Ca2+自身所具有的某种氧化催化性质所致[26]。综上所述,CaCl2通过影响肌原纤维的降解、肌红蛋白的合成以及肉的pH值,从而引起肉色的劣变[27]。
肌肉尸僵及解僵对保水性有着不同程度的影响。结果表明,滩羊肉的离心损失随成熟时间的推移而增高,蒸煮损失呈先升后降的趋势。李文东等[28]研究表明,在成熟过程中,肉中的pH值降低并达到等电点时,会造成大量的水分流失,这很有可能是因为动物宰后呼吸停止,糖酵解过程生成乳酸使机体pH值降低,肌肉蛋白质的净电荷也随之减少,因此蛋白质之间的排斥力也随之减弱,使蛋白质间的空隙变小并将间隙间的水分挤出,造成肌肉的失水率增加,保水性变差。在宰后4~8 d,本实验处理组和对照组的蒸煮损失及离心损失比空白组高,肌肉对外源溶液不能完全吸附,因此在外加离心力及蒸煮处理后水分损失比较大,3 组滩羊肉样中处理组保水性最差,这与Kong Baohua等[29]在研究CaCl2溶液对牛肉嫩度影响时发现注水或CaCl2溶液会使生肉的失水率增加的结论一致。
在滩羊肉成熟期间,3 组滩羊肉样的剪切力值均呈先升后降的趋势,成熟第2天时达到最高。MFI反映了肌肉在成熟过程中微观结构的改变,MFI值较高,表明肌纤维受损较严重。处理组、空白组和对照组MFI在0~8 d均逐渐增加且8 d时都达到最大值。本实验空白组剪切力、MFI变化情况与马旭华等[30]的研究结果类似。随着成熟期的增加,肌肉进入僵直阶段,pH值逐渐下降达到等电点,致使肌肉中的肌浆蛋白和肌原纤维结构蛋白降解,肌肉收缩变硬,失水增多且嫩度下降;从僵直后期到成熟前期,在肌肉内蛋白水解酶如钙激活酶、组织蛋白酶等的作用下,肌原纤维发生断裂,此外肌肉僵直产生的肌纤维收缩张力使Z线断裂,肉变得柔嫩多汁[31]。本实验中,注射CaCl2溶液使滩羊肌浆中Ca2+浓度增加,引起剪切力降低和MFI值增大。这是由于动物宰后消耗大量ATP,肌浆网体失去钙泵作用而破裂导致Ca2+释放,虽然Ca2+浓度增加,但该浓度不足以激活全部的钙激活酶,此时将CaCl2溶液注射到肌肉中相当于为肌肉提供了更多的Ca2+,从而使更多的钙激活酶被激活,使其最大限度地发挥嫩化作用,这与Pringle等[32]利用CaCl2溶液显著改善牛肉嫩度的结论一致。
4 结论
本研究明确了CaCl2处理对宰后成熟期间滩羊肉能量水平和品质的影响。WB结果显示PFKM蛋白表达量上升,CaCl2被证实对糖酵解途径起到激活作用。宰后成熟期间,向滩羊肉中注射CaCl2溶液,加快糖原的分解速度并增加乳酸的生成,加速了糖酵解水平,使pH值快速下降。滩羊肉中注射CaCl2溶液对不同成熟期的滩羊肉的肉色、保水性、水分分布、嫩度均有影响,抑制氧合肌红蛋白的产生,激活钙激活酶的活性,改变肌原纤维的结构并缩短肌肉蛋白分子间隙,促进肌原纤维小片化进程、肌原纤维蛋白水解速度加快,导致了滩羊肉的肉色劣变、水分流失和嫩度增加。
