可再分散甲壳素纳米纤维的制备及其在稳定Pickering乳液中的应用
2024-01-03董同珺魏孔菊丁贝贝王学东丁文平
董同珺,魏孔菊,双 媛,丁贝贝,王学东,丁文平
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
由固体颗粒稳定的乳液被称为Pickering乳液[1]。与由表面活性剂或聚合物稳定的传统乳液相比,Pickering乳液表现出优异的抗聚结稳定性、高内相比例、刺激响应性和调节脂质消化等优势,将其引入食品中可大大提高乳液体系的安全性和稳定性,因此,吸引了越来越多科研工作者的关注[2-3]。常见无机颗粒如二氧化硅或改性二氧化硅粒子是优良的Pickering乳液稳定剂,但它们难以被生物降解,在食品领域的应用受到很大限制[2,4]。目前,开发一种能够有效稳定乳液且安全可食用的稳定剂仍然是一个挑战。
甲壳素是自然界中含量仅次于纤维素的可再生天然多糖,广泛存在于虾、蟹及其他甲壳类动物的外骨骼中,具有良好的生物相容性和生物可降解性[5]。近年来,虾、蟹作为经济价值较高的甲壳类动物,产业发展迅速,与之同时产生的废弃虾、蟹壳数量也逐年增加。虾、蟹壳的浪费既给环境带来负担,又造成生物质资源的浪费[6-7]。目前,甲壳素因具有良好的生物相容性、生物可降解性及独特的生物活性,在食品领域引起越来越多的关注[8]。已有研究表明,甲壳素及其衍生物具有抑菌和抗菌作用且易于成膜,在果蔬、冷冻肉保鲜和食品包装膜等方面有广泛的应用前景[9-10],同时,甲壳素还具有降血压、降血脂、改善肠胃功能、调节机体免疫等功效,能在保健食品领域发挥重要作用[11]。此外,甲壳素分子链上含有大量的—OH和—NHCOCH3,具有良好的双亲性,易于改性。甲壳素纳米纤维(chitin nanofibers,ChNFs)是由甲壳素制备得到的一维纳米材料,不仅有甲壳素的优良性质,还具有高的比表面积、结晶度和模量,是一种极具发展前景的食品级Pickering乳化剂[12-14]。
已有研究表明,ChNFs和甲壳素纳米晶能有效稳定O/W型Pickering乳液。Tzoumaki[15]和Zhou Hualu[16]等已经分别证明ChNFs可吸附到油水界面并形成O/W型Pickering乳液。同时ChNFs可以产生强静电和空间排斥力,这使其可以有效稳定Pickering乳液并防止液滴聚结[17]。Torlopov等[18]以甲壳素纳米晶为水相,橄榄油为油相,制备O/W型Pickering乳液用于保护递送VD3,发现其乳液稳定性、流变学特性均有改善并能在消化系统上部保存微滴。还有研究者比较了ChNFs和甲壳素纳米晶对葵花籽油乳液的稳定性,发现在相同浓度下,ChNFs表现出更好的稳定O/W乳液能力,而且这些纳米材料均没有细胞毒性[19]。此外,研究者们更多地选择将表面存在阳离子基团的ChNFs与其他纳米粒子如纤维素、玉米醇溶蛋白等联合,形成复合物一起作为乳化剂用于稳定Pickering乳液[20-21]。
基于此,本研究将甲壳素进行纯化、部分脱乙酰化及羧甲基化处理后得到同时带有氨基和羧基的ChNFs,表征其结构并将其作为乳化剂应用于稳定Pickering乳液,结合流变学特性、激光共聚焦显微镜等对乳液稳定性进行评估,观察其贮藏稳定性及对pH值的适应能力。以期在食品和生物技术领域用于保护和递送生物活性物质,尤其是对pH值敏感的物质。
1 材料与方法
1.1 材料与试剂
甲壳素购自浙江金壳药业股份有限公司。实验过程中所用试剂由国药控股股份有限公司提供,均为分析纯。实验过程中所用水均为超纯水。
1.2 仪器与设备
Dimension ICON原子力显微镜 德国Bruker公司;JEM-2200 FS透射电子显微镜 日本JOEL公司;Nexus 670型傅里叶变换红外光谱(Fourier transform-infrared spectroscopy,FT-IR)仪 美国Thermo Nicolet公司;Empyrean型X射线衍射仪 荷兰帕纳科公司;Zetasizer Nano ZS90型纳米粒度仪 英国Malvern公司;DHR-2型多功能流变仪 美国TA公司;FV1200型激光共聚焦显微镜 日本Olympus公司。
1.3 方法
1.3.1 ChNFs的制备
参考文献[22]的方法对甲壳素原料进行纯化,干燥并置于干燥器中以便进行后续实验。甲壳素部分脱乙酰化的方法参考文献[23-24]并稍作修改。将纯化好的甲壳素粉末加入到质量分数33%氢氧化钠溶液中,然后加入质量分数0.3%硼氢化钠,在90 ℃条件下水浴加热2 h实现甲壳素的部分脱乙酰化。随后将部分脱乙酰化甲壳素(deacetylated chitin,DE-chitin)粉末加入到体积比为1∶4的水和异丙醇混合溶液中,之后加入质量分数13%氢氧化钠溶液,50 ℃水浴加热1 h,将15 g氯乙酸溶解于20 mL异丙醇溶液中,缓慢滴加至上述反应体系中,保持反应温度不变继续反应4 h,随后加入乙醇停止反应同时除去粗产物中的盐和水。利用细胞破碎仪在50%功率下冰浴处理5 min,6 000 r/min离心15 min后所得离心管上层淡蓝色悬浮液即为ChNFs悬浮液。将制得的ChNFs干燥后再次加入到超纯水中,经超声处理后即得再分散甲壳素纳米纤维(redispersible ChNFs,RE-ChNFs)悬浮液。
1.3.2 Pickering乳液的制备
分别将0.1%~2.0%新制备的ChNFs悬浮液与液体石蜡按体积比9∶1混合,利用高速剪切机在10 000 r/min条件下剪切2 min,再利用高压微射流仪对混合溶液处理2 次,即得由不同质量分数ChNFs稳定的Pickering乳液。
1.3.3 理化特性表征
1.3.3.1 原子力显微镜(atomic force microscope,AFM)观察
利用AFM在扫描模式下对ChNFs和RE-ChNFs的形貌进行表征。分别在新切割的云母片上旋涂1 滴稀释的ChNFs和RE-ChNFs水分散液,并在室温干燥过夜,ChNFs的长度和宽度是利用Nano Measurer 1.2软件通过计数至少100 个纳米纤维测量。
1.3.3.2 透射电子显微镜(transmission electron microscope,TEM)观察
利用TEM对ChNFs和RE-ChNFs的形貌进行表征。分别将稀释好的ChNFs和RE-ChNFs水分散液滴在铜网上,用滤纸除去多余液体,然后用质量分数1%磷钨酸钠染色,最后通过蒸发自然干燥,将得到的样品放置在透射仪器内进行观察并成像,设置加速电压为200 kV。
1.3.3.3 FT-IR和X射线衍射(X-ray diffraction,XRD)测定
甲壳素原料、纯化甲壳素(purified chitin,PUchitin)、DE-chitin干燥后剪成粉末,粉末状样品与KBr以1∶100的质量比混合,充分研磨并压制成薄片,用FT-IR测定。测试范围为4 000~400 cm-1,分辨率为4 cm-1,扫描次数为32 次。此外,为了使ChNFs表面的羧基特征峰更加明显,将新制备的ChNFs水分散液常压干燥成膜,经酸处理再洗涤至中性后测试。
将新鲜制备的ChNFs冷冻干燥并剪成粉末以便开展测试。XRD测试条件:反射法,Cu靶(λ=1.54 Å),设置扫描速率为5°/min,扫描步长为0.02,扫描范2θ为5°~40°。
1.3.3.4 粒径和Zeta电位测量
利用纳米粒度仪测量ChNFs及RE-ChNFs水分散液的粒径及Zeta电位。测试前用去离子水对分散液进行稀释,以消除多重散射效应的影响。
1.3.3.5 流变学特性
利用多功能流变仪来测定乳液的流变学特性。将由不同浓度ChNFs稳定的乳液滴加在两块间距为1 mm、直径为40 mm的平板中间,用刮刀刮掉周围多余液体,随后盖上涂有矿物油的盖子。在振荡模式下进行频率扫描,记录乳液的弹性模量(G′)和黏性模量(G″)。其中测试温度为25 ℃,频率为0.1~100 Hz,扫描应变为1%。在剪切速率为0.01~100 s-1的范围内测试乳液的剪切黏度,测试温度保持在25 ℃。
1.3.3.6 激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)
使用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和尼罗红对乳液进行染色,以异丙醇为溶剂配置1 mg/mL的FITC和尼罗红溶液置于5 mL离心管中,在另一个装有1 mL Pickering乳液的5 mL离心管中加入20 μL FITC溶液和10 μL尼罗红溶液,混匀后室温静置24 h,取10 μL染色后的乳液滴在载玻片上,盖上盖玻片后使用CLSM观察乳液的微观形态,激发波长为488 nm和543 nm。
1.3.3.7 乳液稳定性
贮藏稳定性:将制备好的由不同浓度ChNFs稳定的Pickering乳液置于室温贮藏,并选取贮藏时间,观察乳液的稳定情况。参照Lee等[25]方法测定乳析指数(emulsifying index,EI),EI按下式计算:
式中:H乳液为乳液的高度/cm;H全部为所有相(乳液、添加的ChNFs及连续相)的总高度/cm。
pH值稳定性:新鲜制备的乳液的pH值通过添加0.1 mol/L的NaOH或HCl溶液进行调节,所得不同pH值的乳液在室温放置24 h后观察乳液的稳定情况。
1.4 数据统计与分析
数据采用OriginPro 9.0软件绘制图形。利用SPSS 19.0进行数据分析,运用方差分析法进行显著性分析,部分实验结果采用表示。
2 结果与分析
2.1 ChNFs和RE-ChNFs的形态表征
图1A分别为ChNFs和RE-ChNFs水分散液的AFM图像,可以清楚地看到单个纳米甲壳素的纤维形态。不仅如此,新鲜制备及再分散的纳米甲壳素在水介质中分散良好,均没有出现聚集现象。利用图像处理软件分别对2 种纳米纤维的长度和宽度进行统计学分析,结果分别如图1B、C所示,再分散前后ChNFs的平均长度分别为271.2 nm和295.4 nm,平均直径分别为39.4 nm和44.5 nm,长径比分别约为6.9和6.7,较低的长径比也符合α-甲壳素“短胖”的形态。此外,在AFM图像中还观察到有少许较短的物质存在。Bai Long等[24]对部分脱乙酰的α-甲壳素进行超声处理,结果发现,当超声功率相同时,未经超声处理、超声处理20 min和40 min所得的ChNFs的长径比分别约为≥60、15和25。Wang Yuntao等[26]根据再生ChNFs的TEM图像及水分散液的透光率发现在超声时间从10 min增加到60 min的过程中,分散的甲壳素的平均尺寸从1 183 nm减小至670.9 nm,并且样品的透光率也随之升高,同样显示分散液中有小颗粒物质的存在[27],这些结果均可理解为更多的能量输入会将甲壳素降解为更小的颗粒。与这些研究结果不同的是,制备得到的ChNFs悬浮液及再分散悬浮液中纳米纤维的尺寸变化不大,这可能是由于在制备过程中超声处理时间较短,对甲壳素尺寸的影响不大,甚至可以忽略不计。
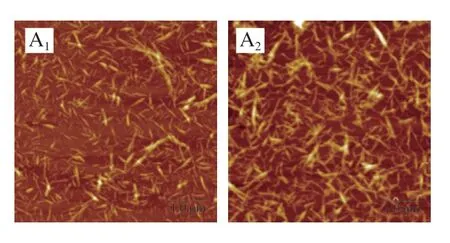
图1 ChNFs和RE-ChNFs的AFM图(A)和尺寸分布直方图(B、C)Fig.1 AFM images (A) and size distribution (B,C) of ChNFs and RE-ChNFs
图2A为再分散前后ChNFs水分散液在相同浓度下的外观。结果表明,当水分散液中甲壳素浓度相同时,新鲜制备的ChNFs与RE-ChNFs水分散液的透光性差别不大,即浊度相近。经干燥除去分散介质得到的ChNFs只要再通过简单的超声处理就可重新分散在水介质中,且与新鲜制备的样品相比,除去分散介质后再次分散的过程并不会对ChNFs的分散性产生影响,这主要是由于甲壳素在浓碱和羧甲基化试剂处理之后,大大削弱了分子内和分子间的氢键作用。

图2 ChNFs和RE-ChNFs悬浮液的外观(A)和TEM图像(B)Fig.2 Visual appearance (A) and TEM images (B) of ChNFs and RE-ChNFs suspension
AFM和TEM结果(图2B)表明,利用氯乙酸处理DE-chitin能得到可再分散纳米甲壳素,并且,冷冻干燥除去水分散介质及再分散时超声处理的过程对纳米甲壳素的长度和宽度影响不大,说明再分散过程中的冷冻干燥和短暂的超声处理并不会影响甲壳素的形态。
图3A所示为新鲜制备和再分散ChNFs悬浮液的粒径分布,测量前用超纯水适当对悬浮液进行稀释处理,避免多散射现象的影响。结果表明,新鲜制备和再分散ChNFs悬浮液的粒径分布基本相同,说明再分散过程并未对甲壳素的形态造成太大影响。这与AFM和TEM所得到的结论一致。由图3B可知,ChNFs悬浮液在pH 7条件下的Zeta电位值为-(38.1±1.2)mV,其绝对值大于30,且多分散性指数(polydispersity index,PDI)为0.380,证明粒径分布均匀。此外,由粒径分布强度可知,所制得ChNFs与RE-ChNFs悬浮液尺寸均比较均一,粒径范围较小,这与所测得较小的PDI值吻合。
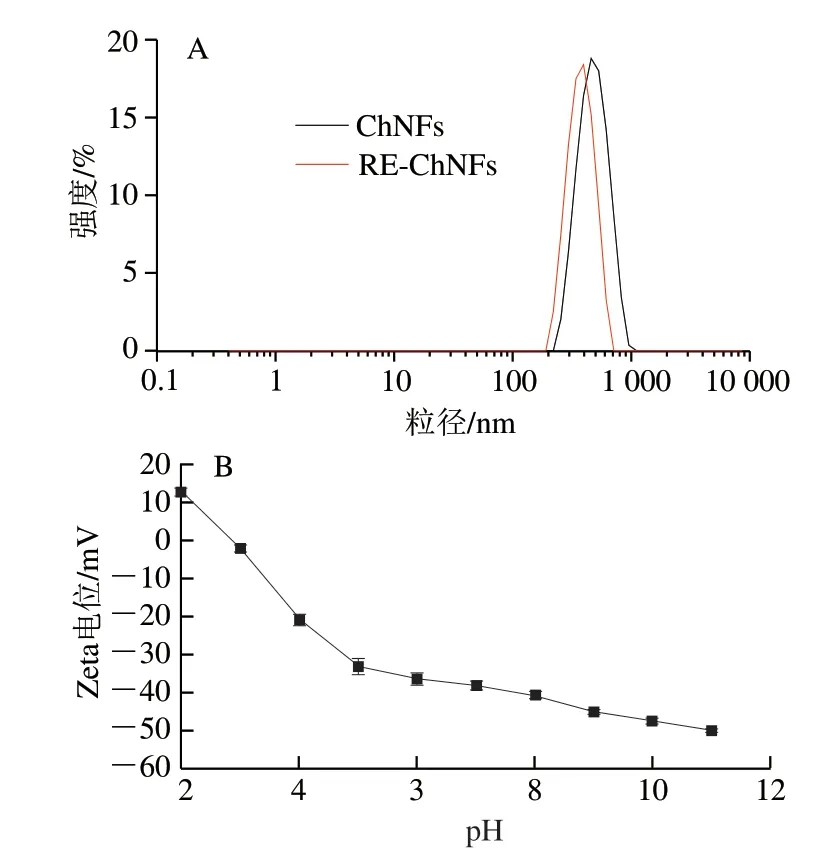
图3 ChNFs和RE-ChNFs悬浮液粒径(A)及不同pH值ChNFs的Zeta电位(B)Fig.3 Particle sizes of ChNFs and RE-ChNFs suspension (A) andzeta potential of ChNFs at various pH (B)
2.2 ChNFs和RE-ChNFs的结构表征
通过FT-IR及XRD结果确定所制备ChNFs的化学和晶体结构。图4A为甲壳素原料、PU-chitin、DE-chitin及ChNFs的红外图像,图4B为1 800~1 000 cm-1范围内的放大图,可以看出,1 730 cm-1处附近出现一个小峰,此峰是羧基的特征峰,表明在甲壳素分子链上成功引入羧基。Fan Yimin[28]和Ma Qinyan[29]等分别利用2,2,6,6-四甲基哌啶-1-氧自由基氧化和过硫酸铵处理鱿鱼骨制备羧基化ChNFs时也得到类似结论,酸处理能使甲壳素表面的羧基电离,使红外谱图上羧基的特征峰更加明显。与甲壳素原料及PU-chitin的结果相同的是,ChNFs的酰胺I键在1 660 cm-1和1 621 cm-1处有双重吸收峰,说明实验中所用甲壳素的晶体结构为α-晶型,且其晶体结构在整个处理过程中未发生变化[30]。

图4 甲壳素原料、PU-chitin、DE-chitin和ChNFs的FT-IR(A)及其放大图(B)Fig.4 FT-IR spectra (A) of chitin,PU-chitin,DE-chitin and ChNFs and their zoom-in images (B)
图5中XRD结果显示,4 种甲壳素样品均在9.4°、12.8°、19.3°、20.8°、23.4°及26.4°处出现衍射峰[22],分别对应α-甲壳素晶体中的(020)、(021)、(110)、(120)、(130)及(013)晶面[31-32],这与FT-IR谱图结果一致。同时FT-IR谱图及XRD结果表明,在ChNFs的制备过程中,其部分脱乙酰化和羧甲基化均只发生在ChNFs的表面[33-34]。与未经处理的甲壳素相比,在甲壳素纯化、部分脱乙酰及羧甲基化的处理过程中,样品结晶峰的峰值均随处理过程的增加而逐渐降低,这也表明了甲壳素的分子间氢键在处理过程中进一步被破坏[26]。
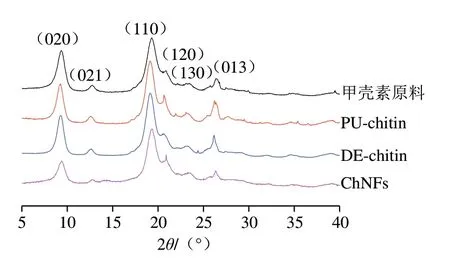
图5 甲壳素原料、PU-chitin、DE-chitin和ChNFs的XRDFig.5 XRD profiles of chitin,PU-chitin,DE-chitin and ChNFs
2.3 乳液的流变学特性
已有研究表明,可以通过增稠提高乳状液的稳定性,用这种方法同样可以有效提高Pickering乳液的稳定性[35]。当乳液处于凝胶化这一极端情况时可以长期稳定贮存。为了解不同质量分数ChNFs对Pickering乳液稳定性的影响,考察由不同质量分数ChNFs稳定的Pickering乳液样品的流变行为。图6A为Pickering乳液的弹性模量(G′)和黏性模量(G″)随频率的变化趋势,可以看出,即使乳液中ChNFs含量在很低的情况下,3 个样品在低频区的G′均高于G″,表明这些乳液都表现出明显的凝胶特性[36],且当ChNFs质量分数大于1.0%时,所稳定乳液样品的G′、G″值在低频区不依赖于频率的变化。除此以外,ChNFs质量分数为1.0%和2.0%时,稳定的Pickering乳液G′、G″变化趋势与0.5%时的变化趋势略有不同,当用来稳定乳液的ChNFs质量分数较低(0.5%)时,G′和G″在较低频率条件下较低,在较高频率下相交,这一现象与Xu Baomei等[2]研究结果类似,他们将这一现象归因于乳液中的物质很少或没有形成网络结构。随着稳定乳液的ChNFs质量分数的增大,乳液的G′和G″逐渐增大,当乳液中ChNFs质量分数为2.0%,乳液的G′和G″值分别约为22 Pa和3 Pa,此时G′值超过G″值7 倍以上,且在0.1~10 Hz的频率范围内相对保持不变,这一结果说明此时乳液中的物质形成凝胶状网络结构[37]。图6B所示为Pickering乳液的黏度随剪切速率的变化趋势,可以看出,当剪切速率高于0.1 s-1时,3 种乳液样品均表现出典型的剪切稀化行为,即在低剪切速率下,乳液的剪切黏度都很高;随着剪切速率的不断增加,乳液的剪切黏度逐渐减小,这表明乳液网络可以被较高的剪切速率破坏,同时这一现象也证明所制备的乳液类型属于水包油型乳液[38]。此外,乳液的表观黏度随ChNFs质量分数增加而增加,这可能是由于ChNFs悬浮液连续相的黏度增加导致[30]。

图6 不同浓度ChNFs稳定乳液的流变学特性Fig.6 Rheological properties of the Pickering emulsions stabilized by ChNFs at various concentrations
2.4 乳液的微观结构
图7为ChNFs质量分数为1.0%时稳定的Pickering乳液的CLSM图像,其中油相用尼罗红染色,ChNFs用FITC染色,可以看出,在乳液中绿色的ChNFs几乎占据整个观察背景区域,呈连续相分布(图7B),而红色的石蜡呈现出相对独立的液滴状分布(图7A)。如图7C所示,在ChNFs的水连续相周围包围着独立分布的油滴,这一现象证实制备的乳液类型为O/W型乳液,也与乳液的流变学测试结果保持一致。

图7 1% ChNFs稳定Pickering乳液的CLSM图Fig.7 CLSM images of the Pickering emulsions stabilized by 1.0% ChNFs
2.5 乳液的贮藏稳定性
由图8A可知,随着分散液中ChNFs质量分数的增大,ChNFs分散液的光散射增加,即浊度增加[24]。图8B~F为不同质量分数ChNFs稳定的Pickering乳液在室温条件下贮藏0、7、14、28 d和90 d的外观图片。表1所示为不同乳液样品在贮藏期间的EI。这些结果表明,0.1%~2.0%的ChNFs在0 d(新鲜制备时)均能有效稳定Pickering乳液,且EI值无显著差异。此外,当用于稳定乳液的ChNFs质量分数较低时(0.1%、0.2%),样品在0~7 d的贮藏期内会出现明显分层,且在3 d乳液底部就可观察到少量分层并随着贮存时间的延长,分层现象逐渐明显。乳液在贮藏后期会表现出相对较低的EI值,尽管它们的EI值较低,但是通过视觉观察外观,它们依然是稳定的乳液,这一现象也与之前的报道结果一致[25,39]。与之相反的是,当用于稳定乳液的ChNFs质量分数较高时(0.5%~2.0%),所制备的乳液在整个90 d的贮藏期内均不会出现明显分层,除0.5% ChNFs稳定的乳液在贮藏后期EI值略有降低外,其他2 个乳液样品的EI值均能维持在1左右,表明乳化效果良好,乳液具有优异的贮存稳定性,同时也证明制备的ChNFs具有作为乳化剂的潜力。

表1 水包油型Pickering乳液在贮存0、7、14、28 d和90 d的EITable 1 EI of oil/water Pickering emulsions at 0,7,14,28 and 90 days of storage

图8 不同质量分数ChNFs(A)和ChNFs稳定的Pickering乳液(B~F)的视觉外观Fig.8 Visual appearance of ChNFs at concentrations (A) and the Pickering emulsions stabilized by ChNFs (B–F)
2.6 pH值对乳液稳定性的影响
pH值对乳液稳定性的影响通常可归因于表面活性组分中极性基团的电离,因为电离可以引起一定的静电排斥作用,从而破坏界面的内聚力[40]。目前,大多数具有pH值响应的乳化剂都是无机颗粒或者合成接枝聚合物,但一般情况下这些乳化剂的制备成本较高且对环境不友好。通过部分脱乙酰化处理使得ChNFs表面带有一定量的氨基,再通过羧甲基化处理赋予其羧基,使ChNFs具有类似蛋白质的双电荷性质。利用2.0% ChNFs悬浮液在不同pH值条件下制备得到的石蜡-水乳液放置24 h后,研究pH值对乳液稳定性的影响,其中油水的体积比为1∶9。由图9可知,当乳液的pH值在3~11范围内时,24 h内ChNFs都可以稳定乳液,若进一步增大或减小乳液的pH值则会出现破乳现象。研究表明,纳米粒子作为乳化剂对乳液稳定性影响的主要因素是表面电荷和湿润性。由图3B中Zeta电位的测量结果可知,当pH值在6~8范围内时ChNFs的疏水性会有一定程度增加,疏水性变化会导致纳米粒子能被油水两相润湿[34]。在较高或较低pH值时出现破乳现象的原因可能是此时纳米粒子电荷密度较高,导致排斥力增加,从而出现油水分层的现象。尽管如此,ChNFs依然具有在较大pH值范围内稳定乳液的能力,与传统具有pH值响应性的乳化剂相比,本实验制备得到的ChNFs还具备来源广、可再分散及生物相容性高的优点,应用前景可观。

图9 pH值对ChNFs稳定Pickering乳液的影响Fig.9 Effect of pH on ChNFs-stabilized Pickering emulsion
3 结论
利用脱乙酰化法结合羧甲基化处理,制得同时带有氨基和羧基的ChNFs,且其经干燥除去分散介质后仍能再次分散,便于大规模运输和贮存。此外,这种ChNFs能有效稳定O/W型Pickering乳液,结果表明所制得的Pickering乳液具有良好的凝胶特性,同时还具有良好的贮藏稳定性及较宽范围pH值适应性,可以用于保护和递送对pH值敏感的活性物质,拓展了甲壳素在食品生物领域的应用。
