Protamex酶水解对玉米谷蛋白泡沫性质及结构特性的影响
2024-01-03范广琦王俊彤崔素萍郑喜群
范广琦,王俊彤,2,,李 丹,2,崔素萍,3,李 晶,郑喜群,3,
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319;3.粮食副产物加工与利用教育部工程研究中心,黑龙江 大庆 163319)
2021年,全国玉米产量约27 255万 t,玉米加工副产物总量可达7 000万 t左右。玉米蛋白粉(corn gluten meal,CGM)是湿法生产玉米淀粉的主要副产物之一,其蛋白质质量分数为55%~65%,是一种丰富的植物蛋白质资源[1-2]。玉米蛋白质由68%醇溶蛋白、22%谷蛋白及少量白蛋白和球蛋白等组成,水溶性差,不适宜直接在食品行业中的应用,而通常是作为饲料或直接废弃[3]。玉米谷蛋白主要由谷氨酰胺、亮氨酸、脯氨酸、苯丙氨酸及结氨酸等氨基酸组成,酰胺基氨基酸比例较高,是天然表面活性剂的良好来源。但玉米谷蛋白是由大约20多种分子质量在11~127 ku的不同蛋白质亚基以二硫键为主要相互作用力而紧密连接的巨大、复杂的大分子蛋白质[4],且仅能溶于稀碱溶液。这导致其很难在食品体系中发挥起泡或乳化作用。因此,本研究希望通过适度修饰玉米谷蛋白结构,增强谷蛋白在气/水界面吸附的能力,从而改善其起泡性质,拓宽玉米谷蛋白在蛋糕、啤酒、冰淇淋以及搅打稀奶油等制品中的应用[5-6]。
已有研究表明物理和化学方法能够提高谷蛋白的功能性质。Zhao Meng等[7]发现通过碱热处理大米谷蛋白可提升其起泡性及泡沫稳定性;Wang Yang等[8]采用低功率密度超声法对CGM进行改性发现CGM局部的氨基酸序列相互作用发生改变,此外,刘金玲[9]和Wang Yaru[10]等分别采用糖基化以及磷酸化等化学修饰法对玉米谷蛋白和大米谷蛋白样品进行改性,结果表明玉米谷蛋白和大米谷蛋白的功能性质显著提高。酶水解法也是蛋白质改性的有效方法,具有反应条件温和、毒副作用小等优点,在食品蛋白质深加工中应用广泛。Wang Yonghui等[11]采用Alcalase酶水解CGM并与单宁酸复合,其混合物的起泡性及气/水界面行为均显著优于玉米蛋白;Klost等[12]则利用胰蛋白酶对豌豆分离蛋白进行水解,发现水解可有效提高蛋白质的溶解性、乳化性等功能性质并且对豌豆分离蛋白的界面性质也产生了积极的影响。但有报道称过度水解会导致蛋白质分子结构遭到剧烈破坏反而使其功能性质降低,由于过小的肽段会失去某些形成几种功能特性所需的蛋白质网络结构的能力,从而影响其功能性质[13]。因此,对玉米谷蛋白进行适度的水解必不可少。Protamex是经枯草芽孢杆菌发酵而制得,属于内切蛋白酶,具有广泛的酶切位点,使具有紧密空间结构的大分子质量玉米谷蛋白的肽键断裂。
本研究在前期研究结果基础上[4],采用Protamex酶解玉米谷蛋白,以不同酶解时间表示水解进程,探讨不同酶解时间条件下玉米谷蛋白的起泡性、泡沫微观形态、表面张力、静态流变学特性、粒径分布及结构性质的变化情况,以期为蛋白酶适度修饰技术在玉米蛋白质上的应用提供一定的理论依据,从而促进玉米蛋白质的高值化应用。
1 材料与方法
1.1 材料与试剂
CGM购自黑龙江龙凤玉米开发有限公司,蛋白质质量分数为65%(以干基计算)。
Protamex酶(食品级)丹麦诺维信公司;α-淀粉酶(食品级)北京奥博星生物技术有限责任公司;8-苯胺-1-萘磺酸(8-(phenylamino)naphthylamine-1-sulfonic acid,ANS)美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
T25高速分散机 德国IKA公司;ZEN3700纳米激光粒度电位测定仪、kinexusPro+高级旋转流变仪英国Malvern公司;BX53F荧光显微镜 日本奥林巴斯公司;U-2910紫外-可见分光光度计 日本Hitachi公司;RF-6000荧光分光光度计 日本岛津公司;MacroRAM拉曼光谱仪 堀场(中国)贸易有限公司。
1.3 方法
1.3.1 玉米谷蛋白的制备
参考许瑞雪等[14]的方法,先对CGM进行去淀粉、去醇溶蛋白处理,再采用碱提酸沉法提取谷蛋白。去淀粉:CGM分散于pH 6.5水溶液中,料液比1∶10(g/mL),置于65 ℃恒温水浴磁力搅拌器中,加入1%(质量分数)的α-淀粉酶反应2 h,灭酶15 min后于4 000 r/min离心15 min,所得沉淀用纯水洗涤3 次,晾干、粉碎。去醇溶蛋白:去淀粉后样品分散于70%乙醇溶液中,料液比1∶10(g/mL),置于60 ℃水浴中抽提醇溶蛋白,2 h后于4 000 r/min离心15 min,重复抽提2 次,将沉淀晾干、粉碎。提取谷蛋白:将预处理后样品以料液比1∶10分散于0.1 mol/L NaOH溶液,置于60 ℃恒温水浴磁力搅拌器中提取2 h,于4 000 r/min离心15 min;取上清液用HCl(4 mol/L)溶液调节pH值至等电点,于4 000 r/min离心15 min,将沉淀用70%乙醇溶液和蒸馏水分别洗涤3 次,并将pH值调回至7.0,将所得谷蛋白冷冻干燥、粉碎后过80 目筛备用。
1.3.2 Protamex酶水解玉米谷蛋白
将1.3.1节所得玉米谷蛋白分散于蒸馏水中,底物质量浓度5 g/100 mL,按酶与底物之比0.81%加入Protamex酶,在pH 7.0、60 ℃条件下进行水解,期间以0.1 mol/L NaOH溶液维持pH值恒定,并采用pH-stat法[15]测定水解度。水解反应分别进行10、30、60、120 min和150 min后,煮沸30 min灭酶,水解液于4 500 r/min离心15 min,所得上清液冷冻干燥后为水解物,待测。
1.3.3 溶解性的测定
参考Surówka等[16]的质量差法稍作修改,将2 mL离心管标记、称量记为m1,称取样品0.1 g置于离心管中,再向离心管中加入1 mL的蒸馏水,旋涡振荡10 min,后10 000 r/min离心10 min,弃去上清液,将沉淀物于80 ℃干燥8 h,最后将带有沉淀物的离心管称量记为m2。按照式(1)计算:
1.3.4 泡沫性质的测定
参照Zheng Xiqun等[4]所述搅打法测定,并稍作修改。样品分散于蒸馏水中制成质量浓度为1 g/100 mL的蛋白溶液。取20 mL样品溶液放置于50 mL烧杯中,记录初始高度(H0),以13 500 r/min高速间歇搅打2 min,立刻记录此时泡沫高度H1,室温下静置30 min后的记录泡沫高度H2。起泡性和泡沫稳定性按照式(2)、(3)计算:
1.3.5 泡沫宏观和微观形态观察
按照1.3.4节方法将样品溶液搅打起泡,用相机拍照记录泡沫产生0、10、20 min和30 min的宏观形态变化。同时取部分泡沫置于载玻片上,并于显微镜下观察并记录相应的微观形态变化。
1.3.6 表面张力的测定
将样品配制为质量浓度1 g/100 mL的分散液,采用DCAT21自动表面张力仪按照GB/T 27842—2011《化学品 动态表面张力的测定 快速气泡法》的方法测定其表面张力[17]。
1.3.7 粒径及Zeta电位的测定
参照Sharan等[18]的方法,将样品制为质量浓度1 mg/mL分散液并过0.22 μm水系膜,设置温度为25 ℃,蛋白折射率1.46,吸收参数1.33,溶剂为水,采用马尔文纳米激光粒度电位测定仪进行测定。
1.3.8 内源荧光光谱的测定
参照Tao Xia等[19]的方法,将样品制为质量浓度0.1 mg/mL的分散液,室温下通过荧光分光光度计扫描其内源荧光强度。设定激发波长为290 nm,发射波长范围300~400 nm,狭缝宽度5 nm。
1.3.9 表面疏水性的测定
参照Zheng Xiqun等[4]的ANS探针法并稍作修改,将样品溶解并稀释至蛋白质量浓度0.01~0.20 mg/mL之间。取5 mL样品溶液加入25 μL ANS试剂(浓度为8 mmol/L,溶于0.01 mol/L pH 7.0的磷酸盐缓冲液)在室温条件下反应15 min。设定荧光分光光度计的激发波长为390 nm,发射波长为470 nm,狭缝5 nm,分别测定样品的荧光强度(FI0)和样品加入ANS试剂后的荧光强度(FI1),FI1和FI0的差值记为FI,以蛋白质量浓度为横坐标,FI为纵坐标作图,曲线初始斜率即为样品的表面疏水性指数。
(2)经济管理。长期以来,由于水资源伸手即来,人们对水资源的价值缺乏进一步的更深的认识。所以在弥补行政手段不足的同时,我们每一个个体都应重新确立水的意义和价值,与此同时政府建立以水权为操作的核心、以水价为操作的通用手段、有偿使用水资源的社会主义市场机制。所以水权的初始分配必须通过政府机构进行并建立相应的标准。
1.3.10 拉曼光谱的测定
参照Chang Cuihua等[20]的方法,将样品平铺在载玻片上进行拉曼光谱的测定,设置波长532 nm,扫描范围400~2 000 cm-1,扫描10 次,每个样品3 次累加,以苯丙氨酸(1 003±1)cm-1的谱峰强度作为归一化因子并运用LabSpec6软件对数据进行处理。
1.3.11 静态流变学的测定
参考李弓中等[21]的方法并略有修改。样品制为质量浓度为10 mg/mL的分散液,将样品分散液缓慢倾注于于高级旋转流变仪的样品台上。设定剪切速率为0.1~100 s-1,测试夹具为60 mm的锥板。将表观黏度与剪切速率按照式(4)的幂律方程进行拟合:
式中:η为黏度/(Pa · s );K为黏稠系数/(Pa·sn);ε为剪切速率/s-1;n为流动指数。
1.4 数据统计与分析
2 结果与分析
2.1 Protamex酶水解对玉米谷蛋白泡沫性质的影响
由图1可知,经Protamex酶水解的玉米谷蛋白的起泡性和泡沫稳定性均显著高于原玉米谷蛋白(起泡性(124.46±3.85)%、泡沫稳定性(102.96±3.51)%,P<0.05),且随着水解时间延长,呈先增加后减小的变化趋势。在水解120 min时,水解物的起泡性和泡沫稳定性都为最高,即(350.57±2.83)%和(228.39±2.90)%,分别是原玉米谷蛋白的2.8 倍和2.2 倍左右。Patino[22]和Ren[23]等水解向日葵蛋白分离物时得到了相似的结果,水解可以提高蛋白质的起泡力和泡沫稳定性,但过度水解对其起泡性和泡沫稳定性产生了不利影响。
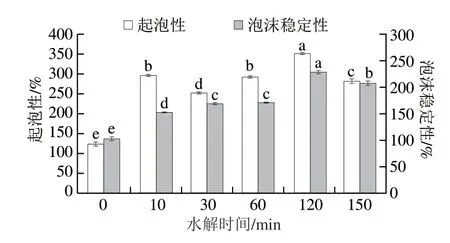
图1 水解时间对玉米谷蛋白起泡性及泡沫稳定性的影响Fig.1 Effect of hydrolysis time on foaming capacity and foam stability of corn glutelin
图2a、b分别为玉米谷蛋白及其水解物经搅打产生泡沫的宏观和微观图像。玉米谷蛋白分散液中悬浮有明显的大颗粒,产生的泡沫量少且稀疏、形状不规则,随放置时间的延长泡沫几乎消失。微观形貌显示玉米谷蛋白膜在泡沫形成10 min时已经发生崩塌。玉米谷蛋白经过Protamex酶水解后,其水解物的溶解性显著增加(P<0.05)(表1),因此在泡沫中未见明显颗粒,泡沫量明显增加且较为绵密,微观形貌显示气泡数量增多、近似圆形且大小趋于一致、平均气泡面积变小,分布致密有序。水解120 min样品所形成的泡沫最细小均匀,且在泡沫形成后的30 min内,与其他水解时间的样品相比,其气泡数量最多,平均气泡面积最小,蛋白膜的厚度较厚。有报道称平均气泡面积越小,分布越均匀致密越有利于其稳定[24]。但随着酶解时间的延长,水解物的起泡性和泡沫稳定性都显著降低(P<0.05)。蛋白质的起泡性与蛋白质溶解性、分子尺寸、疏水性和分子柔性等性质有关,泡沫稳定性则由蛋白质的黏度、膜的厚度、分子间相互作用等性质决定[25]。因此,通过对以上性质的研究解析水解后玉米谷蛋白起泡性和泡沫稳定性的变化原因。

表1 水解时间对玉米谷蛋白溶解性、水解度、表面张力和表面疏水性的影响Table 1 Effect of hydrolysis time on solubility,hydrolysis degree,surface tension and surface hydrophobicity of corn glutelin
2.2 Protamex酶水解对玉米谷蛋白溶解性和表面张力的影响
由表1 可知,原玉米谷蛋白的溶解性仅为(20.90±0.17)%,经Protamex酶水解后,水解物的溶解性显著提高,在水解60 min后均可达到90%以上。这说明Protamex酶水解能够改善谷蛋白的溶解性,其水解物中蛋白质/多肽能够更好地分散在水中,形成胶体态溶液。研究过程中发现水解物分散液并非透明澄清的溶液,而是可以看到少量胶体物质悬浮于溶液中,并且在溶解性测定方法的离心力下,这些悬浮的蛋白质也不能够完全被沉淀,而是较稳定的存在于上清液中。当蛋白质溶液被搅打时,只有分散在溶液中的蛋白质才能够快速在气/水界面吸附[26]。因此,水解物溶解性的提高使可以吸附到气/水界面上的蛋白质含量增加,这对玉米谷蛋白起泡力的改善具有积极意义。随着水解时间的延长,玉米谷蛋白的水解度在反应前30 min中快速增加,之后持续升高并在120 min后趋于平稳,所有水解物的蛋白质含量在74%~85%之间。原玉米谷蛋白的表面张力为(71.83±0.50)mN/m,经Protamex酶水解后,其水解物的表面张力均显著降低,且随水解时间的延长呈先降低后升高趋势。当水解时间在120 min时表面张力达最低(60.40±0.72)mN/m,这与其起泡性的变化趋势一致。这是由于适度的水解有利于增强蛋白质的分子柔性,暴露出更多疏水基团,更有利于水解物中蛋白质/多肽的疏水性基团和亲水性基团分别伸展至气相和水相,从而在界面处发生吸附,导致表面张力的降低[27]。表面张力反映蛋白质分子在气/水界面的吸附和展开的速度。表面张力越低,蛋白能够越快速的完成在气水界面上的吸附,形成有一定黏弹性的保护层,促进泡沫的形成以及维持泡沫体系的稳定[28]。过度的水解使蛋白质分子持续减小,低分子质量多肽由于肽段过短而失去分子柔性,不能在界面处发生吸附,导致水解时间为150 min水解物的表面张力增加。
2.3 Protamex酶水解对玉米谷蛋白粒径分布及Zeta电位的影响
蛋白质受到酶和热的作用,使得蛋白质分子发生解离和聚集的动态变化,通过测量粒径及Zeta电位可对其水解过程中蛋白质分子大小、聚集和静电相互作用情况进行表征。由图3a可知,玉米谷蛋白的粒径分布图中出现3 个明显粒径峰,P1(<68 nm)、P2(68~825、900 nm)和P3(>3 000 nm)。随着Protamex酶水解时间的延长,水解物的粒径逐渐向小粒径方向移动,其中P2峰逐渐向左移动与P1峰重合,在水解60 min后的酶解物中P1峰完全消失,同时粒径较大的P3峰也在水解60 min后消失。这说明着Protamex酶水解作用不仅使玉米谷蛋白的粒径降低,同时使粒径均一度增加。由图3b可知,水解30 min后酶解物平均粒径显著降低(P<0.05),并随着水解时间延长而持续降低。这可能是由于水解作用切断了玉米谷蛋白分子内肽键,大分子质量聚集体发生降解,低分子质量二聚体/亚基或者多肽逐步释放,使粒径降低。而水解反应过程中水热环境的作用可能引起暴露巯基的氧化交联等共价作用使部分蛋白质/多肽发生聚集,因此水解60 min和120 min样品的平均粒径差异不显著(P>0.05)。杨晓钒等[29]在酶水解处理扁桃仁蛋白质的研究中也发现了水解时间超过60 min后,水解物的粒径反而逐渐增大。值得注意的是,本研究采用马尔文纳米激光粒度仪测定的样品粒径为纳米级别,对玉米谷蛋白中部分粒径较大的大分子质量天然聚集体未能测出。
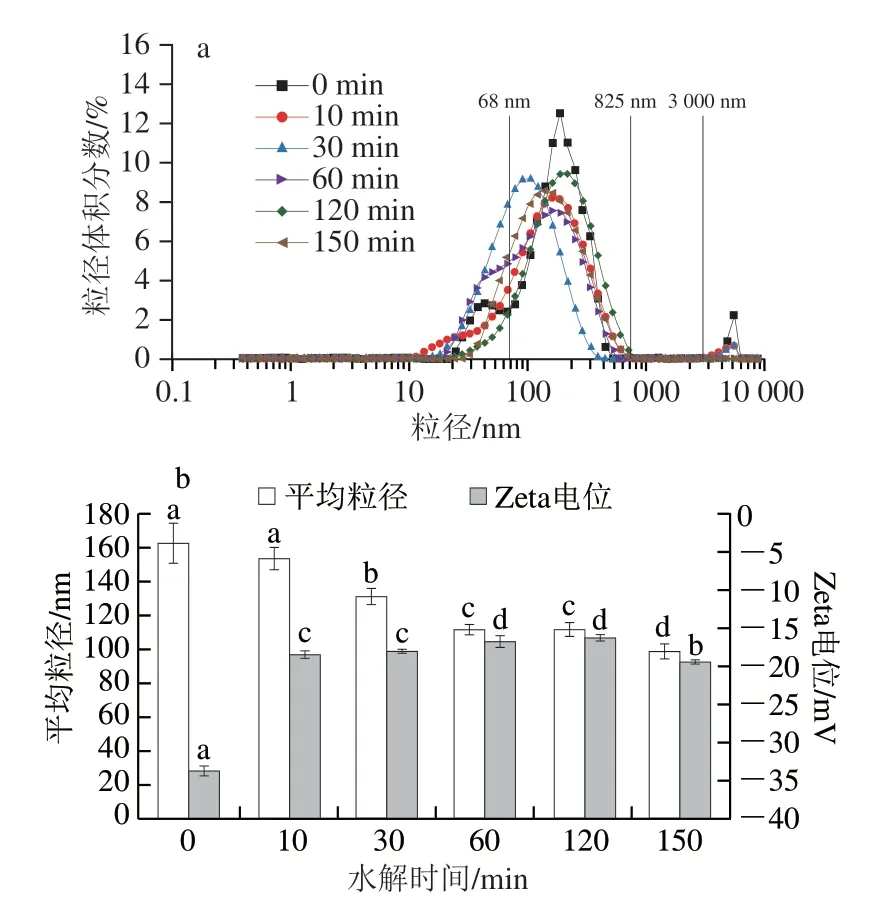
图3 水解时间对玉米谷蛋白的粒径分布(a)和平均粒径及Zeta电位(b)的影响Fig.3 Effect of hydrolysis time on particle size distribution (a),mean particle size and zeta potential (b) of corn glutelin
由图3b可以看出,与原谷蛋白相比,Protamex酶水解物的Zeta电位绝对值显著降低(P<0.05),在水解120 min时达到最低,为(16.30±0.50)mV,而酶解150 min时回升至(19.47±0.31)mV。玉米谷蛋白的Zeta电位为负值,说明其分子表面带有负电荷,绝对值降低说明了水解蛋白质分子表面净电荷减少。这是由于水解过程中脱氨基作用和带正电荷氨基酸暴露,使得蛋白质/多肽所带正电荷增加,从而中和部分负电荷所致。当水解时间延长至150 min,可能是由于反应进程中蛋白质/多肽的解聚与聚集动态变化导致部分带正电荷氨基酸重新被包埋而使绝对值增加,也可能是带负电荷氨基酸暴露增加所致。表面净电荷的减少对蛋白质/多肽在膜界面的吸附和扩散有利,促进泡沫的形成。同时还能够降低它们在界面的静电斥力,有利于形成黏弹性较好的界面膜而增强泡沫稳定性[30]。Xiong Wenfei等[31]研究也指出较小的粒径与表面电荷可加速蛋白质分子的扩散速度,提升其在气/水界面的吸附速率,并有利于蛋白质分子在界面上的展开和重排,从而提高起泡性。
2.4 Protamex酶水解对玉米谷蛋白内源荧光光谱的影响
玉米谷蛋白中的芳香族氨基酸,即苯丙氨酸、酪氨酸和色氨酸残基在激发波长290 nm处可产生荧光,即内源性荧光。内源荧光光谱变化反映了谷蛋白及其水解物中芳香族氨基酸所处的微环境极性的变化情况,是对Protamex酶水解过程中蛋白质三级结构变化的表征[32]。由图4可知,与原玉米谷蛋白相比,Protamex酶水解物的内源性荧光光谱峰位发生明显的红移现象,且内源性荧光强度水解时间的延长而显著增强。这表明水解使玉米谷蛋白的芳香族氨基酸特别是色氨酸的极性环境增强,蛋白质结构伸展。Zheng Zhaojun等[33]通过Bromelain和Alcalase分别水解黑豆蛋白时也获得了相似结果,水解产物的荧光强度均高于原蛋白样品。Protamex属于丝氨酸蛋白酶,酶水解过程中以丝氨酸残基作为活性中心主要促使玉米谷蛋白中酪氨酸、色氨酸、苯丙氨酸及亮氨酸等的羧基端多肽链裂解,导致芳香族氨基酸残基和疏水性氨基酸的暴露,增强了玉米谷蛋白的分子柔性,这有利于玉米谷蛋白质能发挥良好的起泡力和泡沫稳定性。但是在水解150 min尽管有更多的芳香族氨基酸残基暴露,却不能使水解物的起泡力和泡沫稳定性持续增加,这是因为影响玉米谷蛋白水解物起泡性质变化是多种因素相互作用的结果。
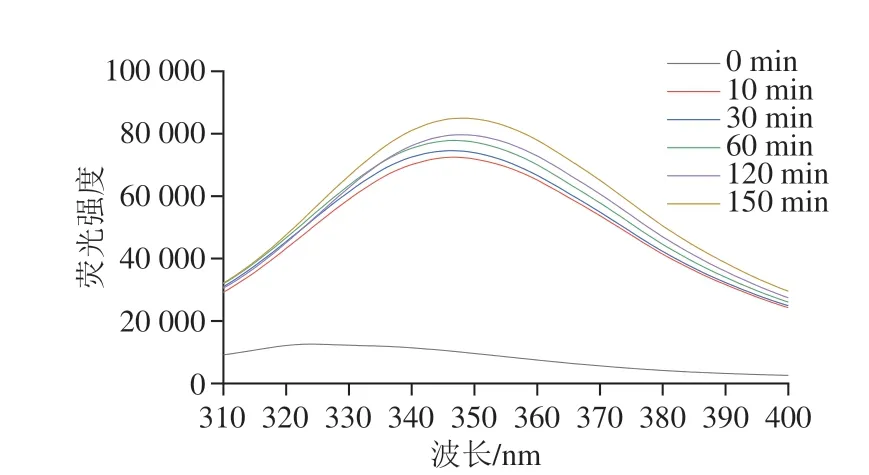
图4 水解时间对玉米谷蛋白内源荧光强度的影响Fig.4 Effect of hydrolysis time on endogenous fluorescent intensity of corn glutelin
2.5 Protamex酶水解对玉米谷蛋白表面疏水性的影响
蛋白质表面疏水性是维持其空间结构、界面性质及分子间相互作用力的重要因素[4]。由表1可知,Protamex酶水解物的表面疏水性显著升高(P<0.05),随着水解时间的延长,表面疏水性指数持续增加。在蛋白质天然构像中,一部分疏水性氨基酸会埋藏在蛋白质分子内部,而经过水解后谷蛋白分子结构变得松散、舒展,使原本包埋于分子内部的疏水基团暴露于表面,疏水基团暴露的增多使得疏水性增强,分子柔性增大,这有利于蛋白质在界面上吸附速率的升高从而提高起泡性[34]。与内源荧光光谱的结果一致,150 min水解物的表面疏水性显著高于其他样品,但其起泡力和泡沫稳定性均降低,这可能是由于此时谷蛋白分子的其他性质因素变化对其泡沫性质的消极作用更显著。
2.6 Protamex酶水解对玉米谷蛋白拉曼光谱的影响分析
由图5可知,玉米谷蛋白及其Protamex酶水解物的拉曼光谱在酰胺I带(1 600~1 700 cm-1)和酰胺III带(1 230~1 350 cm-1)均有属于肽键(—CO—NH—)的振动模式,酰胺I带振动模式主要源于肽基平面内C=O伸缩振动和较小程度的N—H弯曲振动,并且水解物的在1 650 cm-1附近和1 290 cm-1附近的谱峰的强度与玉米谷蛋白相比有所减弱,反映了水解后蛋白质的二级结构发生改变。波数1 004 cm-1归属于苯丙氨酸苯环伸缩振动,由于该谱峰受外界环境影响小而被作为归一化因子。850 cm-1和830 cm-1附近的谱带为酪氨酸双峰带,760 cm-1附近的谱带为色氨酸吲哚环的振动,其谱峰强弱反映了其所处微环境的变化情况[35]。
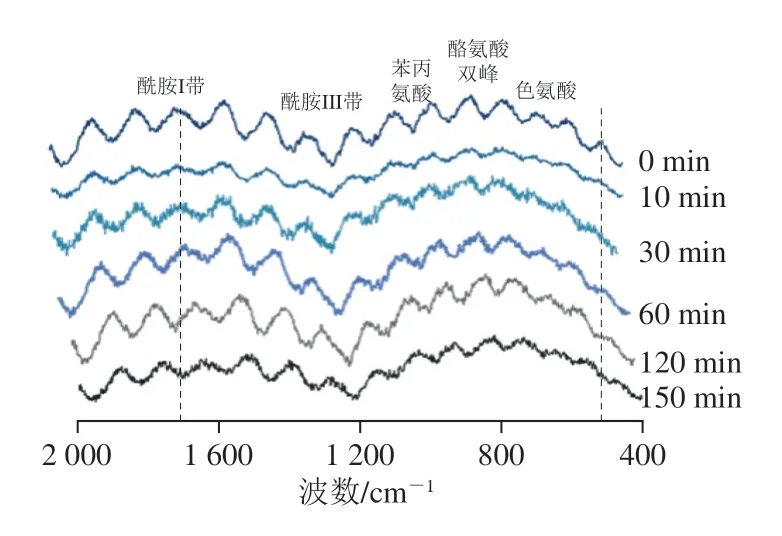
图5 不同水解时间玉米谷蛋白的拉曼光谱Fig.5 Raman spectra of corn glutelin at different hydrolysis times
2.6.1 Protamex酶水解对玉米谷蛋白主链构象分析
通常利用酰胺I带(1 600~1 700 cm-1)对各蛋白质二级结构进行定量分析。酰胺I带拉曼光谱峰的蛋白质二级结构主要由α-螺旋(1 650~1 660 cm-1)、无规卷曲(1 661~1 665 cm-1)、β-折叠(1 666~1 680 cm-1)及β-转角(1 681~1 690 cm-1)附近等构成[35]。由图6可知,玉米谷蛋白中α-螺旋结构含量最高(39.56%),β-折叠和β-转角结构含量相似(21%左右),无规卷曲含量最低(17.99%)。Protamex酶水解物中α-螺旋结构含量显著降低,在酶解120 min时达到最低(26.07%)。随着水解时间的延长,β-折叠结构含量无明显变化,无规卷曲结构含量逐渐增加,β-转角含量显著增加(除150 min酶解物)。这说明Protamex酶水解使玉米谷蛋白的有序结构向无序结构转变,分子柔性增加。Yong Yehui等[36]在PG酶处理麦谷蛋白后发现其的二级结构更加灵活,同时也伴随着β-转角含量增加的现象。α-螺旋结构含有较多氢键,而玉米谷蛋白水解物中蛋白质/多肽表面所带同种电荷增多也会导致氢键断裂使得α-螺旋结构减少[21]。本研究中玉米谷蛋白质分子无序结构增加,分子柔性增强,利于分子内部的疏水性氨基酸暴露,提高蛋白质的疏水性,从而达到改变起泡性和泡沫稳定性的目的。但水解时间延长至150 min无规卷曲结构含量显著高于β-折叠结构,此时玉米谷蛋白水解物的起泡性和泡沫稳定性均有降低,这可能说明高比例的无规卷曲结构不利于玉米谷蛋白在界面形成稳定的界面膜。
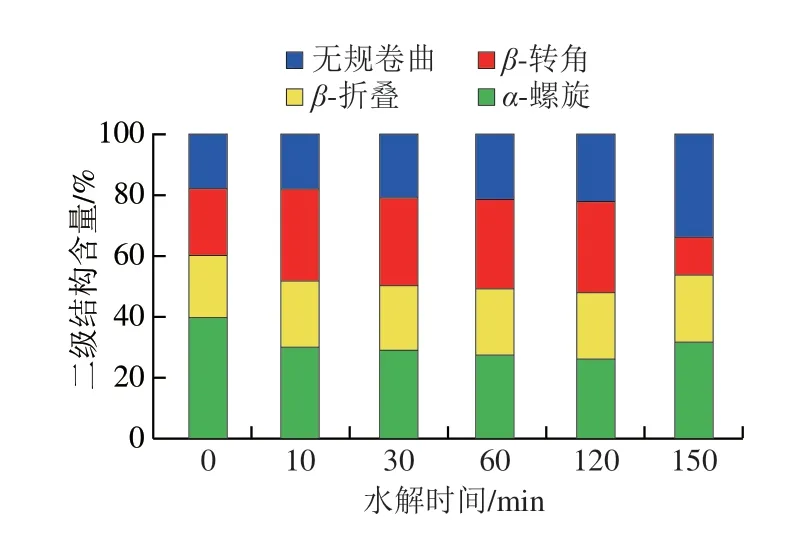
图6 水解时间对玉米谷蛋白二级结构含量的影响Fig.6 Effect of hydrolysis time on secondary structure content of corn glutelin
2.6.2 Protamex酶水解对玉米谷蛋白侧链构象分析
酪氨酸双峰带位于850 cm-1和830 cm-1附近的谱带,是酚羟基的氢键的良好指标。通常用酪氨酸双峰的羟苯基环的呼吸振动和环平面外弯曲振动倍频之间费米共振谱线的相对强度比(I850/I830)反映氢键状态和酪氨酸侧链中酚羟基的电离状态,判定蛋白质中酪氨酸残基的暴露或者埋藏情况[35]。当I850/I830>1.0时,表明酪氨酸残基暴露于水相环境,能够参与温和的或者微弱的氢键作用,而I850/I830<1.0时,表明酪氨酸残基埋藏在疏水环境,倾向于充当氢键供体,起到增强氢键的作用。如图7所示,本研究中玉米谷蛋白的I850/I830为0.58,表明酪氨酸残基埋藏于分子内部。当Protamex酶水解60 min以后,I850/I830均>1.0,此时酶解物中酪氨酸残基呈“暴露”态。这与本研究中疏水相互作用的结果相符(表1)。
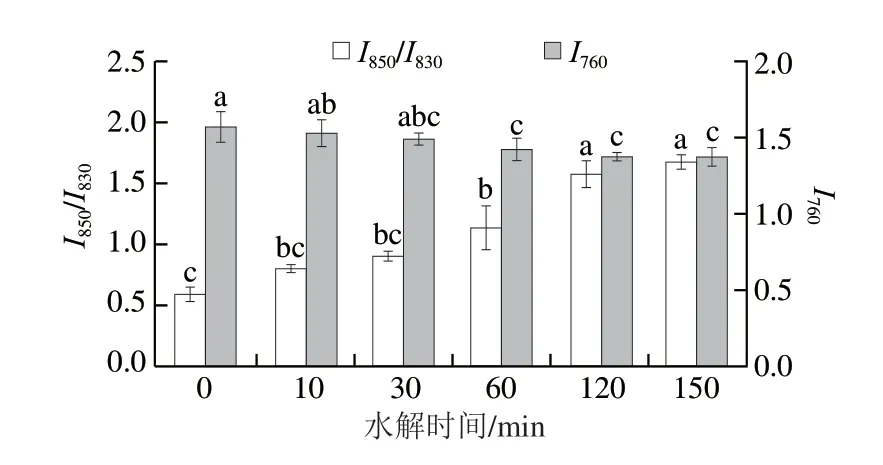
图7 水解时间对玉米谷蛋白I850/I830和I760的影响Fig.7 Effect of hydrolysis time on I850/I830 and I760 of corn glutelin
色氨酸残基的吲哚环伸缩振动会在760 cm-1附近产生光谱,代表色氨酸芳香基的局部环境的变化,埋藏残基比暴露在极性环境中的残基表现出更强的760 cm-1带强度[35]。由图7可知,随水解时间延长,水解物的I760强度逐渐降低。这说明酶解使色氨酸残基逐渐趋向于“暴露”态,疏水相互作用增强提高了蛋白质的表面疏水性,这与内源荧光光谱和表面疏水性的结果一致。江连洲等[37]利用Protex6L酶制剂水解大豆蛋白得到了相似结论,水解可使大豆蛋白分子表面色氨酸、酪氨酸残基等暴露增多。
2.7 Protamex酶水解对玉米谷蛋白静态流变学性质的影响
蛋白溶液的流变学特性是评价蛋白质气/水界面性质的重要指标。由图8可知,玉米谷蛋白及其水解物分散液的表观黏度随着扫描频率的增加而逐渐减小,表现为剪切稀释的流变特性,所有样品均为非牛顿假塑性流体[22]。这说明水解作用没有改变谷蛋白分散液的流变行为。同时,样品分散液的表观黏度与剪切速率能够较好地拟合牛顿幂律方程,即R2>0.95(表2)。
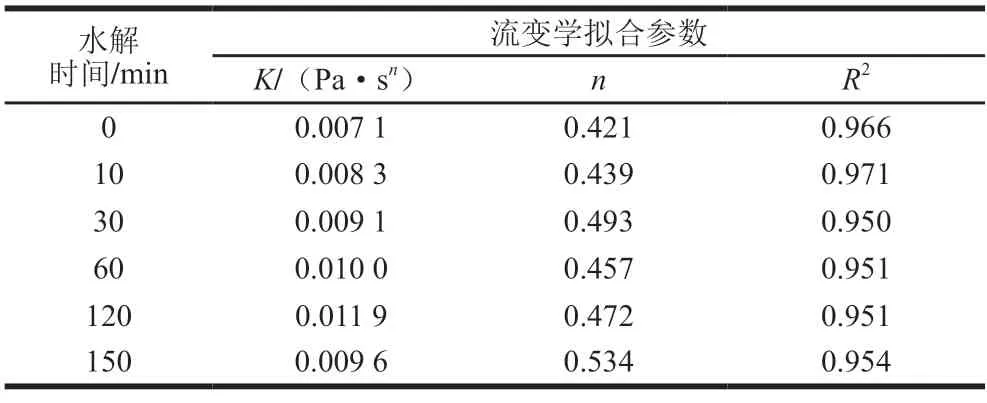
表2 不同水解时间的玉米谷蛋白水解物流变学拟合参数Table 2 Rheological parameters of corn glutelin at different hydrolysis times
根据牛顿幂律方程,K值为黏度系数,代表了流体的黏稠程度,K值越大代表流体越黏稠。由表2可知,K值的变化趋势与图8表观黏度一致,呈现出先增加后降低的趋势,水解120 min样品的K值达到最大,比玉米谷蛋白增加了67%。这一方面是由于酶水解使玉米谷蛋白的粒径减小、溶解性显著提高。另一方面,与天然玉米谷蛋白相比,水解物中的蛋白质/多肽的结构趋于无序、分子柔性更大、表面净电荷降低。这都有了利于增强蛋白质的水合能力,使得复水后蛋白质-蛋白质之间的相互作用增强,表现为表观黏度增强。因此,Protamex酶对玉米谷蛋白的适当水解提高了其水解物中可溶性蛋白质分子定向吸附能力,是其起泡性改善的关键因素。但水解150 min,酶解物的表观黏度下降,这是由于过度水解导致水解物中蛋白质/多肽的粒径持续降低、无序结构增加、静电斥力增大等导致蛋白质溶液流动性增强,分子间相互作用减弱。N为流动指数,代表液体的流动性能,表2中水解150 min样品的n显著高于其他样品,这也表明了此时分散液的流动性最大。
3 结论
采用Protamex酶水解玉米谷蛋白,通过控制水解时间能够显著提高玉米谷蛋白的泡沫性质。当水解时间120 min,水解物的起泡性和泡沫稳定性最高,分别为(350.57±2.83)%和(228.39±2.90)%,且气泡细小均匀、蛋白膜较厚。此时水解物的溶解性较佳、表观黏度值最高。适当的水解一方面使玉米谷蛋白溶解性提高、表面张力降低、分子尺寸减小;另一方面使谷蛋白的α-螺旋含量降低、无规卷曲与β-转角含量增加、疏水性氨基酸残基暴露,进而使分子柔性增强、表面净电荷减少、表面疏水性增强。这有利于玉米谷蛋白水解物中蛋白质分子/多肽持续吸附在界面之上,在气泡之间可形成有一定黏弹性的保护层,促进泡沫的形成以及维持泡沫体系的稳定。然而持续水解至150 min导致水解物中蛋白质/多肽分子尺寸持续降低、结构过度变形即无规卷曲含量显著高于β-转角含量及表面净电荷增加,这导致水解物的气泡间的蛋白膜出现流体排水现象,使得界面膜破裂,气泡将逐渐靠近聚合,即起泡性和稳定性下降。本研究对蛋白酶水解改善玉米谷蛋白和其他植物蛋白起泡性等功能性质的应用和研究提供了一定的理论依据,为玉米蛋白的高值化利用提供参考。
