基于网络药理学和分子对接技术研究祛风药对徐长卿-川芎治疗心房颤动的作用机制*
2024-01-03张振贤陈若宏
侯 宁,张振贤,陈若宏,黄 瑶
1 上海中医药大学,上海 201203; 2 上海中医药大学附属岳阳中西医结合医院,上海 200437
心房颤动(atrial fibrillation,AF)是心房正常节律失去秩序而发生混乱,具有难愈性和复杂性的特点,是临床常见心律失常种类之一。目前国内缺乏大规模AF 流行病学调查,故准确发病率尚不可知。AF 患者易并发缺血性脑卒中,具有高致残及致死率,加之目前射频消融手术费用昂贵,绝大部分患者需长期口服各类抗凝血药物,给家庭和社会带来了巨大的经济负担[1]。根据AF的临床表现,可将其归属于中医学“心悸”“怔忡”等范畴。初发AF多以阵发性AF形式出现,具有突发突止的特点,且常伴有心慌、胸闷、乏力等症状。《素问·风论篇》有云:“风者,善行而数变”,体现中医“风邪”致病的游移不定和变化无常,这正与阵发性AF 特点相类似。因此,国内多位医家以此为理,选择从风邪角度论治AF,临床获效颇丰[2-3]。
徐长卿-川芎是临床常用祛风药对。徐长卿(Cynanchumpaniculatum)为萝藦科植物徐长卿带根的全草,其药性味温、辛,入肝、胃两经,具有祛风利湿、活血止痛、解毒消肿等功效[4]。临床常用于治疗风湿关节和皮肤瘙痒等疾病。现代药理学研究发现从徐长卿干燥根中可提取的一种活性单体成分——丹皮酚,对钙通道具有阻断作用,可使动作电位的持续时间减少,从而发挥抗心律失常的作用[5]。川芎(Ligusticum chuanxiongHort)是伞形科藁本属植物川芎的干燥根茎,药味温、辛,归肝、胆、心包经。川芎具有活血行气、祛风止痛的功效[4]。临床中川芎被普遍用于治疗心脑和风湿关节等疾病,且疗效显著。药理学研究表明,川芎嗪、阿魏酸、西地利特和木本内酯等川芎有效成分均对心肌缺血有保护作用[6]。其中川芎嗪在体外细胞实验中具有开放三磷酸腺苷敏感钾通道和(或)小电导钙激活钾通道的作用[7],可在离子通道的开闭方面与徐长卿产生协同作用。但是目前有关祛风药对徐长卿-川芎治疗AF的物质基础和靶点的研究较少,具体机制尚不明确。故深入研究祛风药对徐长卿-川芎治疗AF 的分子机制具有重要意义。
网络药理学是一个新兴的学科,它融合了多学科及技术,包括基因组学、拓扑学和计算组学等,其通过建立多种网络模型来探索中药与疾病间的潜在机制及关系,有助于探索中药制剂安全性和多药联用的分子机制,为研究药物机制和新药开发提供了新途径[8]。本研究采用网络药理学方法研究祛风药对川芎-徐长卿主要活性成分和干预AF 可能的目标靶点,并用分子对接技术进行部分验证以阐述其可能的作用机制。
1 资料与方法
1.1 药物的化学成分及预测靶点收集首先,通过中药系统药理学数据库与分析平台(http://lsp.nwu.edu.cn/tcmsp.php)检索徐长卿、川芎化学成分,同时根据药物的吸收、分布、代谢和排泄分析,以口服生物利用度(Oral bioavailability,OB)≥30% 及 类 药 性(drug-likeness,DL)≥0.18 筛选两种药物的主要化学成分[9];其次,根据Pubchem 数据库(https://pubchem.ncbi.nlm.nih.gov)确定主要化学成分的SMILES号,并将其导入Swiss target prediction 数据库(http://www.swisstarget-prediction.ch/),选定物种属性“Homo sapiens”。将与徐长卿和川芎小分子化学物质交互作用概率排名前50 位的靶点定为有效预测靶点。随后,将筛选出的主要化学成分及有效预测靶点导入Cytoscape 3.6.1 构建成分-靶点可视化网络。
1.2 疾病的靶点收集通过GeneCards 数据库(https://www.genecards.org/)和OMIM 数据库(https://www.omim.org/)检索关键字“atrial fibrillation”,选择种属为“homosapiens”进行汇总、筛选AF相关基因,然后进行基因规范与去重。
1.3 药物-疾病共同靶点可视化及拓扑属性分析通过Venny 2.1.0 在线软件(http://bioinfogp.cnb.csic.es/tools/venny/index.html)将药物效应靶点和AF 有关靶点交集重叠,发现药物与AF 的交集基因。然后,用Cytoscape 3.6.1 软件构建“中药-成分-重合靶点”网络并利用软件中“Networkanalyze”功能进行拓扑属性分析。
1.4 蛋白相互作用网络构建及核心靶点收集将“1.3”项中经Venny 2.1.0 在线软件做出的重合靶点导入String数据库(https://stringdb.org/)进行检索,将“物种”设置为“Homo sapiens”,设置最低相互作用得分等于0.400。获得蛋白相互作用的结果,导入Cytoscape 3.6.1软件从而构建PPI 网络。与此同时,通过Cytoscape 3.6.1 软件中“Networkanalyze”功能对网络进行拓扑分析,分析内容包括度值(Degree)、接近中心性(closeness centrality,CC)、介度中心性(betweenness centrality,BC)。首先计算出Degree 中位数值,筛选出大于该值2倍的所有节点,将其定义为“big hubs”,然后从中选择其他2 个指标均大于该节点中位数的目标节点,将最终筛选出的节点定义为药物-疾病的核心靶点[10]。
1.5 生物通路富集分析为研究核心靶点在生物信号通路中发挥的作用,本研究利用基因注 释工具Metascape(http://metascape.org)对“1.4”项中筛选出的核心靶点进行有关通路的富集分析。分析主要生物通路,探讨祛风药对徐长卿-川芎治疗AF可能的作用机制。
1.6 分子对接分子对接是评价药物活性成分与靶点结合能力的方法[11]。首先,通过TCMSP 下载“1.1”项筛选出的主要化学成分分子结构,保存为“mol2”格式作为配体;其次,筛选药物-疾病核心靶点Degree 排名前5 位的基因靶点,并利用PDB 数据库查找相对应靶蛋白3D 晶体结构[12]作为受体;最后通过CB-Dock网站[13](http://cao.labshare.cn/cb-dock/)进行分子对接。此外,再利用Originlab2019 将化合物以及对应靶蛋白对接得到的Vina 得分构建热图,从而筛选最佳对接构象并进行部分展示。
2 结果
2.1 有效成分及靶点通过TCMSP 数据库筛选徐长卿、川芎化学成分,符合OB≥30%和DL≥0.18的条件,共得到6 个徐长卿有效化学成分,7 个川芎有效化学成分,其中1 个为两药共有化学成分(MOL000359)。见表1。

表1 徐长卿-川芎药对有效化学成分基本信息
分别将12 种有效化学成分的SMILES 号导入Swiss target prediction 数据库筛选交互作用概率排名前50位的靶点。结果一种成分(MOL002140)无有效预测靶点,余有效化学成分共筛选出379个靶点,其中徐长卿和川芎有效化学成分重合靶点124 个。构建药物活性成分-潜在靶点网络。见图1。
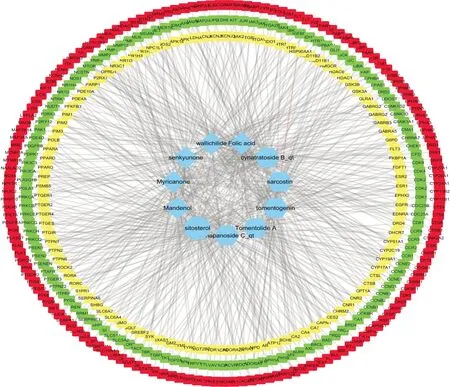
图1 徐长卿-川芎药对活性成分-潜在靶点网络
2.2 疾病有关靶点及交集靶点的筛选通过GeneCards 和OMIM 数据库,以“atrial fibrillation”为检索词,收集、汇总和剔重靶点,共得到2924 个相关靶点,再利用Venny 2.1.0 在线软件得到与药物活性成分-潜在靶点交集靶点,共144个,此可能为川芎-徐长卿治疗AF 的潜在作用靶点。见图2。
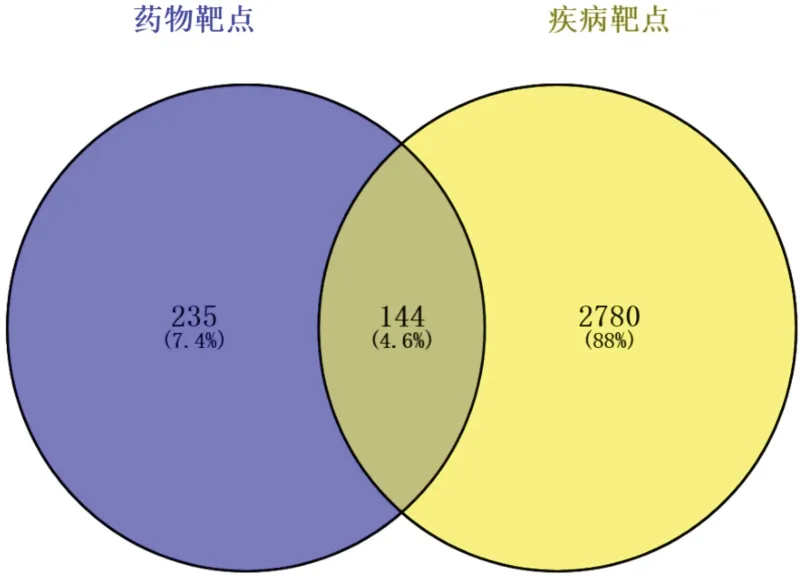
图2 徐长卿-川芎药对靶点与AF靶点交集韦恩图
2.3 中药-成分-重合靶点网络构建和拓扑属性分析利用Cytoscape 3.6.1 软件的“Networkanalyze”功能分析得出,该网络共包括157 个节点和254 条边,其中2 种中药节点,11 种化学成分节点,144 种靶点节点。网络中BC 均值为0.016、CC 均值为0.291、Degree 均值为3.24。而目标靶点的Degree 均值1.68。其中毛红厚壳内酯A(Tomentolide A)和徐长卿甙B_qt(cynatratosideB_qt)同时 位 列Degree 值 首 位(Degree 值29)。中药-成分-重合靶点网络见图3。
2.4 蛋白相互作用网络构建及核心靶点收集将144个交集靶点上传至STING数据库,将蛋白-蛋白互作结果导入至Cytoscape 3.6.1 软件,见图4。该网络共包括142 个节点和1267 条边,其中两个靶点无蛋白相互作用。利用“Networkanalyze”功能分析其网络拓扑学属性,结果分析得出Degree 中位数为12,CC 中位数为0.462,BC中位数为0.002。根据大于2 倍Degree 中位数和大于其他指标中位数的筛选标准,共筛选出34 个关键靶点。见表2。
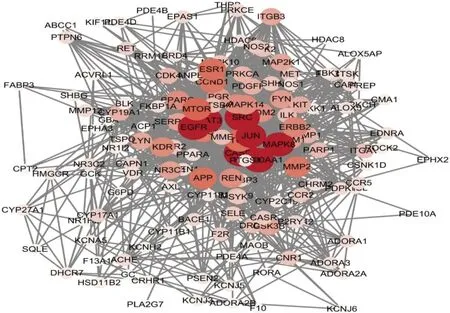
图4 徐长卿-川芎药对治疗AF的PPI网络
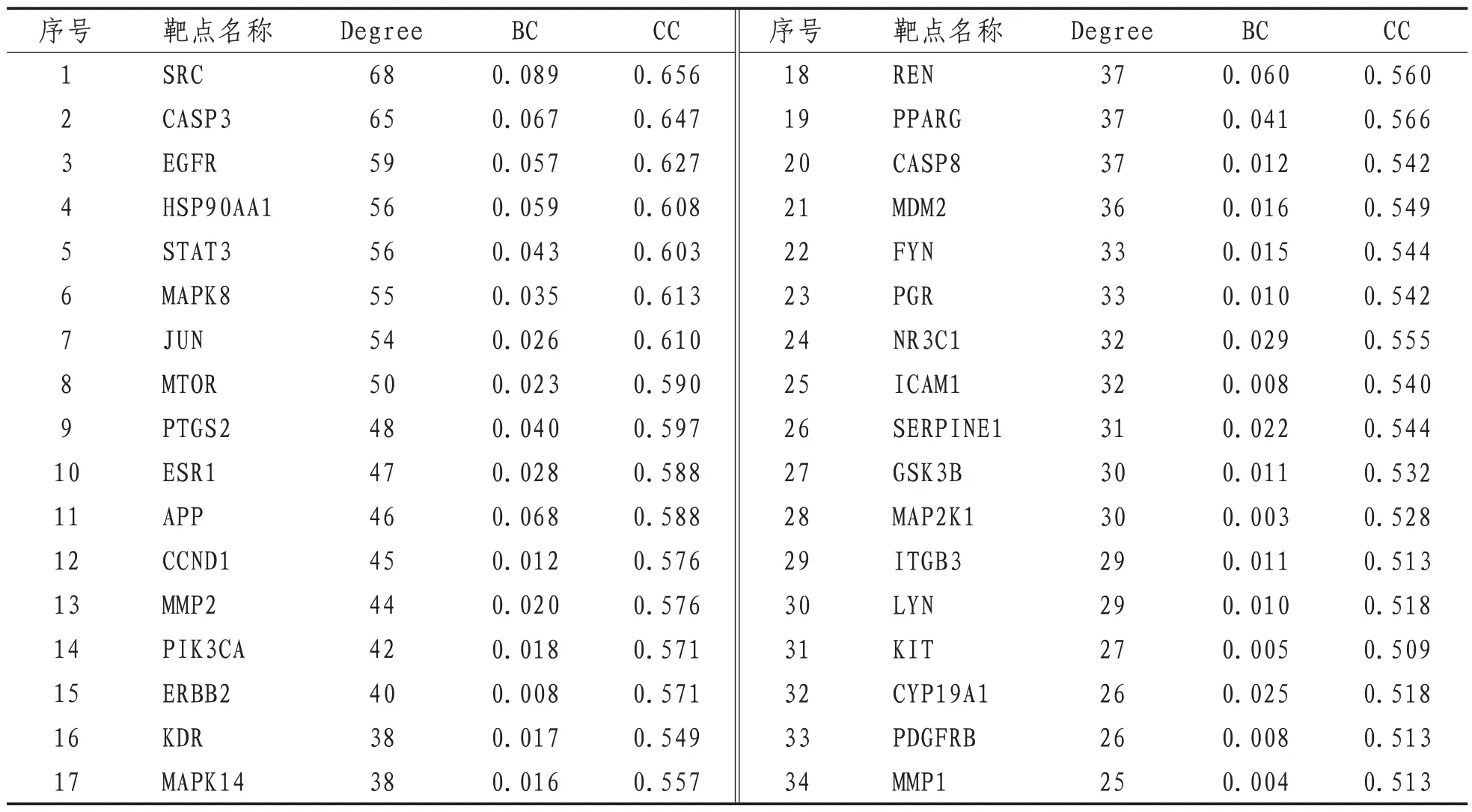
表2 核心靶点及网络拓扑学信息表
2.5 生物通路富集分析将徐长卿-川芎治疗AF的PPI网络中筛选出的34个关键靶点导入Metascape数据库,对其进行生物通路富集分析,结果发现徐长卿-川芎治疗AF的通路主要涉及癌症途径、内分泌抵抗、卡波西氏肉瘤相关疱疹病毒感染、生长因子受体和第二信使信号转导,还可能涉及血流动力学、炎症因子表达等信号通路。此外,富集分析发现多个调控细胞和调控酶生物过程也参与其中。见图5—6。
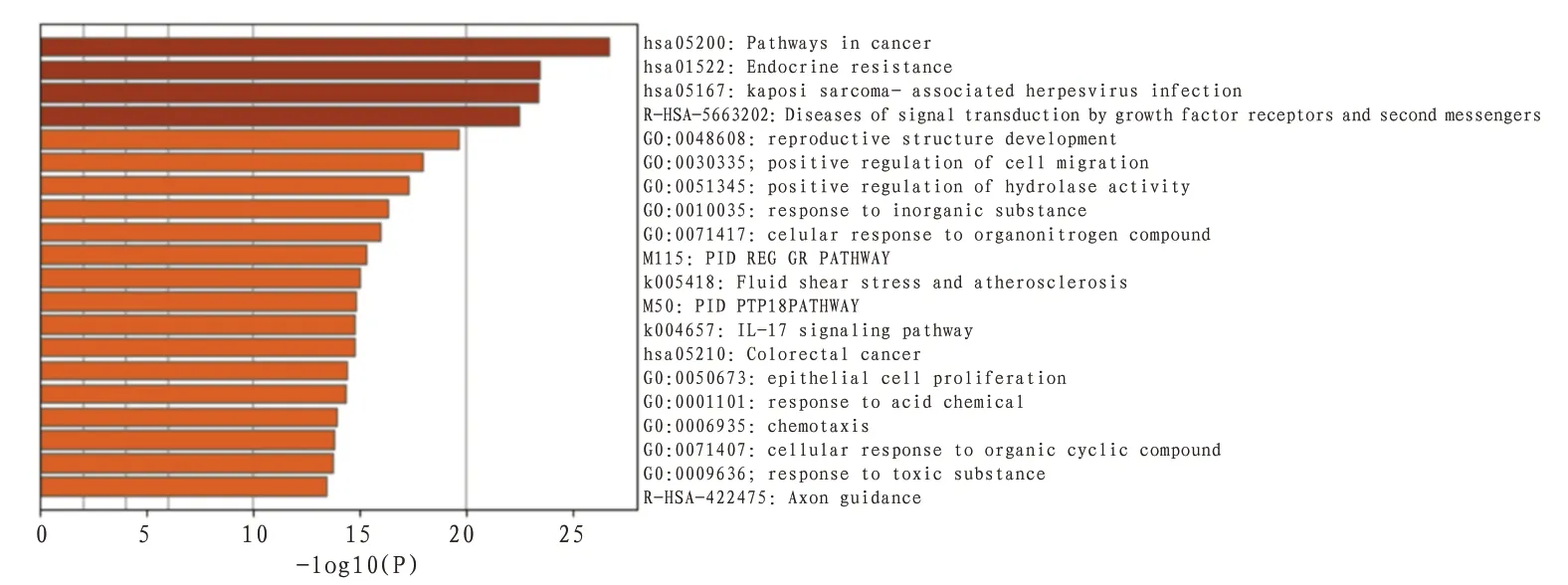
图5 徐长卿-川芎药对治疗AF生物通路热图
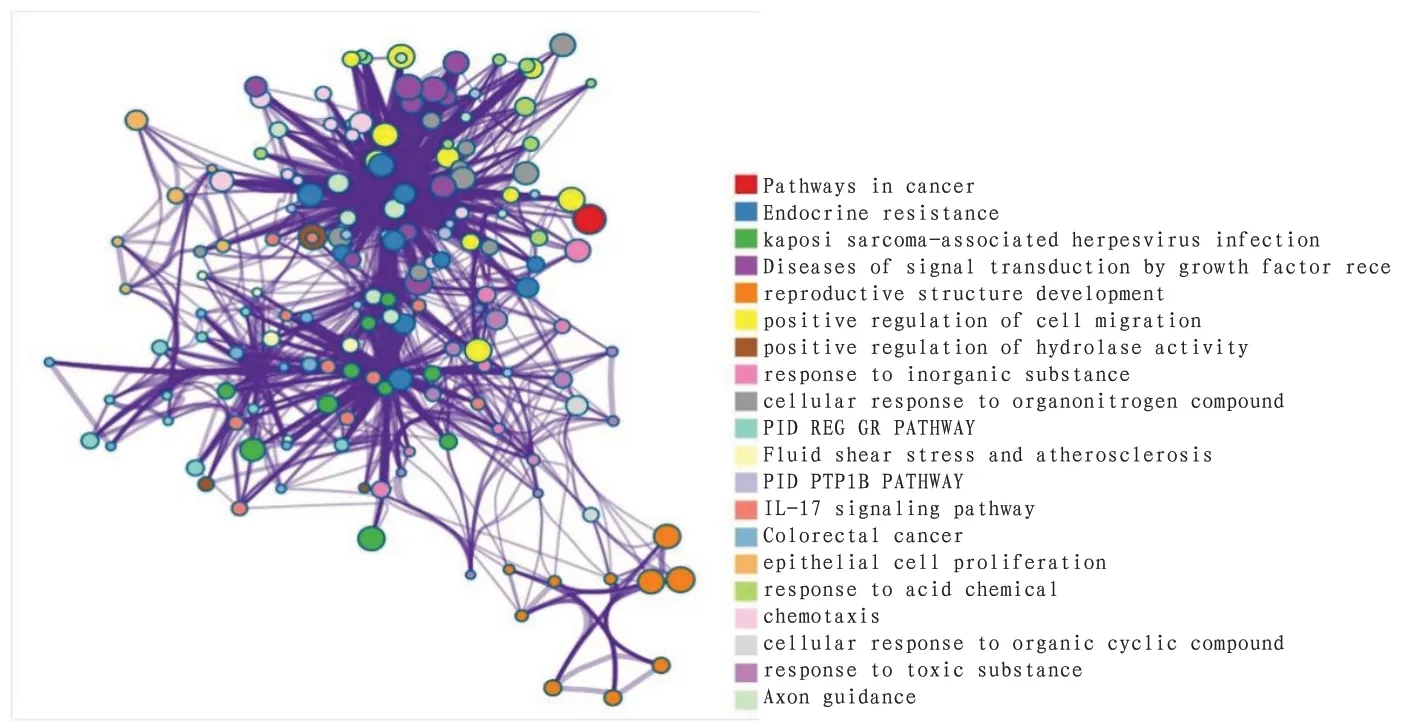
图6 徐长卿-川芎治疗AF富集分析
2.6 分子对接验证CB-Dock 是一种界面友好的在线分子对接工具,它通过AutodockVina 对接程序完成分子对接。“Vina score”代表通过Vina程序所获得的口袋参数对受体和配体分子对接产生的复合得分,“Vina score”越低反应受体和配体亲密性越高[14]。经筛选,药物-疾病核心靶点Degree排名前5位的基因靶点为SRC、APP、CASP3、REN、HSP90AA1。通过PDB 数据库查询它们所对应的靶蛋白分别为:2SRC、3DXC、3DEH、2REN、3HZ5。由图7 可知,各有效化学成分比较,徐长卿所含毛红厚壳内酯A 与靶蛋白2SRC、3DEH 及3HZ5 结合Vina score 平均分值最低,提示该化合物与靶蛋白具有良好的亲和力。毛红厚壳内酯A 与三种靶蛋白具体分子对接模式见图8。
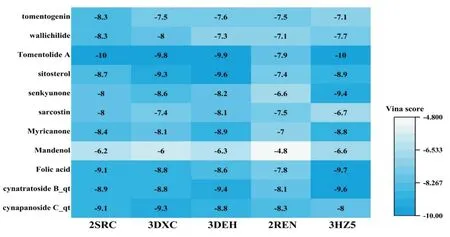
图7 徐长卿-川芎药对有效化学成分和核心靶点对接得分热图
3 讨论
《黄帝内经》曰:“风者百病之长也。”多种疾病的发生、发展都与“风”关系密切,而风又有内外之分。外风袭心可致心悸、怔忡。早在《诸病源候论》就有云:“风邪搏于心,则惊不自安,惊不已,则悸动不定。”肝阳化风、阴虚风动所致的内风也可导致心悸发生,正如《景岳全书》中记载:“命门水亏,真阴不足而怔忡不已者,左归饮。”因此在临床辨证论治AF 的过程中酌加祛风、熄风之药有助病情改善。徐长卿和川芎正是两种代表性的祛风药物。李中梓《医宗必读》曰:“治风先治血,血行风自灭”,两者同时兼有活血之功效,是治疗AF 的优选药物。此外,风邪与炎症细胞因子致病广泛相似,且两者多数是同一种疾病中西医两方面的致病因素[15]。而炎症细胞因子是AF 重要病因之一[16]。徐长卿和川芎的中药药理作用中恰有抗炎和抗氧化应激的作用[17-18]。这加深了研究祛风药对徐长卿-川芎治疗AF的意义。
本研究共收集徐长卿-川芎有效化学成分12种,具有治疗靶点的活性成分11 种,潜在干预AF靶点144 个。徐长卿所含的有效化学成分毛红厚壳内酯A 和徐长卿甙B_qt(cynatratosideB_qt)具有最多的潜在靶点,因此推断徐长卿在干预AF 多靶点的过程中发挥更大作用。经潜在干预靶点PPI 网络拓扑学分析,进一步筛选出34 个核心靶点。排名前五位的是SRC、APP、CASP3、REN、HSP90AA1。其中部分靶点已经证明在AF 的发病和病情的演变过程中有重要作用。首先,MEIJERING 等[19]发现改变SRC 所产生的激酶的药理学作用可能为临床治疗AF 提供新的治疗可能性;其次,APP 所表达的β-淀粉样蛋白通过其对钙稳态和调节蛋白的直接作用显示出致心律失常活性,从而通过肺静脉中淀粉样蛋白的沉积在AF 的发生中发挥潜在作用[20]。此外,CASP3 蛋白表达的遗传抑制可导致AF 相关凋亡的抑制[21],表明CASP3 在致心律失常性心房重构的发病机制中起重要作用。LUO 等[22]调查了889 名AF 患者和1015名对照者中CASP3 基因多态性,发现该基因与中国汉族人群AF 风险独立相关。此外,REN 为表达肾素的重要基因,临床中使用肾素-血管紧张素系统抑制剂可缓解AF 患者病情[23]。虽然核心靶点HSP90AA1 尚未有直接的实验证明其在AF 中的作用,但动物实验研究表明HSP90AA1 是心肌缺血再灌注时miR-1 的新靶点,HSP90AA1 的恢复可能对缺血的心肌产生保护作用,也表明该靶点在心血管疾病研究中的重要地位[24]。
徐长卿-川芎各有效化学成分间有密切的协同关系,其核心靶点在AF 中发挥着至关重要的作用。为进一步研究徐长卿-川芎治疗AF 的作用机制,将34 个核心靶点进行生物通路富集分析。发现生长因子受体和第二信使的信号转导及IL-17信号通路最有可能是徐长卿-川芎治疗AF 的关键通路。此外,机制中可能还涉及炎症因子表达和血流动力学等方面的信号通路。其中生长因子受体和第二信使的信号转导中有AKT1、PIP2、PIP3、PI3K 等重要信号节点参与,它们均与AF 关系密切。其中大量血管紧张素Ⅱ可激活AKT1 以及TGF-β-Smad2/3 信号通路,最终激活NF-kB 靶基因[25]。而大量血管紧张素Ⅱ诱导AF 模型经高通量测序过程中发现有1719 个基因在心房中有差异化表达,其主要参与调节细胞迁移、细胞黏附、补体活化和炎症反应等[26]。KCNQ 相对应的基因突变是导致AF 重要原因之一,其碳末端的关键区域似乎是由PIP2 调节以稳定通道开放状态[27-28]。PIP3 则可以增强胰岛素信号从而增加钠离子电流,最终降低AF 的易感性和持续时间[29]。CHONG等[30]研究发现,上调PI3K、AKT 表达可起到治疗心衰兔模型中AF 的作用。促炎症因子IL-17 参与AF的发展过程,可能与IL-17参与体内炎症、氧化应激和心肌纤维化等多个途径有关[31]。这证明祛风药对徐长卿-川芎在治疗AF 过程中有抗炎机制参与,且与中医祛风理论密切相关。GO 富集分析提示水解酶活性的正调控生物过程可能参与其中。故有研究发现作为基质金属蛋白水解酶9 和基质金属蛋白水解酶2的表达上调与AF患者心房结构重构的高调控指标呈正相关,证明两者均参与AF的发生、发展过程[32]。
分子对接验证发现,徐长卿所含毛红厚壳内酯A 与靶蛋白2SRC、3DEH 及3HZ5 结合Vina score平均分值最低,提示该化合物与靶蛋白具有良好的亲和力,且该化合物存在最多潜在靶点。因此,推断徐长卿在治疗AF 过程中发挥更大作用,但该推断尚需进一步实验验证。
本研究通过网络药理学和分子对接的方法研究祛风药对徐长卿-川芎治疗AF 的机制,进一步证实了中药通过多靶点及复杂途径治疗疾病的过程。徐长卿-川芎治疗AF活性成分主要是毛红厚壳内酯A等12种。而SRC、APP、CASP3、REN、HSP90AA1等34 个核心靶点可能通过生长因子受体和第二信使的信号转导及IL-17 信号通路,以及多种调控细胞和调控酶的参与下,起到减少AF 患者炎症反应,保护心肌细胞,改善心肌重构等作用。本研究可为祛风药对徐长卿-川芎治疗AF 提供一定的依据,也可为中西医融合发展研究提供思路。
