双嘧达莫无定形药物体系动力学稳定性评价
2024-01-02孙嘉汝李聪伟田雅雯杨彩琴
孙嘉汝 李聪伟 田雅雯 杨彩琴
摘要:目的 本研究制备双嘧达莫无定形药物体系,并研究其晶化动力学稳定性和热分解动力学稳定性。方法 通过熔融-冷却-复融的方法成功制备了双嘧达莫无定形药物体系,并用粉末X-射线衍射(PXRD)和温度调制差式扫描量热(TMDSC)进行了表征,高效液相色谱(HPLC)及氢核磁(1HNMR)技术对样品进行了纯度分析及结构确证。采用动态差示扫描量热分析方法研究样品的非等温晶化动力学性质,采用多速率无模型方法评估样品热分解动力学稳定性,并对其贮存有效期进行推断。结果 双嘧达莫晶化机理为三维生长的体积析晶,热分解机理函数为G(a)=[-ln(1-a)]3/4,属于随机成核和随后生长机理(n=3/4),贮存有效期约为4~5年。结论 双嘧达莫无定形药物体系容易晶化,但热稳定性较高。本研究为双嘧达莫无定形药物体系的进一步临床应用提供理论基础,也为其它无定形药物体系动力学稳定性研究提供参考。
关键词:双嘧达莫;无定形;动力学稳定性;晶化;热分解
中图分类号:R94文献标志码:A文献标识码
Evaluation of kinetic stability of dipyridamole amorphous drug system
SUN Jiaru,LI Congwei,TIAN Yawen,YANG Caiqin*
(School of Pharmacy,Hebei Medical University,Shijiazhuang,Hebei 050017,China)
Abstract: Objective To prepare the dipyridamole amorphous drug system, and study its kinetic stability of crystallization and thermal decomposition. Methods The dipyridamole amorphous drug system was successfully prepared by melting-cooling-remelting method. It was verified by powder X-ray diffraction (PXRD) and temperature modulated differential scanning calorimetry (TMDSC), and its purity and chemical structure were analyzed by high performance liquid chromatography (HPLC) and hydrogen nuclear magnetic resonance (1HNMR) techniques. Dynamic different scanning calorimetry analysis was used to study the non-isothermal crystallization kinetics of the sample. The kinetic stability of thermal decomposition of samples was evaluated by multi-rate model-free method, and the shelf life was deduced. Results The crystallization mechanism of amorphous dipyridamole was three-dimensional growth volume crystallization and thermal decomposition mechanism function was G(a)=[-ln(1-a)]3/4, which belonged to random nucleation and subsequent growth mechanism (n=3/4); The shelf life of dipyridamole would be about 4~5 years. Conclusions Dipyridamole amorphous drug system tends to crystallize easily but has high thermal stability. This study provides a theoretical basis for the further clinical application of dipyridamole amorphous drug system, and also provides a reference for the study of kinetic stability of other amorphous drug systems.
Key words: dipyridamole;amorphous;kinetics stability;crystallization;thermal decomposition
雙嘧达莫是抗血栓形成的药物,广泛用于急慢性冠脉功能不全、心绞痛、血栓栓塞性疾病的治疗。近期研究发现,它还具有抗炎、抗氧化和抗肿瘤等新的药理作用[1-2],双嘧达莫在“老药新用”方面表现出的极大潜力,使其具有良好的再开发价值。但双嘧达莫属于BCS II类药物,普通制剂存在生物利用度低、缓释制剂日剂量高等临床不足[3-4],开发双嘧达莫新型制剂是亟待要解决的问题。包合物、微乳、共晶、无定形等可用于解决药物水溶性差的问题,在这些策略中,难溶性晶态药物的无定形化是提高其生物利用度的最有效途径之一[5]。但无定形药物体系处于热力学高能态,在制备、储存和给药等过程中极易发生转晶,一旦再结晶,其快速溶解、极速释放的优势就不复存在,甚至会出现严重的不良后果[6]。因此,无定形药物体系动力学稳定性评价是其开发的关键部分。
本研究创新性地将固体动力学的原理应用于双嘧达莫无定形药物体系的稳定性研究之中。采用快速、用量少,方法灵敏的热分析技术研究样品的晶化动力学和热分解动力学性质,计算晶化过程和热分解过程的活化能,探讨晶化和分解机理,推断出双嘧达莫无定形药物体系晶化动力学稳定性和热分解动力学稳定性,预测药物贮存的保质期,为药物的贮存条件和贮存时间提供准确的信息。该研究解决的是双嘧达莫无定形药物研发过程中最根本、最重要的稳定性问题,为其进一步开发应用奠定理论基础。
1 材料与方法
1.1 主要仪器与试剂
差示扫描量热分析仪(德国耐驰仪器制造有限公司,DSC 214);热重分析仪(德国耐驰仪器制造有限公司,TG 209 F3型);粉末X射线衍射仪(美国Rigaku公司,SmartLAb SE);高效液相色谱仪(安捷伦科技有限公司,Agilent1200);核磁共振波谱仪(中科牛津波谱技术有限公司,WIPM-NMR-400);管式炉(天津市通达实验电炉厂,Sk2-2.5.1.3)。双嘧达莫(99%,索莱宝科技有限公司)。
1.2 实验方法
1.2.1 双嘧达莫无定形药物体系的制备、表征、纯度分析和结构确证
采用熔融-冷却-复融的方法制备双嘧达莫无定形药物体系[7]。具体方法如下:称取双嘧达莫晶态原料药100mg平铺于铝箔纸中,密封,置于管式炉中,调节N2流速为10mL·min-1,以5℃·min-1速率升温,升温范围30~190℃,自然冷却至室温,再升温至190℃,取出样品置于冰盒中骤冷20 min,真空干燥备用。
粉末X射线衍射(PXRD)测定条件:Cu靶,電压40 kV,电流50mA,扫描速率8°/min,扫描范围5~40°,步长0.04°。
温度调制差示扫描量热(TMDSC)分析测定条件:温度范围-10~60℃,升温速率2 K·min-1,振幅0.5 K,周期60s。
高效液相色谱(HPLC)测试条件:C18反向色谱柱 (150mm×4.6mm, 5 μm,Agela),检测波长284nm,柱温25℃,流动相为甲醇∶水= 75∶25 (v/v),流速1.0mL·min-1,进样量20 μL。
氢核磁(1HNMR)测试条件:分别将约5mg的双嘧达莫晶态与无定形态样品溶于500μL氘代DMSO中,光谱宽度设定为11 013 Hz,扫描次数16,弛豫时间D1为1s,温度293.1 K。
1.2.2 双嘧达莫无定形药物体系的动力学稳定性
差示扫描量热(DSC)分析测试条件:样品质量为6mg,温度范围0~200℃;热重分析(TG)测试条件:温度范围30~750℃,样品质量为7mg,升温速率分别为5、10、15、20、30 K·min-1,N2流速为40mL·min-1。
2 结果与讨论
2.1 双嘧达莫无定形药物体系的表征、纯度分析和结构确证
2.1.1 X射线衍射分析
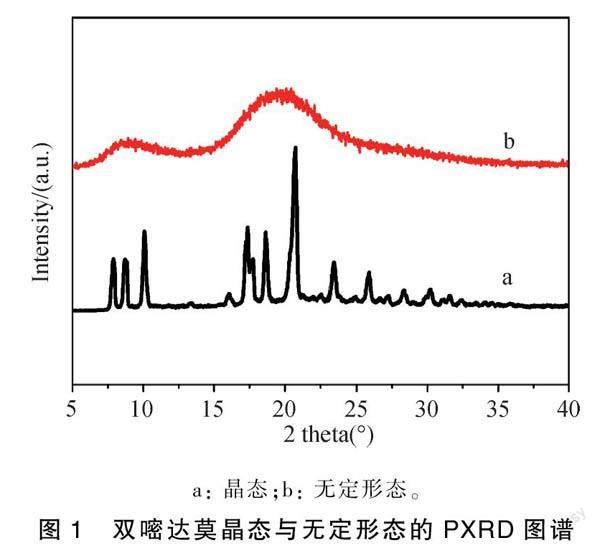
双嘧达莫晶态原料药和制备样品的PXRD图谱见图1。双嘧达莫在2θ为7.88°、8.72°、10.12°、17.36°、18.61°、20.77°、23.41°和 25.85°处有特征晶体衍射峰,而制备样品的衍射图谱呈弥散状驮峰,初步判断无定形态的形成。
2.1.2 温度调制差示扫描热分析
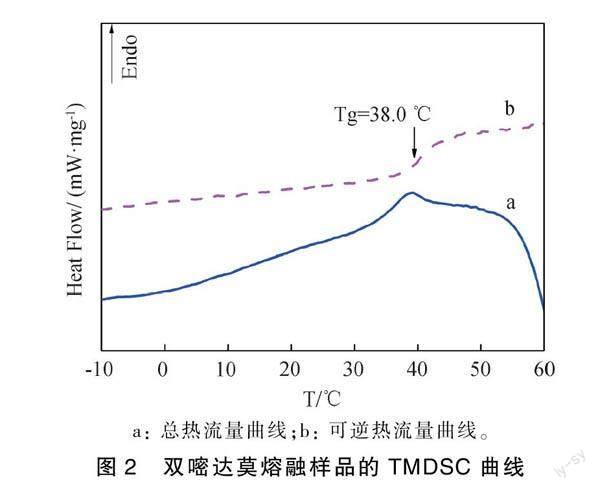
由于物质微晶化也可使PXRD图谱显现弥散衍射晕[8],因而仅仅通过PXRD无法确切判断无定形态的形成。差示扫描量热分析给出的是总的热流量信号,当样品在同一温度发生多种热现象时,其峰则可能会重叠,因而会造成不确定的判断。TMDSC分析手段在无定形表征方面发挥着不可替代的作用,TMDSC克服了由可逆与不可逆信号叠加相互抵消而引起的判断错误,其无定形特有的热力学特征参数―玻璃转变温度(Tg)常用于表征无定形的形成[9]。图2的TMDSC图谱中,熔融样品的可逆热流信号曲线中出现一个吸热台阶,Tg为38℃,由此证明无定形新体系的形成。
2.1.3 高效液相色谱分析
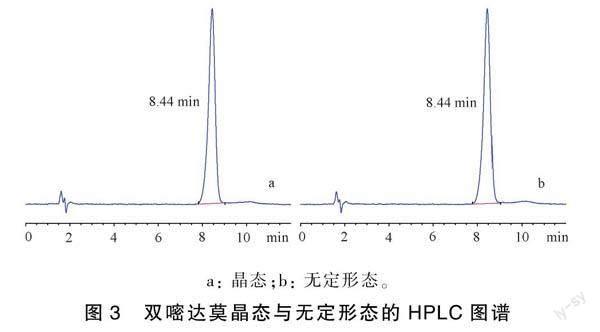
采用HPLC法,通过有无杂质峰可以判断样品的纯度。由图3可知,双嘧达莫晶态原料药保留时间为8.44min,无定形态保留时间为8.44min,二者保留时间完全一致,而且无定形态色谱图中未出现其他的杂质峰。因此可认为双嘧达莫无定形药物体系在制备过程中并未出现分解现象,所制样品纯度较高。
2.1.4 氢核磁分析
1HNMR常用于测定药物分子中氢原子的种类和个数比见图4。
如图4所示,氘代DMSO溶剂峰的化学位移在2.50ppm和3.32ppm,双嘧达莫的化学位移及氢原子个数依次为:I:1.65ppm(12H);II:3.58ppm(16H);III:4.04ppm(8H);IV:4.67ppm(4H)。晶态和无定形态的氢原子种类、个数及化学位移均相同,表明了本实验中制备的双嘧达莫无定形样品与晶态药物结构完全一致。
2.2 双嘧达莫无定形药物体系晶化动力学研究
无定形药物体系晶化过程的动力学研究是一个热门课题,主要是因为其晶化过程与实际应用过程密切相关,深入理解晶化机理对于无定形药物体系的开发具有重要的理论指导意义。本实验采用动态DSC分析方法研究双嘧达莫无定形态的非等温晶化动力学性质。无定形不同升温速率的DSC曲线见图5,随着温度升高,无定形体系呈现玻璃化转变、晶化、再熔融的特征,且随升温速率的增大,晶化特征温度(晶化起始温度、晶化峰温度、晶化结束温度)依次升高,说明其晶化行为与升温速率有关,具有显著的动力学效应,晶化特征温度数值见表1。
2.2.1 晶化活化能的计算
分别采用以下数学模型计算双嘧达莫无定形药物体系的晶化活化能。
Kissinger 方程[10]:
Ec为晶化活化能,β为升温速率,R为气体常数(8.314 J·mol-1·K),Tp为晶化峰顶温度,Tc为DSC晶化起始温度,C为常数,K0为频率因子。分别以lnβ/Tp2、lnβ/Tp及lnβ对1/Tp作图,通过线性拟合,由回归方程斜率计算无定形体系的晶化活化能。计算结果如下:Kissinger、Qzawa和Augis-Bennet方法计算的Ec分别为93.85、100.04和96.94 kJ·mol-1,3种方法计算结果接近,都可用以无定形药物体系的晶化活化能的计算,平均值为96.94 kJ·mol-1。
2.2.2 晶化机理
无定形态的结晶动力学遵从经典的Johnson-Mehl-Avrami理论方程[13],n可以通过Augis-Bennett方法计算,n=2.5RTp2/(△TFWHM Ec),Ec为Augis-Bennett方法计算的晶化活化能,将活化能和不同升温速率对应的Tp、△TFWHM代入,求出n平均值为3.8±0.52。
晶化机制分为表面晶化(n=1)和体积晶化,体积晶化又分为一维生长(n=2)、二维生长(n=3)和三维生长(n=4)[14],一般,n值越大样品越容易晶化。由计算结果说明双嘧达莫无定形态的晶化指数n≈4,为三维生长的体积晶化机理,n值较大意味着双嘧达莫无定形态容易析出晶体。
2.3 双嘧达莫无定形药物体系热分解动力学稳定性
通过研究药物热分解动力学可以了解药物的化学分解速率、分解途径和分解机理。与传统的研究药物稳定性的方法相比,热分析技术借助动力学参数,耗时少,可以通过简單的方法预测药物的保质期,为药物的贮藏条件和时间提供准确的信息。本实验采用多速率无模型的方法评估样品热分解的动力学稳定性[15]。
不同升温速率下双嘧达莫无定形态的TG和DTG曲线见图6,TG曲线没有明显的失重台阶,但DTG曲线呈现两个放热峰,判断药物的热分解分两步完成,但第一步热分解峰明显,第一步分解失重率为33.20%,由双嘧达莫的摩尔质量504.6,计算出失去的基团质量167.3,推测该步失去了嘧啶环上的两个哌啶环(理论值为168)。一般情况下,热分解动力学都是以第一热分解峰作为研究对象[16],药物第一步分解也就意味着失效变质,因此,以下部分的动力学研究均只考虑第一步热分解。
2.3.1 热分解动力学活化能和指前因子的计算
分别采用Ozawa方程[17]和Kissinger方程[18]计算双嘧达莫无定形态的热分解活化能和指前因子。
Ea:热分解活化能;Tp:DTG曲线的峰值温度;A:指前因子;G(α):积分机理函数;α:失重率,α=(m0-mT)/(m0-mf)=(m0-w%·m0)/(m0-w剩余%·m0)= (1-w%)/(1-w剩余%),其中m0、mT、mf分别为样品起始时的质量、温度T时的质量及终了的质量;w为质量分数。分别以lnβ对1/T及lnβ/Tp2对1/Tp作图,通过线性拟合,由回归方程斜率和截距计算Ea和A,结果见表2。Ea是描述样品受热分解时需越过的能垒,在一定程度上反映了样品分解能力的大小,Ea越大,样品越不易分解,即热稳定性越高;反之,热稳定性较差。从热分解活化能的数值分析,双嘧达莫无定形态受热不易分解,热稳定性较高。
本文在动力学稳定性考察中,采用了多种模型同时计算,彼此间可相互校验,提高了分析结果的准确性。测试条件的稳定性是影响动力学结果的关键因素,在具体实验中,要确保试样填充量、试样粒度、试样摆放位置等测试因素一致,在不同升温速率的TG及DSC分析实验中,测试的样品均需研磨过筛,并保证测试样品的质量尽可能保持一致。
2.3.2 热分解机理函数的确定
将Ozawa方程变换为:
从TG曲线中,读出相同温度下不同升温速率β时的α值,分别代入35种机理函数G(α)[19],以lgG(α)对lgβ做图,根据回归方程得到截距a、斜率b和相关系数r;则斜率b最接近-1,且相关系数r最好的G(α)即为该固态体系对应的机理函数。综合分析所得的计算结果,推断出无定形态的热分解机理函数为G(a)=[-ln(1-a)]3/4,机理函数名称为Avrami-Erofeev,属于随机成核和随后生长机理(n=3/4)。
2.3.3 无定形药物体系贮存有效期的推断
将双嘧达莫无定形态的A和Ea代入Arrhenius方程(k=Ae-Ea/RT),求出298 K时pk值,根据文献报道药品的pk值和贮存有效期的关系[20],判断无定形药物贮存有效期约为4~5年(表2)。
3 结论
本实验采取熔融-冷却-复融法制备了双嘧达莫无定形药物体系,PXRD和TMDSC图谱表征了无定形药物体系的形成,HPLC和1HNMR技术分析了样品的纯度和结构。采用非等温多速率分析方法评价了无定形态的晶化动力学和热分解动力学稳定性。双嘧达莫无定形态的晶化机理为三维生长的体积析晶,其晶化过程中需越过的能垒即活化能较小,意味着无定形态容易析出晶体;从热分解活化能的数值分析,双嘧达莫无定形态受热不易分解,热稳定性较高。本研究建立的稳定性的评价方法为无定形药物的生产、贮存以及生产中的工艺优化提供理论依据。
参考文献(References)
[1]CIACCIARELLI M, ZERBINATI C, VIOLI F, et al. Dipyridamole: a drug with unrecognized antioxidant activity[J]. Current Topics in Medicinal Chemistry, 2015, 15(9): 822-829.
[2]GE S M, ZHAN D L, ZHANG S H, et al. Reverse screening approach to identify potential anti-cancer targets of dipyridamole[J]. American Journal of Translational Research, 2016, 8(12): 5187-5198.
[3]RABBIE S C, FLANAGAN T, MARTIN P D, et al. Inter-subject variability in intestinal drug solubility[J]. International Journal of Pharmaceutics, 2015, 485(1-2): 229-234.
[4]田霞, 丁江生, 范云周, 等. 制劑新技术在双嘧达莫新剂型中的研究进展[J]. 国际药学研究杂志, 2018, 45(4): 253-257.
TIAN X,DING J S,FAN Y Z,et al. Novel preparation techniques used in new dosage form of dipyridamole: research advances[J]. Journal of International Pharmaceutical Research, 2018: 45(4): 253-257.
[5]SKRDLA P J, FLOYD P D, DELLORCO P C. Predicting the solubility advantage of amorphous drugs: effect of pH[J]. Journal of Pharmaceutical Sciences, 2020, 109(4): 1627-1629.
[6]PAJIZDERSKA A, JENCZYK J, EMBS J P, et al. Exploring molecular reorientations in amorphous and recrystallized felodipine at the microscopic level[J]. RSC Advances, 2020, 10(61): 37346-37357.
[7]MIZOGUCHI R, WARAYA H, HIRAKURA Y. Application of co-amorphous technology for improving the physicochemical properties of amorphous formulations[J]. Molecular pharmaceutics, 2019, 16(5): 2142-2152.
[8]DEDROOG S, PAS T, VERGAUWEN B, et al. Solid-state analysis of amorphous solid dispersions: Why DSC and XRPD may not be regarded as stand-alone techniques[J]. Journal of Pharmaceutical and Biomedical Analysis, 2020, 178: 112937.
[9]ZHAO M, BARKER S A, BELTON P S, et al. Development of fully amorphous dispersions of a low Tg drug via co-spray drying with hydrophilic polymers[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2012, 82(3): 572-579.
[10]KISSINGER H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11): 1702-1706.
[11]AUGIS J A, BENNETT J E. Calculation of the Avrami parameters for heterogeneous solid-state reactions using a modification of the Kissinger method[J]. Journal Thermal Analysis and Calorimetry, 1978,13(2):283-292.
[12]OZAWA T. Kinetic analysis of derivative curves in thermal analysis[J]. Journal of Thermal Analysis, 1970, 2(3): 301-324.
[13]MALEK J. The applicability of johnson-mehl-avrami model in the thermal analysis of the crystallization kinetics of glasses[J]. Thermochimica Acta, 1995, 267: 61-73.
[14]GAN L, ZHANG C X, ZHOU J C, et al. Continuous cooling crystallization kinetics of a molten blast furnace slag[J]. Journal of Non-Crystalline Solids, 2012, 358(1): 20-24.
[15]TORRES-GARCIA E, BRACHI P. Non-isothermal pyrolysis of grape marc[J]. Journal of Thermal Analysis and Calorimetry, 2020, 139(2): 1463-1478.
[16]WU C J, YOU J Z, WANG X J. Thermal decomposition mechanism of piroxicam[J]. Journal of Thermal Analysis and Calorimetry, 2018, 134(3): 2041-2048.
[17]OZAWA T. A new method of analyzing thermogravimetric data[J]. Bulletin of the Chemical Society of Japan, 1965, 38(11): 1881-1886.
[18]KISSINGER H E. Variation of peak temperature with heating rate in differential thermal analysis[J]. Journal of Research of the National Bureau of Standards, 1956, 57(4): 217-221.
[19]ELSHAFIE M, YOUNIS S A, SERP P, et al. Preparation characterization and non-isothermal decomposition kinetics of different carbon nitride sheets[J]. Egyptian Journal of Petroleum, 2020, 29(1): 21-29.
[20]陈栋华, 唐万军,李丽清,等. 药物贮存期的热分析动力学[J]. 中南民族大学学报: 自然科学版, 2002, 21(4): 1-4,9.
CHENG D H, TANG W J, LI L Q, et al. Thermal analysis study for prediction of drugs shelf-time[J]. Journal of South-Central Minzu University (Natural Sciences Edition), 2002, 21(4): 1-4,9.
(责任编辑:编辑唐慧)
收稿日期:中文收稿日期2022-02-28
基金项目:河北省自然科学基金项目(H20206218)
作者简介:孙嘉汝(1998—),女,硕士研究生,专業方向为药物制剂。
*通信作者:杨彩琴(1967—),女,教授,从事超分子药物体系方面的研究,e-mail: yang_caiqin@163.com。
