基于小胶质细胞活化探讨丁苯酞对一氧化碳中毒迟发性脑病的作用机制
2024-01-01石雨王宝军陈超庞江霞李洋张军许毛毛


摘要:目的 探究丁苯酞(NBP)对一氧化碳中毒迟发性脑病(DEACMP)小鼠海马组织内小胶质细胞活化及炎症因子表达的作用机制。方法 筛选认知功能正常的C57成年野生型小鼠,采用静态吸入一氧化碳法制备DEACMP小鼠模型,并随机分为3组:DEACMP组、对照组及NBP组,其中,NBP组灌胃NBP混悬液6 mg/kg连续21 d,DEACMP组和对照组灌胃等量植物油。采用HE染色观察小鼠海马组织损伤情况,Western blot法测定离子钙结合衔接分子1(IBA1)蛋白表达水平,ELISA法检测下游炎症因子表达水平。结果 与对照组比较,DEACMP组和NBP组逃避潜伏期显著延长(P=0.00 P=0.029),神经细胞数量明显减少(P=0.00 P=0.035),IBA1表达显著增加(P=0.00 P=0.042),IBA1平均荧光强度显著增强(P=0.00 P=0.021),肿瘤坏死因子-α(TNF-α)(P=0.00 P=0.024)、白细胞介素(IL)-6(P=0.00 P=0.015)、IL-1β(P=0.00 P=0.023)表达水平显著增高。与DEACMP组比较,NBP组逃避潜伏期缩短(P=0.025),神经细胞数量增多(P=0.039),IBA1表达降低(P=0.035),IBA1平均荧光强度减弱(P=0.031),TNF-α(P=0.028)、IL-6(P=0.037)、IL-1β(P=0.034)表达水平降低。结论 NBP可通过抑制小胶质细胞活化减少炎症因子的表达,进而减轻DEACMP导致的认知功能障碍及脑组织损伤。
关键词:一氧化碳中毒;迟发性脑病;小胶质细胞;炎症因子;丁苯酞
中图分类号: R595.1;R747.9" 文献标识码: A" 文章编号:1000-503X(2024)05-0659-07
DOI:10.3881/j.issn.1000-503X.16017
Mechanism of Butylphthalide in Treating Delayed Encephalopathy After Carbon Monoxide Poisoning Based on Activation of Microglia
SHI Yu WANG Baojun CHEN Chao PANG Jiangxia LI Yang ZHANG Jun XU Maomao2
1Central Clinical Medical College of Baotou Medical College,Inner Mongolia University of Science and Technology,Baotou,Nei Mongol 014040,China
2Department of Neurology,Baotou Central Hospital,Baotou,Nei Mongol 014040,China
Corresponding author:CHEN Chao Tel:15849200184,E-mail:282262797@qq.com
ABSTRACT:Objective To explore the mechanism of butylphthalide (NBP) in regulating microglia activation and inflammatory cytokine expression in the hippocampus of the mouse model of delayed encephalopathy after carbon monoxide poisoning (DEACMP).Methods Wild-type C57 adult mice with normal cognitive function were selected,and DEACMP was modeled by static inhalation of carbon monoxide.The mice were randomized into three groups:DEACMP,control,and NBP.The NBP group was administrated with NBP suspension at 6 mg/kg by gavage for 21 days,and the DEACMP and control groups were administrated with the same amount of vegetable oil by gavage.The hippocampal injury was observed by HE staining.The protein level of ionized calcium-binding adapter molecule 1 (IBA1) was determined by Western blotting,and the levels of downstream inflammatory cytokines were measured by ELISA.Results Compared with the control group,the DEACMP and NBP groups showed prolonged escape latency (P=0.00 P=0.029),reduced nerve cells (P=0.00 P=0.035),up-regulated expression of IBA1 (P=0.00 P=0.042),increased mean fluorescence intensity of IBA1 (P=0.00 P=0.021),and elevated levels of tumor necrosis factor-α (TNF-α) (P=0.00 P=0.024),interleukin (IL)-6 (P=0.00 P=0.015),and IL-1β (P=0.00 P=0.023).Compared with the DEACMP group,the NBP group showed shortened escape latency (P=0.025),increased nerve cells (P=0.039),down-regulated expression of IBA1 (P=0.035),decreased average fluorescence intensity of IBA1 (P=0.031),and lowered levels of TNF-α (P=0.028),IL-6 (P=0.037),and IL-1β (P=0.034).Conclusion NBP can inhibit the activation of microglia and reduce the expression of inflammatory factors,thereby alleviating cognitive dysfunction and brain tissue damage caused by DEACMP.
Key words:carbon monoxide poisoning;delayed encephalopathy;microglia;inflammatory cytokines;butylphthalide
Acta Acad Med Sin,2024,46(5):659-665
一氧化碳(carbon monoxide,CO)中毒是导致中毒性死亡的常见原因之一,约半数CO中毒幸存者会遗留神经系统后遗症,其中,最常见且严重的是一氧化碳中毒迟发性脑病(delayed encephalopathy after carbon monoxide poisoning,DEACMP),其病程迁延难愈且预后差,严重影响患者的生活质量[1]。DEACMP的发病机制不清,目前的治疗方法单一且疗效不佳,因此,探究DEACMP发病机制并寻找有效的治疗靶点显得尤为重要。近年研究发现免疫损伤在DEACMP中发挥着重要作用[2-3]。小胶质细胞(microglial,MG)是负责维持中枢神经系统正常生理功能及对损伤产生局部反应的免疫细胞[4]。MG激活后产生的炎症介质促进了阿尔茨海默病、缺血性脑卒中等神经退行性疾病的进展[5-6]。以MG为靶点抑制神经炎症,进而改善甚至逆转神经系统疾病的病理损伤过程已成为当前的研究热点[7]。丁苯酞(butylphthalide,NBP)是我国自主研发的一种新型脑保护药物,能够重建微循环,保护线粒体,通过下调炎症因子来治疗认知障碍等神经系统疾病[8-10]。但关于NBP能否通过介导炎症因子改善DEACMP认知障碍及其具体机制尚不明确。本研究探究NBP对DEACMP小鼠海马组织内MG活化及炎症因子表达的作用机制,为临床诊疗提供新思路。
1 材料和方法
1.1 实验动物
6~8周龄健康清洁级C57BL/6小鼠120只,购自斯贝福(北京)生物技术有限公司,动物生产许可证[SCXK(京)2019-0010],饲养于包头医学院动物实验中心,温度18~23 ℃,12 h明暗交替,标准小鼠饲料喂养,自由采食和饮水。本研究通过内蒙古医科大学伦理委员会批准(伦理审批编号:YKD202301009)。
1.2 主要试剂
NBP胶囊购自石药集团恩必普药业有限公司,离子钙结合衔接分子1(ionized calcium-binding adaptor molecule "IBA1)单克隆抗体购自美国Abcam公司,小鼠白细胞介素(interleukin,IL)-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒均购自江苏酶免实业有限公司。
1.3 DEACMP动物模型制备及分组
筛选认知功能正常的小鼠,采用静态吸入CO法制备DEACMP小鼠模型[11]。将实验动物置于CO中毒箱中,持续吸入CO 1000 ppm 40 min,3000 ppm 20 min制备DEACMP小鼠模型,对照组小鼠暴露在空气中1 h。采用随机数字表法将120只小鼠随机分为3组,每组40只。NBP组灌胃NBP混悬液(NBP和植物油的混合溶液)6 mg/kg[12],DEACMP组和对照组灌胃等量植物油,各组均每天灌胃1次,连续21 d。
1.4 Morris水迷宫实验
采用Morris水迷宫实验检测小鼠的空间学习及记忆能力。在直径120 cm、高50 cm的圆形容器中装满含有食品级二氧化钛的水,水温(22.0±0.5)℃。将水池分为4个象限,在目标象限中央水面下1 cm处放置1个实验平台。小鼠先适应水迷宫环境1 d,再进行5 d正式实验,取4次训练潜伏期的平均值作为其最终学习成绩,记录各组小鼠平均逃避潜伏期。
1.5 HE染色
经常规麻醉灌注处理后,将脑组织置于4%多聚甲醛溶液中进行固定,采用石蜡包埋法制备脑组织切片(8 μm),浸泡于二甲苯中脱蜡、酒精梯度清洗、水化、苏木精染色、分化、伊红浸染,常规脱水后透明、封片,置于光学显微镜下观察各组小鼠脑细胞形态结构。
1.6 Western blot检测
提取脑组织总蛋白,BCA法检测蛋白浓度,将蛋白样品进行凝胶电泳,转膜后用5%脱脂牛奶封闭1 h,分别加入IBA1(1∶1000)、β-actin抗体(1∶5000)4 ℃孵育过夜,PBS清洗3次,加入二抗(1∶1000),室温孵育1.5 h,ECL显影,采用Image-proplus 6.0软件分析条带。
1.7 免疫荧光染色
将小鼠海马组织制成30μm切片,0.5% Triton X-100室温通透20 min,PBS冲洗,10%羊血清室温封闭1 h,加入IBA1一抗4 ℃摇床过夜,再加入二抗室温孵育1 h,清洗后常规封片观察。
1.8 ELISA实验
采用ELISA检测小鼠海马组织中TNF-α、IL-6、IL-1β的表达,具体操作按照试剂盒说明书进行。
1.9 统计学处理
采用SPSS 26.0软件,符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,进一步两组间比较采用LSD检验。Plt;0.05为差异有统计学意义。
2 结果
2.1 Morris水迷宫实验结果
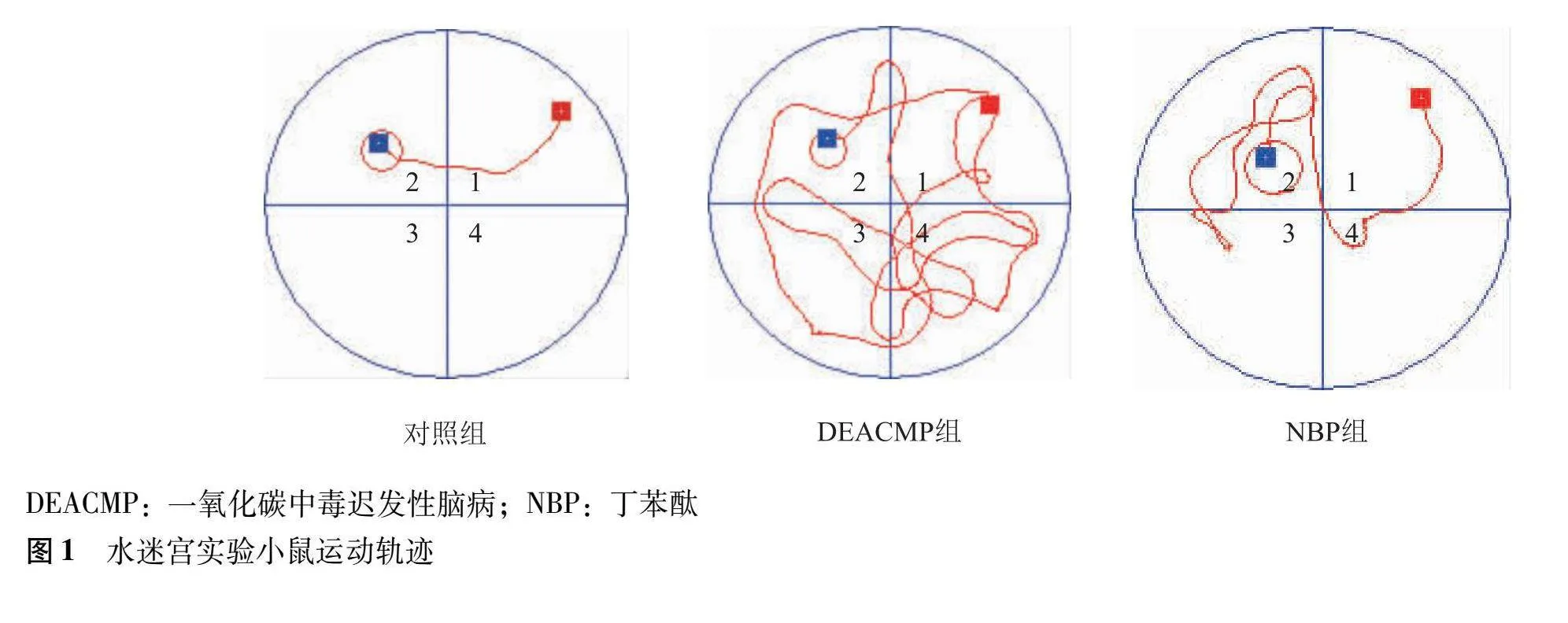
造模21 d后,对照组、DEACMP组及NBP组水迷宫实验逃避潜伏期差异有统计学意义(F=12.260,P<0.001),DEACMP组和NBP组较对照组逃避潜伏期显著延长(P=0.00 P=0.029),NBP组较DEACMP组逃避潜伏期缩短(P=0.025)。对照组运动轨迹呈趋向式,DEACMP组运动轨迹无明显趋势,NBP组运动轨迹较对照组混乱,但轻于DEACMP组(图1)。
2.2 组织病理学变化
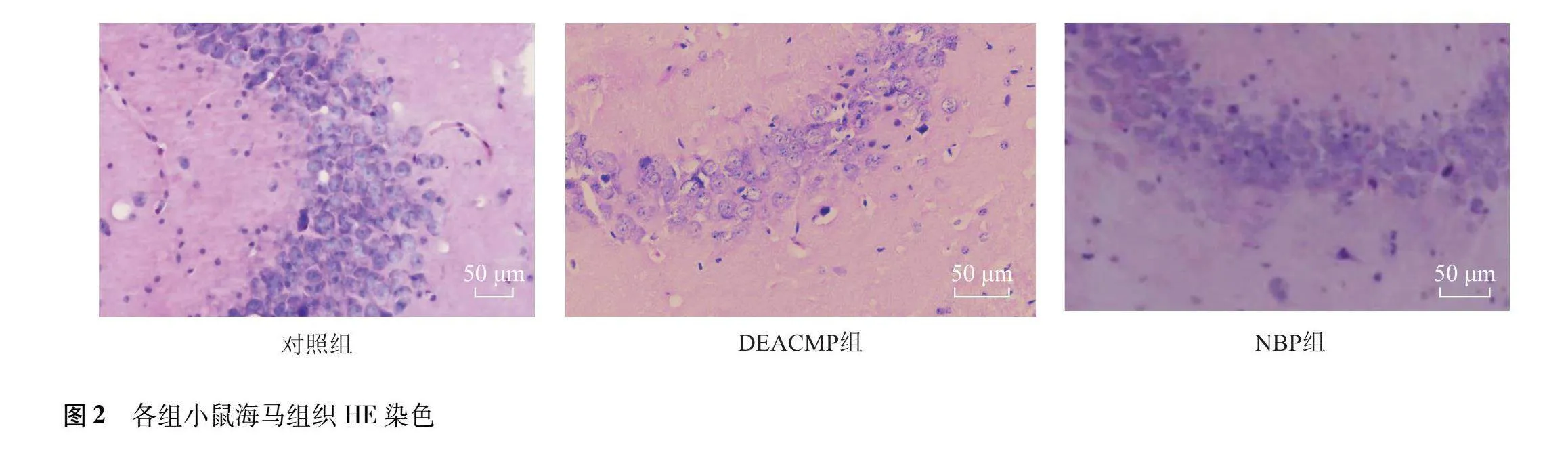
对照组小鼠海马组织神经细胞形状规整,呈圆形或椭圆形,排列紧密有序,细胞结构完整,核膜核仁完好。与对照组比较,DEACMP组神经细胞肿胀,呈三角形或多边形,细胞数量与层数减少,排列混乱,部分细胞出现核固缩、核溶解,甚至坏死。NBP组神经细胞损伤程度较DEACMP组减轻,未见坏死细胞,细胞数量与层数较对照组减少(图2)。3组小鼠海马组织神经细胞计数差异有统计学意义(F=9.804,P=0.001)。与对照组比较,DEACMP组和NBP组小鼠海马组织神经细胞数量明显减少(P=0.00 P=0.035),但NBP组小鼠海马组织神经细胞数量较DEACMP组增多(P=0.039)。
2.3 各组小鼠海马组织中IBA1的表达水平比较
3组小鼠海马组织中IBA1表达水平差异有统计学意义(F=10.280,Plt;0.001)。与对照组比较,DEACMP组和NBP组海马组织中IBA1表达显著增加(P=0.00 P=0.042),且NBP组IBA1表达较DEACMP组降低(P=0.035)(图3)。
2.4 各组小鼠海马组织中IBA1的活化水平比较
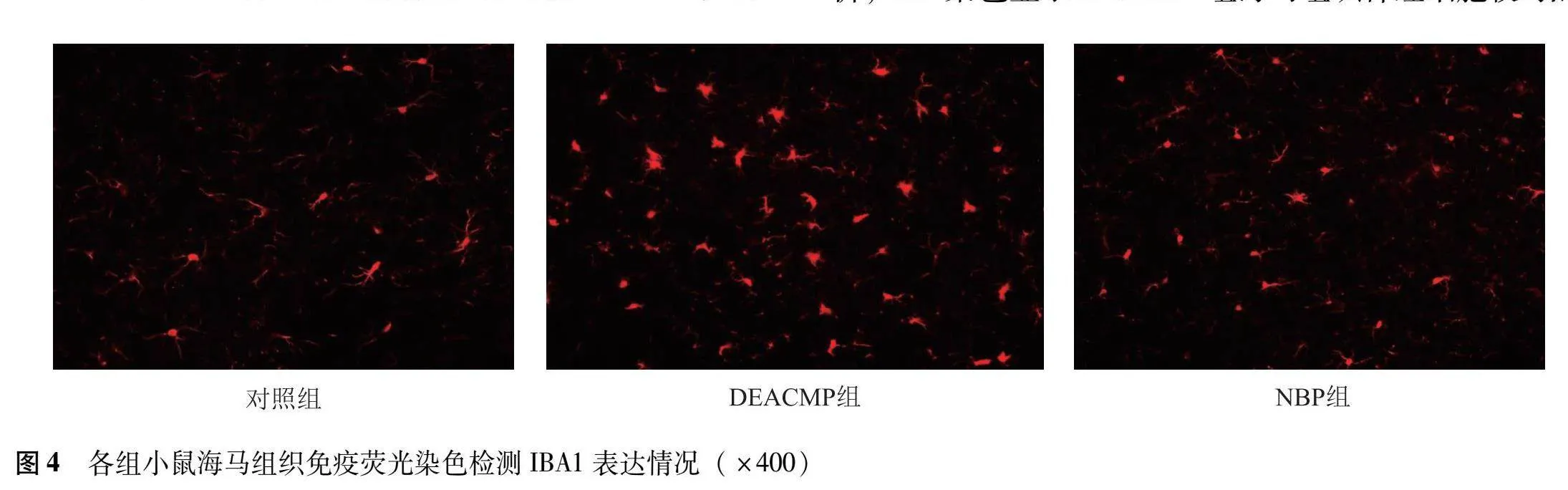
对照组小鼠海马组织中MG呈静息态,细胞胞体较细长,分枝多;DEACMP组小鼠海马组织中MG处于活化状态,细胞胞体增大,分枝减少,突起增粗;NBP组小鼠海马组织可见部分MG处于活化状态,活化数量较DEACMP组减少,但较对照组增多。3组小鼠海马组织中IBA1平均荧光强度差异有统计学意义(F=10.150,P<0.001),与对照组比较,DEACMP组和NBP组IBA1平均荧光强度显著增强(P=0.00 P=0.021),但NBP组IBA1平均荧光强度较DEACMP组减弱(P=0.031)(图4)。
2.5 各组小鼠海马组织中TNF-α、IL-6、IL-1β的表达水平比较
3组小鼠海马组织中TNF-α(F=11.200,Plt;0.001)、IL-6(F=12.760,P<0.001)、IL-1β(F=11.860,P<0.001)表达水平差异有统计学意义。与对照组比较,DEACMP组和NBP组海马组织中TNF-α(P=0.00 P=0.024)、IL-6(P=0.00 P=0.015)、IL-1β(P=0.00 P=0.023)表达水平显著增高,且NBP组TNF-α(P=0.028)、IL-6(P=0.037)、IL-1β(P=0.034)的表达水平较DEACMP组降低(图5)。
3 讨论
多数CO中毒患者经假愈期后会出现DEACMP,包括认知及精神异常、锥体外系及锥体系症状、大脑皮质局灶性功能障碍等,其中以认知障碍为最典型的临床表现[13]。DEACMP治疗以高压氧疗法为主,但研究表明高压氧治疗对于严重CO中毒患者效果不佳,且会导致气压创伤、肺水肿、癫痫和自由基生成等并发症[14]。若能找到有效药物早期干预,将有助于提高患者生存质量,减轻社会负担。目前DEACMP的发病机制有缺血缺氧学说、免疫损伤学说及自由基损伤等。大量研究表明脑组织损伤可分为早期损伤和二次损伤,损伤后脑内MG在数量和形态上发生一系列变化。DEACMP假愈期的发病特点和病程早期的病理损伤与脑损伤及二次损伤相似[ 15-16],并且本团队前期研究证实免疫损伤在DEACMP中发挥重要作用[17-18]。具有抗炎活性的神经保护药物在治疗免疫损伤相关疾病方面的效果显著[19],有可能改善DEACMP的临床症状。
海马体位于大脑颞叶内侧,在空间导航、情景记忆及认知功能中起关键作用[20]。越来越多的证据表明成人海马损伤及神经调节异常可能与阿尔茨海默病、多发性硬化、帕金森病及癫痫等神经系统疾病的认知能力下降和精神疾病的心理症状有关[21]。CO中毒后海马对缺血缺氧高度敏感,MRI可见脑白质高信号和海马萎缩;在DEACMP模型中也发现海马区神经元坏死凋亡[22-24]。因此,本研究对小鼠海马组织样本进行分析,HE染色显示DEACMP组海马组织神经细胞较对照组明显肿胀、数量减少、细胞层数减少、排列紊乱疏松,部分细胞出现核固缩、核溶解,并可见呈三角形或多边形的坏死细胞。Morris水迷宫实验结果显示,在造模21 d后,DEACMP组小鼠较对照组逃避潜伏期显著延长,运动轨迹明显混乱,表明DEACMP组小鼠出现认知障碍和记忆力减退;采用NBP干预后,小鼠逃避潜伏期较DEACMP组缩短,运动轨迹也趋向规整,表明NBP对治疗DEACMP引起的认知障碍具有一定效果,但与对照组仍存在差异,提示还可能存在其他机制介导DEACMP相关认知功能障碍。本研究成功构建DEACMP小鼠模型,从病理及行为认知方面证明了DEACMP会使小鼠海马组织内的神经细胞减少甚至坏死,出现以认知障碍为主的一系列临床表现。
MG是炎症因子的主要来源,参与多种神经系统疾病的炎性损伤过程。它在静息状态下为M0型,过度激活转变为M1型(经典激活)[25]。既往研究表明MG能通过Toll样受体和核苷酸结合寡聚结构域样受体识别受损细胞,释放损伤相关分子模式,产生IL-1β、IL-6、TNF-α等促炎因子,同时这些细胞因子又进一步活化MG,使MG由M0型向M1型极化,产生大量促炎因子,造成持续或放大的炎症反应,加重中枢神经系统损伤[26-27]。这些促炎因子导致的脑损伤被认为是阿尔茨海默病及DEACMP等神经退行性疾病发生认知障碍的关键因素[28]。本研究免疫荧光染色发现对照组小鼠海马组织中MG呈静息态,细胞胞体较细长,分枝多;与对照组比较,DEACMP组小鼠海马组织中MG活化增强,细胞胞体增大,分枝减少,突起增粗,并且IBA1平均荧光强度显著增强;Western blot也显示DEACMP组小鼠海马组织内IBA1表达较对照组显著增加。可见MG参与DEACMP的脑损伤机制:CO中毒引起免疫反应,使MG活化增强,IBA1表达增加,释放大量炎症因子导致神经细胞坏死,这与Thom等[2]研究结论一致。此外,本研究ELISA检测结果显示DEACMP组炎症因子表达量较对照组增高,提示在DEACMP发病过程中,MG受到刺激极化为M1型,发挥促炎作用产生大量炎症因子,造成神经细胞坏死引起脑损伤。
NBP已被推荐用于急性缺血性卒中的治疗,它是一种小分子多靶点药物,具有神经保护、改善认知障碍、抗凋亡、抗氧化应激和抗炎等作用,在神经退行性疾病、脑水肿、自身免疫性疾病及血管性痴呆等神经系统疾病的治疗中表现出巨大潜力[29-30]。临床研究表明NBP不会增加药物性肝损伤和肝肾功能衰竭的发生风险,对体内血糖和血脂水平的影响小,药物不良反应少[31]。药理研究表明NBP可促进脑血管新生、加速神经行为功能恢复从而治疗缺血性脑卒中[32];以MG为靶细胞可以减轻肌萎缩侧索硬化症的神经炎症反应[33]。基础研究表明NBP能显著下调脑内炎症因子水平,减轻免疫性脑损伤,改善认知障碍[34]。但NBP对DEACMP的保护作用及其机制还不清楚。Chen等[35]研究表明NBP能通过减轻MG活化改善小鼠的认知障碍。Han等[36]研究发现NBP可通过减少促炎细胞因子来减轻慢性灌注不全导致的认知障碍。本研究结果显示,与DEACMP组比较,NBP组小鼠海马组织神经细胞未出现坏死,细胞数量及层数较多,较致密;MG活化减弱,IBA1表达降低,IBA1平均荧光强度减弱,TNF-α、IL-6、IL-1β表达水平降低。这提示NBP可能通过抑制MG活化减少炎症因子的产生进而减轻DEACMP的免疫损伤,并在一定程度上改善认知功能。
综上,本研究结果表明,NBP可以改善DEACMP小鼠的认知障碍,其可通过抑制MG活化,减少炎症因子表达,进而减轻脑组织损伤。研究成果为探索新的DEACMP治疗策略提供重要的参考依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 石雨:撰写论文、统计数据、参与实验;王宝军:设计实验、指导研究、提供基金支持;陈超、庞江霞:指导研究、参与实验;李洋:参与实验;张军:指导研究、参与实验;许毛毛:参与实验
参 考 文 献
[1]Tseng WT,Yeh JY,Lane HY,et al.Effects of donepezil on cognition and global functioning in patients with delayed encephalopathy after carbon monoxide poisoning:a case series[J].Psychiatry Clin Neurosci,2019,73(6):348.DOI:10.1111/pcn.12841.
[2]Thom SR,Bhopale VM,Fisher D,et al.Delayed neuropathology after carbon monoxide poisoning is immune-mediated[J].Proc Natl Acad Sci U S A,2004,101(37):13660-13665.DOI:10.1073/pnas.0405642101.
[3]Eichhorn L,Thudium M,Jüttner B.The diagnosis and treatment of carbon monoxide poisoning[J].Dtsch Arztebl Int,2018,115(51-52):863-870.DOI:10.3238/arztebl.2018.0863.
[4]Plemel JR,Stratton JA,Michaels NJ,et al.Microglia response following acute demyelination is heterogeneous and limits infiltrating macrophage dispersion[J].Sci Adv,2020,6(3):eaay6324.DOI:10.1126/sciadv.aay6324.
[5]Thakkar R,Wang R,Wang J,et al.17β-estradiol regulates microglia activation and polarization in the hippocampus following global cerebral ischemia[J].Oxid Med Cell Longev,2018,2018:4248526.DOI:10.1155/2018/4248526.
[6]Kwon HS,Koh SH.Neuroinflammation in neurodegenerative disorders:the roles of microglia and astrocytes[J].Transl Neurodegener,2020,9(1):42.DOI:10.1186/s40035-020-00221-2.
[7]Gao C,Jiang J,Tan Y,et al.Microglia in neurodegenerative diseases:mechanism and potential therapeutic targets[J].Signal Transduct Target Ther,202 8(1):359.DOI:10.1038/s41392-023-01588-0.
[8]Chamorro ,Dirnagl U,Urra X,et al.Neuroprotection in acute stroke:targeting excitotoxicity,oxidative and nitrosative stress,and inflammation[J].Lancet Neurol,2016,15(8):869-881.DOI:10.1016/S1474-4422(16)00114-9.
[9]Chen XQ,Qiu K,Liu H,et al.Application and prospects of butylphthalide for the treatment of neurologic diseases[J].Chin Med J,2019,132(12):1467-1477.DOI:10.1097/CM9.0000000000000289.
[10]Zheng B,Zhou Y,Zhang H,et al.Dl-3-n-butylphthalide prevents the disruption of blood-spinal cord barrier via inhibiting endoplasmic reticulum stress following spinal cord injury[J].Int J Biol Sci,2017,13(12):1520-1531.DOI:10.7150/ijbs.21107.
[11]Ochi S,Abe M,Li C,et al.The nicotinic cholinergic system is affected in rats with delayed carbon monoxide encephalopathy[J].Neurosci Lett,2014,569:33-37.DOI:10.1016/j.neulet.2014.03.054.
[12]Diao X,Pang X,Xie C,et al.Bioactivation of 3-n-butylphthalide via sulfation of its major metabolite 3-hydroxy-NBP:mediated mainly by sulfotransferase 1A1[J].Drug Metab Dispos,2014,42(4):774-781.DOI:10.1124/dmd.113.056218.
[13]朱红灿,岳培建.CO中毒迟发性脑病诊断与治疗中国专家共识[J].中国神经免疫学和神经病学杂志,202 8(3):173-179.DOI:10.3969/j.issn.1006-2963.2021.03.001.
[14]Simonsen C,Magnusdottir SO,Andreasen JJ,et al.Metabolic changes during carbon monoxide poisoning:an experimental study[J].J Cell Mol Med,202 5(11):5191-5201.DOI:10.1111/jcmm.16522.
[15]Thom SR,Bhopale VM,Han ST,et al.Intravascular neutrophil activation due to carbon monoxide poisoning[J].Am J Respir Crit Care Med,2006,174(11):1239-1248.DOI:10.1164/rccm.200604-557OC.
[16]石雨,王宝军,陈超.一氧化碳中毒迟发性脑病机制的研究进展[J].中国医药,202 18(6):940-944.DOI:10.3760/j.issn.1673-4777.2023.06.032.
[17]陈超,王宝军,项文平,等.大鼠海马组织小胶质细胞活化水平与急性一氧化碳中毒迟发型脑病的相关性研究[J].脑与神经疾病杂志,2018,26(8):472-475.
[18]Xiang W,Yang Z,Xue H,et al.P2Y12 receptor-mediated microglia activation involved in delayed encephalopathy after acute carbon monoxide poisoning[J].Aging,202 13(4):6134-6143.DOI:10.18632/aging.202607.
[19]Mallah K,Couch C,Borucki DM,et al.Anti-inflammatory and neuroprotective agents in clinical trials for CNS disease and injury:where do we go from here[J].Front Immunol,2020,11:2021.DOI:10.3389/fimmu.2020.02021.
[20]Toda T,Parylak SL,Linker SB,et al.The role of adult hippocampal neurogenesis in brain health and disease[J].Mol Psychiatry,2019,24(1):67-87.DOI:10.1038/s41380-018-0036-2.
[21]Jeon SB,Sohn CH,Seo DW,et al.Acute brain lesions on magnetic resonance imaging and delayed neurological sequelae in carbon monoxide poisoning[J].JAMA Neurol,2018,75(4):436-443.DOI:10.1001/jamaneurol.2017.4618.
[22]Guan L,Wen T,Zhang Y,et al.Induction of heme oxygenase-1 with hemin attenuates hippocampal injury in rats after acute carbon monoxide poisoning[J].Toxicology,2009,262(2):146-152.DOI:10.1016/j.tox.2009.06.001.
[23]Mousavi SR,Mohammadpour AH,Moshiri M,et al.A pilot study of neuroprotective effect of granulocyte colony-stimulating factor (G-CSF) in patients with carbon monoxide poisoning:a double-blind,randomized,placebo-controlled trial[J].Naunyn Schmiedebergs Arch Pharmacol,202 396(6):1257-1267.DOI:10.1007/s00210-023-02395-8.
[24]Wang A,Jia B,Zhang X,et al.Efficacy and safety of butylphthalide in patients with acute ischemic stroke:a randomized clinical trial[J].JAMA Neurol,202 80(8):851-859.DOI:10.1001/jamaneurol.2023.1871.
[25]Xu M,Wang J,Zhang X,et al.Polysaccharide from schisandra chinensis acts via LRP-1 to reverse microglia activation through suppression of the NF-κB and MAPK signaling[J].J Ethnopharmacol,2020,256:112798.DOI:10.1016/j.jep.2020.112798.
[26]Ma Y,Yang S,He Q,et al.The role of immune cells in post-stroke angiogenesis and neuronal remodeling:the known and the unknown[J].Front Immunol,202 12:784098.DOI:10.3389/fimmu.2021.784098.
[27]Lin H,Cao X.Nuclear innate sensors for nucleic acids in immunity and inflammation[J].Immunol Rev,2020,297(1):162-173.DOI:10.1111/imr.12893.
[28]Liu Y,Zhang Y,Zheng X,et al.Galantamine improves cognition,hippocampal inflammation,and synaptic plasticity impairments induced by lipopolysaccharide in mice[J].J Neuroinflammation,2018,15(1):112.DOI:10.1186/s12974-018-1141-5.
[29]Song K,Zeng X,Xie X,et al.Dl-3-n-butylphthalide attenuates brain injury caused by cortical infarction accompanied by cranial venous drainage disturbance[J].Stroke Vasc Neurol,202 7(3):222-236.DOI:10.1136/svn-2021-001308.
[30]Zhang J,Guo Y,Li W,et al.The efficacy of n-butylphthalide and dexamethasone combined with hyperbaric oxygen on delayed encephalopathy after acute carbon monoxide poisoning[J].Drug Des Devel Ther,2020,14:1333-1339.DOI:10.2147/DDDT.S217010.
[31]Xiang W,Xue H,Wang B,et al.Efficacy of n-butylphthalide and hyperbaric oxygen therapy on cognitive dysfunction in patients with delayed encephalopathy after acute carbon monoxide poisoning[J].Med Sci Monit,2017,23:1501-1506.DOI:10.12659/msm.899499.
[32]Liao SJ,Lin JW,Pei Z,et al.Enhanced angiogenesis with dl-3n-butylphthalide treatment after focal cerebral ischemia in RHRSP[J].Brain Res,2009,1289:69-78.DOI:10.1016/j.brainres.2009.06.018.
[33]Calafatti M,Cocozza G,Limatola C,et al.Microglial crosstalk with astrocytes and immune cells in amyotrophic lateral sclerosis[J].Front Immunol,202 14:1223096.DOI:10.3389/fimmu.2023.1223096.
[34]Yang CS,Guo A,Li Y,et al.Dl-3-n-butylphthalide reduces neurovascular inflammation and ischemic brain injury in mice[J].Aging Dis,2019,10(5):964-976.DOI:10.14336/AD.2019.0608.
[35]Chen X,He JL,Liu XT,et al.Dl-3-n-butylphthalide mitigates stress-induced cognitive deficits in mice through inhibition of NLRP3-Mediated neuroinflammation[J].Neurobiol Stress,202 20:100486.DOI:10.1016/j.ynstr.2022.100486.
[36]Han QY,Zhang H,Zhang X,et al.Dl-3-n-butylphthalide preserves white matter integrity and alleviates cognitive impairment in mice with chronic cerebral hypoperfusion[J].CNS Neurosci Ther,2019,25(9):1042-1053.DOI:10.1111/cns.13189.
(收稿日期:2024-01-24)
