小鼠原代气道上皮基底细胞分离、增殖与气液界面培养诱导的定向分化
2023-12-28王彩妹,周希,杨露等
健康的气道上皮能够促进气道中的空气运输、屏障功能、粘液纤毛清除和肺免疫反应的调节,是机体呼吸道防御系统的重要屏障,主要由基底细胞、纤毛细胞、刷细胞、杯状细胞、神经内分泌细胞等细胞组成[1-2]。疾病发生时,各细胞功能状态常发生改变。构建与体内自然生长状态相近的体外气道上皮模型,可更好的研究气道慢性疾病机制或外源性毒理评价。目前,气-液界面(air-liquid interface, ALI)培养技术是培养气道上皮的重要方法,ALI培养可形成典型的假复层纤毛柱状上皮结构,分化为纤毛细胞、杯状细胞和基底细胞[3-4]。虽然ALI培养在国外已有多年研究的历史,但目前国内也只有少数实验室成功建立了该培养体系[5-7],仍存在技术不够成熟,实验结果不一致的问题。而且各实验室采用的方法都不同,包括原代细胞的分离培养、ALI培养基添加成分、预铺胶原类型的选择、细胞的接种密度等都各不相同[8-9]。ALI培养大多选用原代气道上皮细胞,如冀晓丽等[10]用分离的原代细胞成功构建了ALI培养小鼠气道上皮细胞模型,但每次ALI培养,需要大量的实验动物(10~30只小鼠)才可分离足够的原代细胞,存在一定的动物伦理问题。另外,原代细胞数量少,构建的气道上皮模型不足以用于后续各种对比实验的开展。气道上皮的基底细胞具有自我更新和分化潜能,可分化为主要分泌型和多纤毛细胞类型[11]。因此,本实验进行了原代基底细胞的分离、鉴定,细胞传代及ALI培养等实验,从而研究基底细胞的增殖和定向分化,通过细胞扩增构建更多的体外气道上皮模型,为研究各种慢性气道疾病机制和吸入性物质暴露的毒性评价提供了体外实验模型。
1 材料与方法
1.1 实验动物 SPF级10~12周成年KM小鼠,由遵义医科大学实验动物中心提供,生产许可证号为SCXK(黔)2021-0002:使用许可证(黔)2021-0004。通过遵义医科大学动物伦理委员会的审查(NO:ZMU21-2309-009)。
1.2 主要试剂及仪器 Ⅰ型胶原蛋白(CORNING,354236);PneumaCultTM-Ex Plus基础培养基、PneumaCultTM-Ex Plus 50×增补剂(STEMCELL Techsupport,#05040);PneumaCultTM-ALI基础培养基、PneumaCultTM-ALI 10×增补剂、PneumaCultTM-ALI 维持补充剂(STEMCELL Techsupport, #05001);氢化可的松(STEMCELL Techsupport,#74142);肝素(STEMCELL Techsupport, #07980);中性蛋白酶(上海懋康生物科技有限公司,MX1006-100MG);0.25%胰酶-EDTA(上海源培生物科技股份有限公司,S310JV);青霉素-链霉素(Solarbio, P1400);DMEM培养基(gibco,C11995500BT);胎牛血清(SORFA,SH5021);6.5mm Transwell小室(Jet·Biofil, TCS016024);KRT5(proteintech, 28506-1-AP);DAPI(Solarbio,C0065);Triton X-100(BioFroxx,1139ML100);山羊血清(Solarbio,S9070);山羊抗兔荧光二抗(ABclonal, AS05);甲醇(成都金山化学试剂有限公司,20200204);乙酸(重庆川东化工有限公司);4% 多聚甲醛(biosharp, BL539A);多聚赖氨酸(Solarbio,P210);蔗糖(成都金山化学试剂有限公司,20220624);细胞筛(biosharp,BS-40-CS)。倒置显微镜(OLYMPUS,CKX53);冰冻切片机(Leica,CM1900-1-1);倒置荧光显微镜(OLYMPUS,IX73);场发射扫描电镜(HITACHI,SU8010);研究级正置显微镜(OLYMPUS,BX43)。
1.3 试剂的配置 增殖培养基:在484.5 mL PneumaCultTM-Ex Plus基础培养基中加入 10 mL PneumaCutTM-Ex Pus 50×Supplement、0.5 mL 0.2 mM氢化可的松、5 mL 青霉素/链霉素(P/S),保存于4 ℃ 冰箱。分化培养基:50 mL PneumaCultTM-ALI 10×Supplcment+450 mL Pn-eumaCultTM-ALI基础培养配成PneumaCultTM-ALI 完全基础培养基。在486.5 mL的PneumaCultTM-ALI 完全基础培养基中加入5 mL的PneumaCultTM-ALI维持增补剂、1 mL肝素、2.5 mL氢化可的松、5 mL青霉素/链霉素,混合配成PneumaCultTM-ALI 分化培养基。
1.4 小鼠原代基底细胞的分离培养 颈椎脱臼法处死小鼠,酒精消毒后,从胸骨到下颌剪开皮毛,打开小鼠胸腔,暴露气道。手术获取小鼠气道5~6个,沿长轴剪开,PBS清洗,1.5 mg/mL中性蛋白酶37 ℃孵育消化0.5 h,手术刀背刮气道管腔面,眼科剪刀剪碎刮下的黏液团,再消化0.5 h,含10% FBS的 DMEM终止消化。1 000 r/min,5 min离心后40 μm细胞筛过滤,接种于含增殖培养基的60 mm的培养皿中,记为培养第0天,2~3 d后换液,倒置显微镜下观察细胞生长情况。
1.5 小鼠原代基底细胞鉴定 选用NIH/3T3成纤维细胞作为阴性对照组,鉴定方法如下:-20 ℃甲醇固定培养的基底细胞,室温10 min,PBS冲洗3次,每次5 min。用1× PBS制成的0.2% Triton X-100孵育5 min,1× PBS冲洗,封闭缓冲液孵育1 h。KRT5一抗(1∶300)稀释在4 ℃孵育过夜,1×PBS洗涤3次,每次5 min。用山羊抗兔荧光二抗(1∶300)稀释在室温下避光孵育1 h,1× PBS清洗3次,每次3 min。加入DAPI室温避光孵育5 min,1× PBS清洗3次,每次3 min。荧光显微镜观察KRT5荧光表达情况。
1.6 小鼠原代基底细胞ALI培养体系构建 气道上皮原代基底细胞生长至70%~80%汇合度后0.25%胰酶消化8 min,用含有 10%FBS的DMEM终止消化, 1 000 r/min、离心 5 min, 加入增殖培养基悬浮沉淀,细胞计数板计数,将细胞浓度稀释到1.65×105个/mL,在6.5 mm Transwell小室加入200 μL细胞悬液,并在小室下方添加600 μL增殖培养基。待细胞达到100%融合率,培养基更换为分化培养基,开始进行气液界面培养,每2~3天换1次液,镜下观察分化情况。在培养7、14、21 d时用扫描电镜观察纤毛生长情况。
1.7 小鼠基底细胞的传代实验 按上述方法,收集气道上皮原代基底细胞制成细胞悬液,细胞计数板计数,将细胞浓度稀释到2.3×105个/mL,在6孔板中加入1 mL细胞悬液及2 mL增殖培养基。每24 h观察细胞生长情况,待细胞融合率达70%~80%,连续传代,重复上述操作。
1.8 不同代数基底细胞的ALI培养 收集1~8代的基底细胞,制成细胞悬液,按上述方法进行ALI培养,2~3 d换液1次。
1.8.1 HE染色观察ALI培养后各代细胞分化情况 取气液界面培养21 d的Tanswell小室,1×PBS清洗两2次,4% PFA固定,30%蔗糖脱水后将Transwell小室底部的膜切割,经OCT包埋进行冰冻切片,用1×多聚赖氨酸包被的盖玻片贴取切片,于50 ℃烘烤2 h,HE染色,中性树胶封片后观察。
1.8.2 扫描电镜观察分化后游离面纤毛 取ALL培养21 d的Tanswell小室,PBS润洗小室两遍,加入2.5%戊二醛室温固定2 h,PBS冲洗4次,每次15 min。加入1%四氧化锇固定 1.5 h。吸去锇酸,用PBS冲洗4次,每次10 min。梯度脱水:30%、50%、70%、90%乙醇脱水1次,每次15 min,100%乙醇脱水2次,每次15 min。临界点干燥仪干燥,真空镀膜机待金或碳喷镀到样品表面,取出用扫描电镜观察、拍照。

2 结果
2.1 光镜下观察小鼠气道原代基底细胞情况 结果显示,培养第2 天(图1A),有散在的小团块成“簇状”增殖生长的贴壁细胞,另有呈梭型、圆形的细胞。培养第3 天(图1B),“簇状”团块细胞增殖快速变大,呈经典的“铺路石”状。同时梭型细胞增多,圆形透明的细胞减少。培养第4天(图1C),细胞大小不等,有部分细胞体积继续变大,更加扁平,胞质空泡化,细胞呈现老化状态。培养至第5~6天(图1D,E), “铺路石”状细胞排列明显,但空泡化的细胞增多,梭型细胞在减少。鹅卵石样细胞、体积变大细胞、胞质空泡化细胞融合在一起。图1F显示,第2~4天,细胞生长缓慢,第4天后细胞进入对数生长期,细胞增殖活跃,培养至第6天细胞融合高达70%~80%,老化细胞增多,可以进行传代。
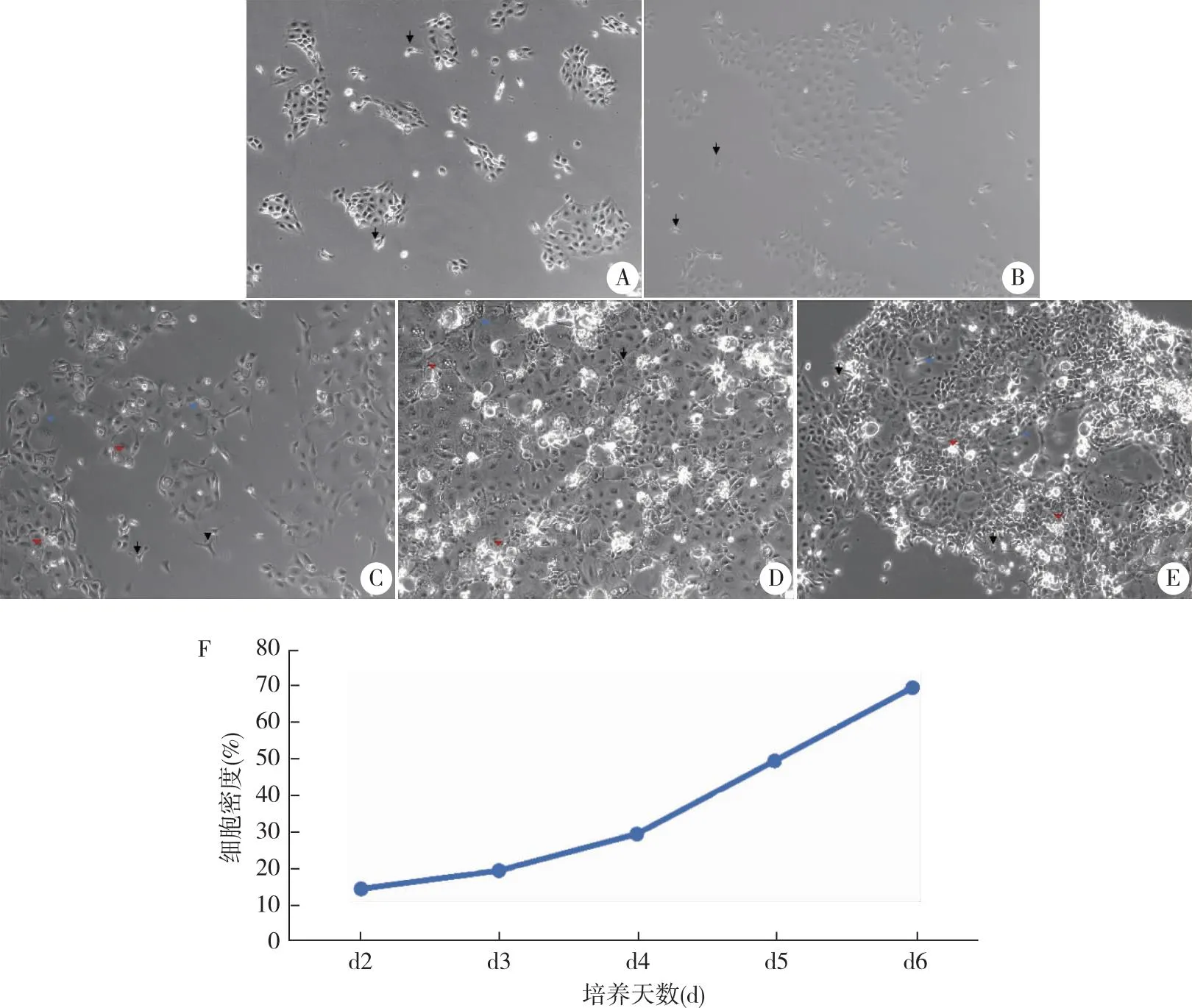
A~E分别代表:培养第2、3、4、5、6 天;所指为梭型细胞;所指为空泡化的细胞;所指为体积大且扁平的细胞;F:P0生长曲线;标尺:100 μm,放大倍数×100。
2.2 免疫荧光鉴定小鼠气道原代基底细胞 KRT5基因标记气道上皮基底细胞,小鼠胚胎成纤维细胞(NIH/3T3细胞)阴性对照,KRT5标记为绿色,DAPI标记为蓝色。免疫荧光染色显示:分离培养的原代细胞大部分表达KRT5阳性,通过软件分析,阳性率(KTR5阳性细胞数/DAPI核染细胞总数)可达95%(图 2C),阴性对照NIH/3T3细胞未观察到绿色荧光(图2F),提示该分离方法可获取气道上皮基底细胞,且纯度达95%。

A~C:分离细胞的KRT5荧光和DAPI荧光;D~F:NIH/3T3KRT5荧光和DAPI荧光;标尺:20 μm,放大倍数×400。
2.3 ALI培养观察小鼠气道基底细胞的分化 倒置显微镜下观察:ALI d 7至ALI d 21均观察到细胞堆叠,小室表面凹凸不平并有粘液分布(图3B~D)。ALI d 21可明显观察到纤毛快速摆动。

A~D:倒置显微镜观察ALI d 0、ALI d 7、ALI d 14、ALI d 21;E~G:HE染色观察ALI d 7、ALI d 14、ALI d 21;所指为纤毛;H~J:扫描电镜观察ALI d 7、ALI d 14、ALI d 21;A~D标尺:100 μm,放大倍数×100;E~G标尺:20 μm;H~I标尺:10 μm,放大倍数×5.00 K。
HE染色和扫描电镜观察:ALI d 7细胞已经出现堆叠,达到2~3细胞层,细胞表面凹凸不平(图3E),HE染色和扫描电镜均未观察到纤毛(图3E、H);ALI d 14和ALI d 21细胞层数没有增加,均为2~3层(图3F、G),HE染色和扫描电镜均可观察到游离面的纤毛,ALI d 21纤毛的数量更多,提示基底细胞已经出现分化(图3I、J)。
2.4 小鼠气道基底细胞传代实验
2.4.1 各传代基底细胞生长情况 倒置显微镜下观察(图4):传代的细胞生长旺盛,接种培养3 d细胞融合度可达到90%。目前已传至第八代,P1至P8:传代细胞一直保持着“鹅卵石”上皮细胞样的形态,细胞形态和大小较一致。但P5~P8细胞扁平、体积变大或胞质空泡化衰老的细胞逐渐增多。

标尺:100 μm,放大倍数×100。
2.4.2 免疫荧光检测各传代基底细胞的KRT5表达水平 免疫荧光结果(图5)显示,P1到P8都有KRT5阳性荧光,也出现KRT5阴性的细胞,荧光强度在P5后出现减弱趋势。说明随着传代数的增加,KRT5的表达水平发生了改变,提示P5代后基底细胞的功能是否也出现改变?

标尺:50 μm,放大倍数×200
2.5 ALI培养后各传代基底细胞的分化情况
2.5.1 HE观察形态结构 结果显示,P1至P3细胞层较高,可观察到柱状细胞,游离面有纤毛,P4细胞形态变为扁平,游离面也可观察到纤毛,但P5至P8细胞形态均扁平,游离面未观察到纤毛,说明从P4后细胞分化出现异常现象(图6)。
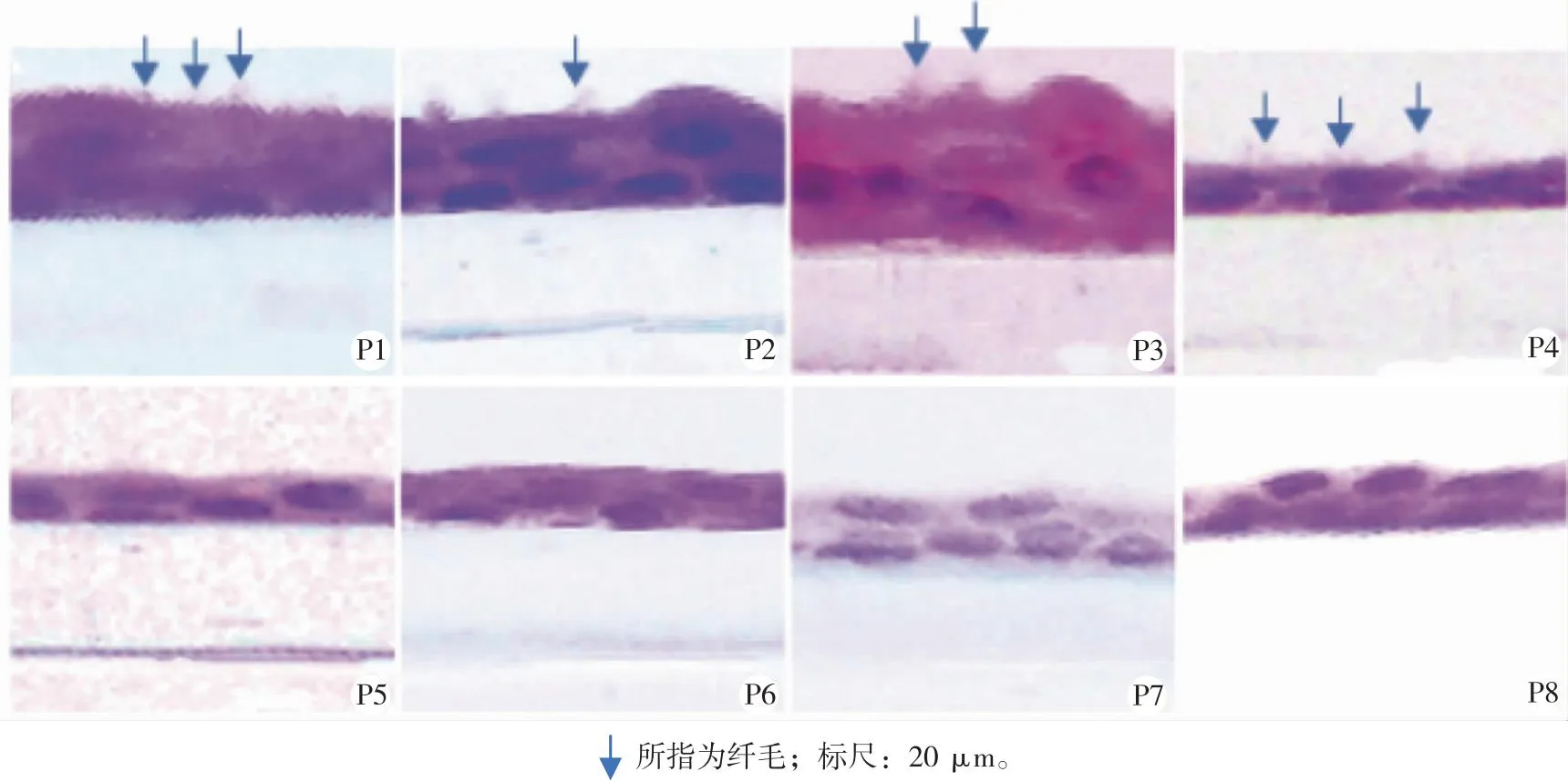
图6 HE观察各传代基底细胞分化后的形态结构
2.5.2 扫描电镜观察分化后细胞表面的情况 扫描电镜观察:P1至P8,均可观察到纤毛、微绒毛结构。P1~P3纤毛成束状,周围可见卵圆形细胞,可能为黏液细胞。P4~P8纤毛单根分明,周围细胞呈扁平状。2.50 K放大倍数下,任意取3个视野比较定向分化细胞游离面特化结构的面积,P1~P4代细胞游离面特化结构的面积多,而P5~P8细胞游离面特化结构的面积少,与P1相比有统计学差异(图7)。

标尺:20 μm,放大倍数×2.5 K;***:与P1比较,P<0.001。
3 讨论
在呼吸系统中,对肺上皮细胞的研究取得了很大的进展,已经可以了解到肺泡 II 型(AT2)细胞维持分化AT1 细胞[12],但气道上皮,因其细胞成分的复杂性,仍然存在很多未知的东西。基底细胞位于上皮的基底部,且数量少,消化分离时较为困难,按传统的原代分离方法,无法获取足够多活性好的细胞,分离时,国内、外大多使用的是蛋白酶4 ℃消化4~24 h[10,13-14]。本实验对酶消化法进行了改良,将气道剖开进行分段消化和处理(先组织整体中性蛋白酶消化0.5 h,刮下腔面黏液团剪碎后再消化0.5 h),避免消化时间过短无法消化下来,时间过长活性减弱或黏膜下层其他细胞一并消化下来。改良后的酶消化法,缩短了消化时间,可获取活性好、数量较多的气道上皮细胞。除基底细胞的其他上皮细胞属于成体细胞,增殖能力弱,通过培养就可清除。在小鼠中,大多数稳态气道上皮基底细胞是KRT5/KRT15/14++-[15],通过免疫荧光鉴定95%为KRT5阳性细胞,所以该分离方法可行,能分离纯度较高的基底细胞。
基底细胞分布于上皮的基底部,体内环境相对稳定,体外培养时DMEM/F12等培养基无法满足要求。目前,基底细胞培养方法选用含有Rho相关蛋白激酶抑制剂Y-27632的培养基,将与有丝分裂灭活的3T3成纤维细胞进行共培养[16-17]。有丝分裂灭活的方法有射线照射或者丝裂霉素C处理[18-19],过程繁琐,联合培养需要探索,3T3成纤维细胞和基底细胞共存,不利于后续实验开展。因此,本实验无血清和BPE的细胞培养基PneumaCultTM-Ex Plus只适合气道上皮细胞的培养,不利于成纤维细胞等其他类型细胞生长,该培养基培养上皮细胞时不需要饲养层细胞,也不需要使用差速贴壁法分离成纤维细胞,只需通过培养和传代可进一步使细胞纯化。通过细胞传代和定向分化实验,该培养基可很好的维持基底细胞的增殖和定向分化效果。
原代细胞ALI培养物与浸没的单层培养物相比,ALI培养物与体内天然气道上皮结构和功能更相似[20]。ALI培养极大地扩展了在体外系统中测量组织特异性终点的可能性,例如组织屏障功能,离子通道生理学,MCC和组织形态。评估与呼吸系统疾病相关的组织反应有望为确定空气中物质的潜在不良健康影响提供有价值的信息。本实验ALI培养,将原代或传代的细胞接种到Transwell小室,在顶端和基底外侧隔室中添加增殖培养基。培养2~4 d,当细胞达到完全汇合时,通过去除顶端隔室中的培养基并向基底外侧隔室添加分化培养基。这使得培养物的顶端侧暴露在空气中,基底外侧与分化培养基接触,这种培养条件模拟天然环境,对于驱动及基底细胞分化为气道中发现的粘液纤毛表型至关重要。ALI 14 d和ALI 21 d后细胞层数为2~3层,HE染色和扫描电镜均可观察到游离面的纤毛,ALI 21 d纤毛的数量更多,提示基底细胞已经出现分化。因此,实验室已成功构建了基底细胞ALI培养体系,为从细胞水平上分析研究各种疾病的分子基础奠定了条件。
基底细胞虽可以分离和传代培养[13],但传代后是否保持干细胞的特性和定向分化,未见研究。因此,本实验涉及了基底细胞的增殖和分化实验研究。阶段研究结果显示,基底细胞已传至P8代,细胞增殖效果好,P5代后,细胞老化、死亡相对增多,免疫荧光强度也变弱。ALI培养,HE染色和扫描电镜均体现P5代,细胞层扁平,分化能力弱,形成纤毛数量减少。说明P1代到P4代基底细胞增殖效果好,分化能力强,但P5代后增殖和分化均出现下降趋势。实验结果与Rayner等[21]用PneumaCuTM-Ex Pus和PneumaCultTM-ALI对人类气道上皮细胞进行传代和ALI培养结果一致。至于为什么P5代后各项指标出现下降有待于进一步研究。根据目前结果,基底细胞ALI培养应选择P4代以前细胞进行培养效果更好。
