NLRP3炎性小体对哮喘小鼠TGF-β1/Smad3信号通路的调控及机制研究
2023-12-28杨红霞,张建勇
支气管哮喘(bronchial asthma)简称哮喘,是一种以慢性气道炎症、气道高反应性和气道重塑为特征的异质性疾病[1]。其中,气道重塑是哮喘最主要的病理特征之一[2]。哮喘患者反复发生的气道炎症,引起肺组织损伤以及不正常修复,最终导致气道壁结构和功能发生改变,这一过程被称为气道重塑。气道重塑是引起哮喘患者不可逆性气流受限、肺功能下降和治疗效果不佳的主要原因[3]。转化生长因子β1(transforming growth factor β1,TGF-β1)/Smad3信号通路在哮喘气道重塑过程中起着重要作用[4]。NLRP3炎性小体是一种由NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor protein3,NLRP3)、凋亡相关斑点样蛋白(ASC)和半胱天冬氨酸蛋白酶1前体(pro-caspase-1)组成的多蛋白复合物,对微生物感染、内源性危险信号和环境刺激等作出反应。组装的NLRP3炎性小体可激活蛋白酶1(Caspase-1)诱导消皮素D(gasdermin D, GSDMD)依赖性细胞焦亡,促进IL-1β和IL-18的释放,有助于先天性免疫防御和稳态维持[5]。最新的研究表明,通过NLRP3炎性小体的激活和GSDMD切割,引起支气管上皮细胞焦亡,可加剧过敏原诱导的哮喘气道炎症反应和气道高反应性的发生。NLRP3炎性小体介导的细胞焦亡是哮喘治疗的潜在靶点[6]。但NLRP3炎性小体在哮喘气道重塑中的具体作用和机制尚不清楚。本研究通过鸡卵清白蛋白(ovalbumin, OVA)诱导制备哮喘小鼠模型,使用NLRP3特异性抑制剂MCC950进行干预,观察NLRP3炎性小体对TGF-β1/Smad3信号通路的调控作用及对哮喘气道重塑影响的可能机制。
1 材料与方法
1.1 材料
1.1.1 主要实验试剂 鸡卵清白蛋白(A5503,V级,美国Sigma公司);氢氧化铝凝胶(vac-alu-250,美国invivogen公司);MCC950(HY-12815A,美国MedchemExpess公司);AB-PAS 染色试剂盒(G1285,北京索莱宝生物技术有限公司);IL-1β和IL-18 ELISA试剂盒(JL18442、JL20253,上海江莱生物技术有限公司);兔抗小鼠Anti-NLRP3 抗体(GTX00763,美国GeneTex 公司);兔抗小鼠重组Anti-TGF-β1抗体、兔抗小鼠Anti-Smad3抗体、山羊抗兔IgG HRP(ab215715、ab84177、ab6721,英国abcam公司);RNAiso Reagent、qRT-PCR试剂盒(RR820A、RR037A,大连TaKaRa公司);NLRP3和β-actin引物(北京擎科生物有限公司);Anti-Beta Actin抗体、二抗HRP Conjugated Goat anti-Rabbit IgG Goat Polyclonal Antibody(EM21002、HA1001,华安生物);高效RIPA组织裂解液、PMSF、10%PAGE 凝胶快速制备试剂盒、Omni-Easy 即用型BCA 蛋白定量试剂盒(PC101、P0100-1mL、PG112-10、ZJ102,上海雅酶生物医药科技有限公司);4×蛋白上样缓冲液(P1015-10mL,北京索莱宝生物技术有限公司);预染蛋白Marker、ECL化学发光试剂盒(WJ102、SQ201,上海雅酶生物医药科技有限公司);脱脂奶粉(A600669-0250,上海生工生物工程有限公司);PVDF膜(美国Milipore公司)。
1.1.2 主要实验仪器 压缩空气式雾化器(403H,中国鱼跃医疗);核酸蛋白测量仪(Nanodrop 1000,美国Thermo scientific公司);荧光定量PCR仪(CFX96,BIO-RAD 公司);酶标仪(Multiskan FC,美国Thermo scientific公司);三维冷冻研磨仪(KZ-5F-3D, 武汉赛维尔生物科技有限公司);电泳仪、电转仪、凝胶成像系统(PowerPac Basic、ChemiDocTMMP,美国BIO-RAD公司)。
1.2 方法
1.2.1 动物分组和模型制备 于湖南斯莱克景达实验动物有限公司购买的SPF级BALB/c小鼠[许可证号:SCXK-(湘) 2019-0004)], 24只,6~8周龄,雌性,体重(18.22±0.61) g。动物饲养及实验环节均严格遵照遵义医科大学附属医院伦理委员会《实验动物管理条例》进行(伦理审查编号:KLL-2021-352)。将24只小鼠按照完全随机数字表法分为正常对照组(NC组,n=8)、哮喘组(AS组,n=8)和哮喘组+MCC950干预组(AS+MCC950干预组,n=8)。在Kim等[7]和Casaro等[8]制作哮喘小鼠模型的基础上,进一步改进方法建立本研究中的哮喘小鼠模型。AS组和AS+MCC950干预组小鼠均在第1 天和第13天,通过腹腔、颈部皮下及双侧大腿根部皮下注射OVA和氢氧化铝混悬液进行致敏,第19 天开始予10% OVA溶液进行雾化吸入激发,每天1次,每次 30 min,共激发5次。AS+MCC950干预组于第19、21、23 天雾化激发前30 min,通过腹腔注射NLRP3特异性抑制剂MCC950(10 mg/kg)进行干预,共3次。NC组致敏和激发时以PBS代替OVA,其余处理条件同AS组。
1.2.2 肺组织和BALF标本采集 各组小鼠于末次激发24 h,充分麻醉后经腹主动脉处放血处死,暴露胸腔,在结扎右肺肺门后剪取右肺组织,用于提取肺组织RNA、蛋白和制作石蜡块。充分暴露颈部气管,行气管插管后予PBS液共灌洗3次肺,收集支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF),离心,取上清液用于炎症因子的测定。
1.2.3 HE染色和AB-PAS染色观察肺组织病理形态 肺组织标本制作成石蜡块后切片,进行HE染色和AB-PAS染色,按试剂盒说明书方法进行染色。光镜下观察肺组织病理形态、气道上皮杯状细胞增生及气道黏液物质分泌情况。
1.2.4 qRT-PCR检测肺组织NLRP3 mRNA水平 提取小鼠肺组织中的RNA,将mRNA逆转录成cDNA,以此为模板进行qRT-PCR扩增。计算出每一样本定量结果Ct(threshold cycle)值,采用2-△△Ct法计算NLRP3 mRNA的相对表达量。β-actin和NLRP3引物序列(表1)。

表1 β-actin和NLRP3引物序列
1.2.5 IHC染色检测肺组织中NLRP3、TGF-β1和Smad3蛋白表达 将肺组织切片常规脱蜡至水后置于PH 9.0 EDTA 缓冲液中,微波抗原修复15 min,其余步骤根据试剂盒说明书进行操作。一抗兔抗小鼠Anti-NLRP3 抗体、兔抗小鼠重组Anti-TGF-β1抗体和兔抗小鼠Anti-Smad3抗体稀释浓度均为1∶500,二抗山羊抗兔IgG HRP抗体稀释浓度为1∶500。进行图像采集和分析,阳性蛋白的表达量使用平均积分光密度(Mean IOD)来表示。
1.2.6 Western blot检测各组小鼠肺组织中NLRP3蛋白表达 使用组织研磨仪提取各组小鼠肺组织中蛋白,根据BCA蛋白定量试剂盒说明书对样品进行蛋白定量,加入相应体积的4×loading buffer 和RIPA 组织裂解液使每个样品蛋白浓度为2 μg/μL,混匀后煮5 min使蛋白变性。SDS-PAGE电泳,转PVDF膜(300 mA电流,转膜120 min),5%脱脂奶粉封闭2 h,加入NLRP3一抗(1∶1 000稀释)4 ℃孵育过夜,次日加入二抗HRP Conjugated Goat anti-Rabbit IgG Goat Polyclonal Antibody(1∶10 000稀释),室温孵育2 h,洗膜后使用ECL发光液在曝光机下曝光。Image J进行灰度扫描分析结果,目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.2.7 ELISA法检测BALF中IL-1β和IL-18炎症因子水平 根据ELISA试剂盒说明书方法检测BALF上清液中炎症因子IL-1β和IL-18的含量,在酶标仪450 nm处读取吸光度值,再计算其浓度。

2 结果
2.1 各组小鼠肺组织病理改变 HE和AB-PAS染色结果显示,NC组小鼠气道管壁及肺泡壁结构完整、气道上皮未见明显杯状细胞增生、管腔未见狭窄、管腔内未见黏液分泌,AS组小鼠气道管壁增厚、气道上皮大量杯状细胞增生、气道周围见大量炎症细胞浸润、管腔狭窄,部分管腔内见黏液栓,AS+MCC950干预组小鼠气道上皮杯状细胞和黏液物质分泌、气道周围炎症细胞表达较AS组减少,管壁稍有增厚,管腔未见明显狭窄(图1)。

×200。
2.2 各组小鼠肺组织中NLRP3 mRNA含量的比较 AS 组肺组织NLRP3 mRNA相对表达量较 NC 组增高(P<0.01);AS+MCC950干预组肺组织NLRP3 mRNA相对表达量较 AS 组减少(P<0.05,表2)。

表2 各组小鼠肺组织NLRP3 mRNA相对表达量
2.3 各组小鼠肺组织中NLRP3、TGF-β1和Smad3蛋白含量的比较 IHC染色结果显示,与NC组比较,AS 组肺组织中NLRP3、TGF-β1和Smad3 蛋白表达量增高(P<0.01),使用MCC950干预后,AS+MCC950干预组 NLRP3、TGF-β1和Smad3蛋白表达量较 AS 组明显减少(P<0.01,表3、图2)。Western blot检测结果显示,AS组与NC组、AS+MCC950干预组相比,肺组织中NLRP3蛋白表达水平升高,提示使用MCC950干预后,可以抑制哮喘小鼠NLRP3蛋白表达(P<0.05,图3)。
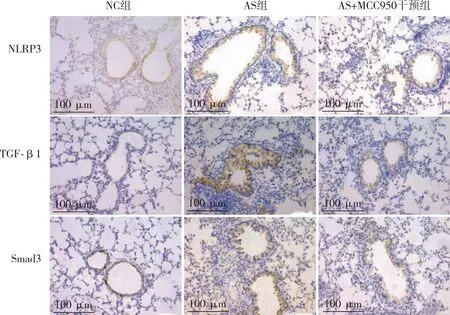
IHC×200。
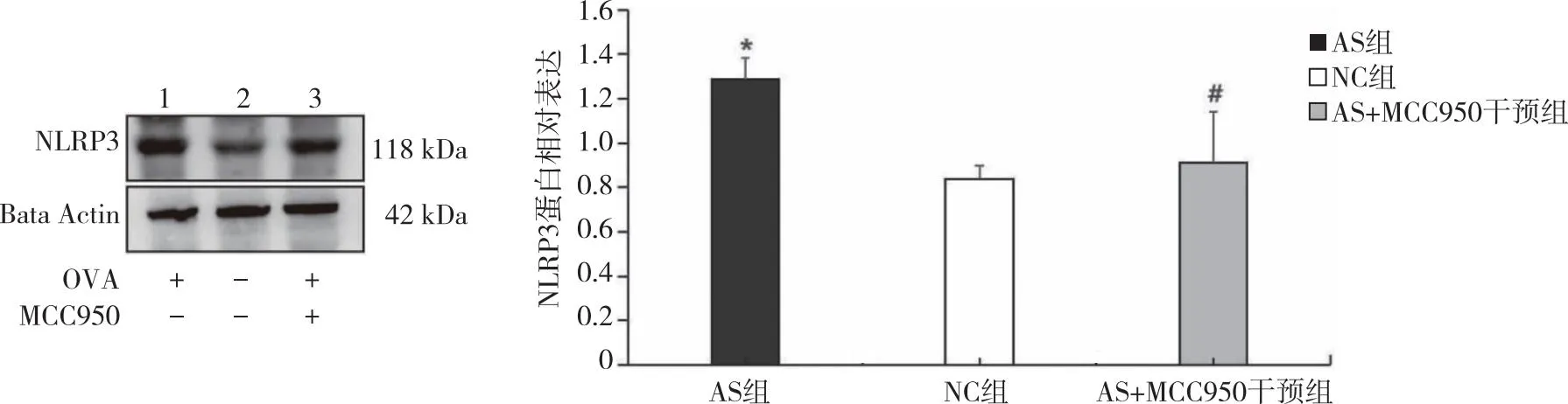
1:AS组;2:NC组;3:AS+MCC950干预组;*:与NC组比较,P <0.05;#:与AS组比较,P <0.05。

表3 IHC染色检测各组小鼠肺组织NLRP3、TGF-β1和Smad3蛋白含量的比较
2.4 各组小鼠BALF中炎症因子IL-1β和IL-18表达水平 与NC组比较,AS组BALF中IL-1β和IL-18浓度明显增高(P<0.01),AS+MCC950干预组BALF中IL-1β和IL-18浓度与AS组比较明显下降(P<0.01,表4)。
表4 各组小鼠BALF中 IL-1β和IL-18表达比较
3 讨论
人体的气道上皮是接触变应原、病原体等有害物质的第一道天然屏障,在炎症反应、免疫反应环节发挥重要作用,以抵抗进入呼吸道的各种有害物质的入侵[9]。气道上皮损伤是哮喘发病的重要标志,反复有害刺激会导致气道上皮的重复损伤、炎症反应、组织修复和气道重塑,引起气流受限[10]。TGF-β是一个具有多种生物学功能的细胞生长因子家族,其中TGF-β1、TGF-β2和TGF-β3这3个亚型存在于哺乳动物中,而TGF-β1是发挥生物学功能的主要因子[11],通过其受体发出信号,激活信号转导器Smad家族成员发挥作用,调节细胞增殖、分化、死亡和迁移[12]。近年来的研究表明,激活TGF-β1/Smad3信号通路可加重哮喘气道炎症和气道重塑,抑制该信号通路可以减轻气道重塑及气道炎症反应[13]。本研究结果表明,在AS组小鼠气道管壁明显增厚、气道上皮有大量杯状细胞增生、管腔狭窄、气道周围见大量炎症细胞浸润等气道重塑表现,肺组织中TGF-β1和Smad3蛋白的表达水平较NC组小鼠明显增高。说明 TGF-β1/Smad3信号通路参与哮喘小鼠气道重塑过程。
NLRP3是目前研究最多的Nod样受体家族成员之一,主要表达在上皮细胞、巨噬细胞、平滑肌细胞等多种细胞的细胞间质及细胞膜[14]。正常状态下胞内NLRP3的表达量极低,不能用于组装或活化NLRP3炎性小体,只能保持不活跃但有应答的泛素化状态。在一定条件下被激活后,可以诱发下游通路中炎性因子释放来调节机体炎症反应[15]。研究发现,NLRP3炎性小体被激活后,通过活化蛋白酶Caspase-1及下游GSDMD而诱导细胞焦亡,导致炎症因子IL-1β和IL-18大量释放从而引起炎症反应[16]。Zhuang等[17]研究表明,哮喘小鼠体内NLRP3和Caspase-1蛋白表达量增加,炎性因子IL-1β分泌增多。Ma等[18]研究发现,在吸入屋尘螨诱导的过敏性哮喘小鼠中,肺部NLRP3炎性小体被激活,并特异性诱导肺泡巨噬细胞Caspase-1和IL-1β的成熟,NLRP3抑制剂治疗显著减少了气道炎症细胞浸润和粘液分泌。经OVA诱导的野生型和NLRP3(-/-)小鼠,野生型小鼠NLRP3、Caspase-1和IL-1β蛋白表达增强,NLRP3(-/-)小鼠表现为BALF中嗜酸性粒细胞减少、气道IL-1β表达水平降低、气道高反应性下降[19]。在哮喘模型中使用NLRP3抑制剂可抑制气道高反应性和肺部炎症[20],MCC950是一种含二芳基磺酰脲的化合物,被认为是一种特异性的小分子抑制剂,可以选择性地阻断NLRP3炎性体的激活,进一步阻碍IL-1β的成熟和释放[21 ]。Chen等[ 22]研究发现,NLRP3炎症小体抑制剂MCC950降低了OVA诱导的哮喘小鼠肺组织中IL-1β和IL-18的产生,可以显著减轻哮喘小鼠气道高反应性和气道炎症。本研究结果显示,AS组小鼠肺组织中NLRP3蛋白和mRNA、IL-1β、IL-18的表达水平较NC组明显升高,使用NLRP3特异性抑制剂MCC950干预后,AS+MCC950干预组小鼠肺组织中NLRP3蛋白和mRNA、IL-1β、IL-18的表达水平均较AS组下降,说明MCC950干预可以抑制哮喘小鼠NLRP3、炎症因子IL-1β和IL-18的表达。通过阻断NLRP3炎性小体激活对哮喘具有治疗作用,但其作用的确切机制仍不清楚。
研究发现,去泛素化酶OTUB1和肿瘤坏死因子受体相关因子3(tumor necrosis factor receptor-associated factor 3, TRAF3)相互作用介导NLRP3炎性小体激活,促进TGF-β1诱导人支气管上皮细胞(BEAS-2B细胞)的炎症和重塑发生,在哮喘的发病机制中起着重要调控作用[23]。炎性因子IL-1β增强TGF-β诱导上皮细胞的上皮-间充质转化(epithelial-mesenchymal transition, EMT),并与中性粒细胞性哮喘患者肺功能改善不佳有关[24]。NLRP3炎性小体在肺泡上皮细胞中被激活,NLRP3可能通过TGF-β1调控EMT而参与肺纤维化的发生发展,其中,EMT在气道重塑过程中具有重要作用[25]。NLRP3可能通过调控TGF-β信号通路来参与气道重塑过程,但在哮喘气道重塑中的具体作用机制尚不明确。本研究结果显示,AS组小鼠肺组织中TGF-β1和Smad3蛋白的表达水平较NC组明显升高,使用NLRP3特异性抑制剂MCC950干预后,AS+MCC950干预组小鼠肺组织中TGF-β1和Smad3蛋白的表达水平均较AS组下降,说明MCC950干预可以抑制哮喘小鼠NLRP3激活,抑制炎症因子IL-1β的表达,进一步下调TGF-β1、Smad3的生成,从而抑制哮喘小鼠气道重塑。
综上所述,NLRP3炎性小体可能通过介导气道上皮细胞焦亡产生大量炎症因子IL-1β和IL-18,上调肺组织中TGF-β1的生成,进一步调控TGF-β1/Smad3信号通路来促进哮喘气道重塑发生。MCC950可以抑制哮喘小鼠NLRP3炎性小体的活化和炎症因子IL-1β和IL-18分泌,下调TGF-β1和Smad3的表达,其可能机制是通过干预NLRP3/IL-1β/TGF-β1/Smad3信号通路来抑制哮喘小鼠气道重塑。
