基于MiniSeq技术分析SOX10,NRG1,NRG3基因单核苷酸多态性与先天性巨结肠症的相关性
2023-12-28王意,刘应松,马达
先天性巨结肠症(hirschsprung’s disease,HD)是常见的小儿遗传疾病[1-2],临床症状主要表现为胎便排出延迟,粪便瘀积导致肠梗阻及结肠肥厚扩张,严重者可导致爆发性小肠结肠炎,若不及时采取治疗措施,可能威胁患儿生命[3]。因此,探究HD发病的相关因素并及时采取干预措施,对于改善患儿预后至关重要。多项研究认为,HD是由多种低外显致病基因协同作用造成的遗传性疾病[4-5],其主要病理机制为神经调节蛋白通路的失调。NRG1和NRG3基因均属于神经调节蛋白(NRGs),可参与调控神经角质细胞的生长、增殖与分化等,在上皮、肌肉细胞的增殖与分化中发挥重要作用[6-7]。与NRG1类似,SOX10对于形成和维持发育后期胶质细胞的特性至关重要,有学者在HD患者的无神经节细胞肠段中观察到SOX10的异常表达[8]。上述研究证实HD的发病与NRG1、NRG3和SOX10基因表达密切相关,但其基因多态性对HD发病的影响相关研究较少,现基于MiniSeq基因测序技术对HD患者NRG1、NRG3和SOX10基因多个位点单核苷酸多态性(single nucleotide polymorphism,SNP)进行检测,探讨基因多态性与HD发病的相关性,具体报道如下。
1 资料与方法
1.1 对象 选择本院在2019年2月到2023年2月期间确诊为HD的患儿74例作为病例组,并将同期83例健康儿童纳入对照组,病例组患儿年龄为2个月~10岁,平均年龄(4.83±1.34)岁;对照组体检儿童年龄为3个月~9岁,平均年龄(4.22±1.10)岁。纳入标准:①HD诊断参考《先天性巨结肠的诊断及治疗专家共识》[9];②研究对象家属签署知情同意书;③研究对象均具有完整的临床资料。排除对象:①样本采集前接受药物治疗;②内分泌相关病史者;③配合度较低者。本次研究应用的治疗方案经东莞市第八人民医院伦理委员会的审核批准(审批号:DEPH190211)。
1.2 方法
1.2.1 临床资料收集 收集患者基本资料用于本次研究,包括性别、母亲年龄、父亲年龄、其它先天性疾病、母孕期主/被动吸烟、母亲接触有毒物质、父亲接触有毒物质、母孕期合并症、母孕期患病史、家庭先天性畸形史、家庭恶性肿瘤病史及家庭顽固性便秘史。
1.2.2SOX10、NRG1和NRG3基因单核苷酸多态性检测 利用生物信息数据库(https://www.ncbi.nlm.nih.gov/snp/)查找目的基因的多态性位点,本研究选取SOX10多态性位点rs139884,3个NRG1多态性位点rs2439302、rs7835688和rs16879552,3分NRG3多态性位点rs10748842、rs10883866和rs6584400,釆用PCR扩增目的基因,再对所选SNP位点进行分型分析。
采外周血2 mL于EDTA抗凝管中,使用白细胞纯化试剂处理血液样本5 min,离心3 min转速为3 000 r/min,再经两次纯化后得到白细胞样本,涡旋裂解白细胞样本3 min,得到待测DNA样品。SOX10、NRG1和NRG3基因PCR引物设计如表1所示。PCR反应体系20 μL:模板DNA 2 μL,正反向引物各0.5 μL,2×Taq PCR Master Mix 10 μL,去离子水7 μL。PCR反应条件:①DNA链预变性95 ℃,10 min;②DNA链变性92 ℃,30 s;反应体系退火55 ℃,30 s;DNA链延伸72 ℃,45 s,均循环36次;③DNA链总延伸72 ℃,10 min;④产物4 ℃保存。PCR反应产物经2%琼脂糖凝胶检测,若目的电泳带清晰、无杂带,表明PCR扩增成功。PCR产物扩增成功后选用相应的限制性内切酶分别对选取的7个SNP位点进行酶切分析,酶切产物在2%琼脂糖凝胶电泳,观察并记录影像。采用美国Illumina公司MiniSeq高通量测序仪进行基因测序。

表1 SOX10、NRG1和NRG3基因各SNP位点引物序列

2 结果
2.1 基因分型结果 根据两组研究对象SOX10、NRG1和NRG3基因的7个SNP位点分析显示,rs139884位点等位基因C/T,分型为CC、TT、CT;rs2439302位点等位基因C/G,分型为CC、GG、CG;rs7835688位点等位基因G/C,分型为GG、CC、GC;rs16879552位点等位基因T/C,分型为TT、CC、TC;rs10748842位点等位基因T/C,分型为TT、CC、TC;rs10883866位点等位基因C/G,分型为CC、GG、CG;rs6584400位点等位基因G/A,分型为GG、AA、GA(图1),图2为各SNP位点的基因型分布情况。对检测出的SOX10、NRG1和NRG3基因多态性数据进行Hardy-Weinberg遗传平衡检验,实际频数和理论频数比较差异无统计学意义(P>0.05),样本符合Hardy-Weinberg遗传平衡定律(表2)。

A:rs139884位点1、2为CT基因型,3、4为TT基因型,5、6为CC基因型;B:1、2、3分别为rs2439302位点CG、CC、GG基因型,4、5、6分别为rs7835688位点GC、CC、GG基因型;C:1、2、3分别为rs16879552位点TT、CC、TC基因型,4、5、6分别为rs10748842位点TT、CC、TC基因型;D:1、2、3分别为rs10883866位点CC、CG、GG基因型,4、5、6分别为rs6584400位点GG、AA、GA基因型。

A:rs2439302位点;B:rs2439302位点;C:rs2439302位点;D:rs16879552位点;E:rs10748842位点;F:rs10883866位点;G:rs6584400位点。
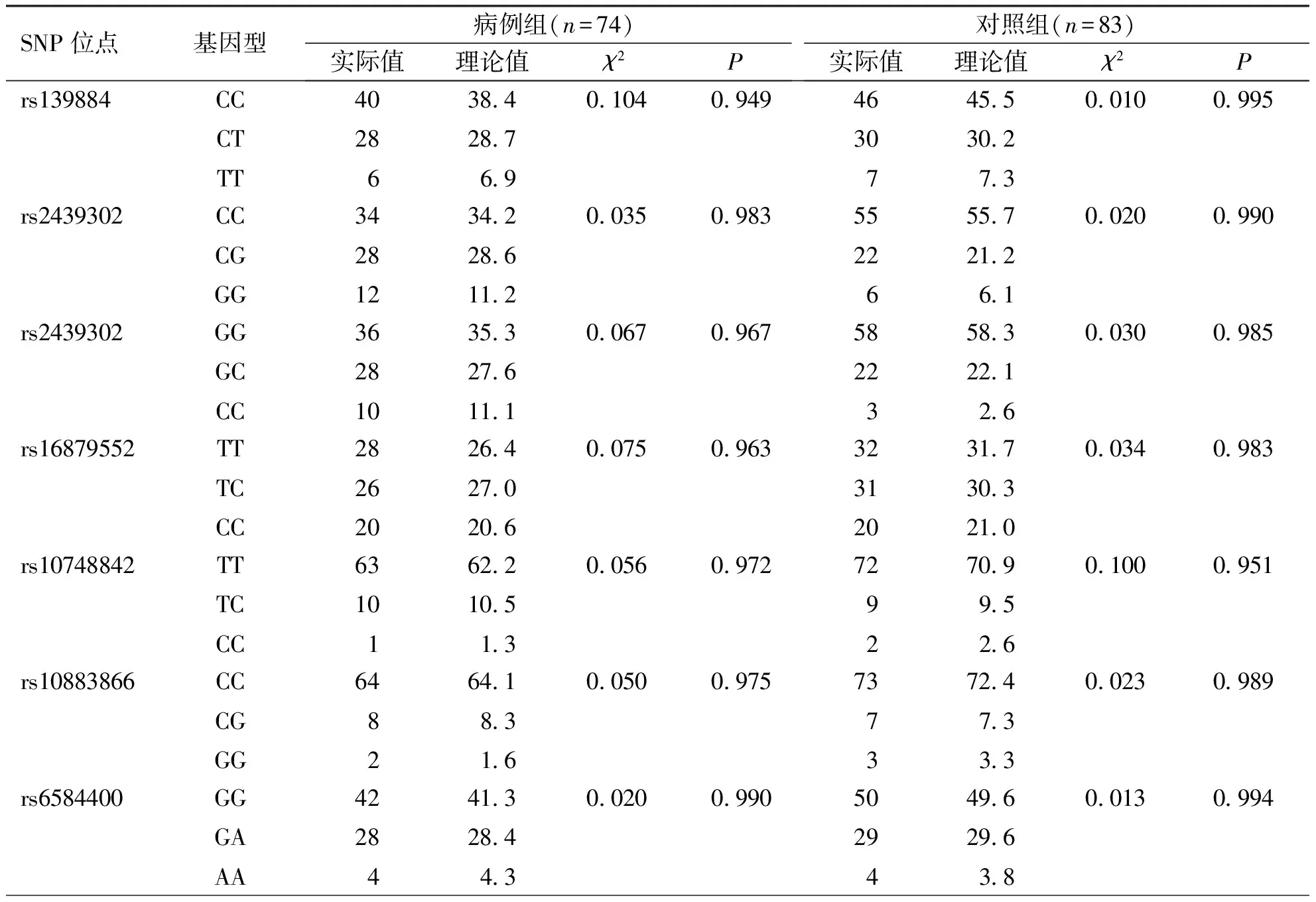
表2 Hardy-Weinberg 遗传平衡检验
2.2 两组一般资料比较 对两组一般资料进行比较,母亲年龄、其它先天性疾病、父亲接触有毒物质、母孕期合并症、母孕期患病史、家庭顽固性便秘史对患儿HD发病无显著影响(P>0.05),病例组患儿父亲年龄显著高于对照组(P<0.05),病例组母孕期主/被动吸烟、母亲接触有毒物质、母亲接触有毒物质及有家庭恶性肿瘤病史的患儿人数显著高于对照组(P<0.05,表3)。

表3 病例组与对照组一般资料对比
以理论值作为参照组进行用卡方检验(χ2)。
2.3 不同基因中单个SNP位点与先天性巨结肠症的相关性SOX10、NRG1和NRG3基因各SNP位点基因型在两组中的分布情况如表4所示,NRG3基因rs10748842、rs10883866、rs6584400位点和SOX10基因rs139884位点各基因型在两组间的分布频率差异均不具有统计学意义(P>0.05);病例组患者NRG1基因rs2439302位点CG和GG基因型人数显著高于对照组,并且rs7835688位点GC和CC基因型人数显著高于对照组(P<0.05),携带NRG1基因rs2439302和rs7835688突变杂合基因和突变纯合基因型的个体比同基因位点野生纯合基因携带者HD发病风险更高。

表4 SOX10、NRG1和NRG3基因不同SNP位点与HD发病的相关性
2.4 HD发病的多因素分析 将是否HD发病作为因变量(未发病=0,发病=1),将患者一般资料中具有显著差异的因素及2个NRG1基因SNP位点的基因型作为自变量(表5)进行多因素Logistic回归分析,校正母亲年龄、其它先天性疾病、父亲接触有毒物质及母孕期合并症等因素后,分析结果显示,性别、母孕期主/被动吸烟、母亲接触有毒物质、rs2439302-G和rs7835688-C等位基因是影响HD发病的独立危险因素(表6)。

表5 多因素Logistic回归分析变量赋值情况
2.5 列线图模型 将筛选出的5个独立危险因素作为预测因子构建列线图模型,根据列阵图读出赋分结果,预测HD发病风险率,以刘某为例,男性赋分49.43分,母孕期主/被动吸烟赋分33.75分,母亲未接触有毒物质赋分0分,NRG1的rs2439302位点基因型为CG或GG赋分39.06分,NRG1的rs7835688位点基因型为GC或CC赋分38.24分,所得总分160.48分对应的概率即为预测HD发病概率79.03%(图3)。

图3 预测HD发病风险的列线图模型
2.6 模型验证 采用Bootstrap法重复抽样1 000次内部验证该模型,列线图模型预测HD发病风险作为检验变量,患者实际HD发病作为状态变量,构建列线图模型预测HD发病的ROC曲线和校准曲线,列线图模型的校准度以校准曲线中的平均绝对误差(Mean absolute error,MAE)进行评估,由分析结果可知,内部验证前后曲线下面积(AUC)分别为0.837(95%CI:0.784~0.893)、0.841(95%CI:0.786~0.896),灵敏度分别为86.5%和89.2%,特异度分别为77.1%、78.3%,MAE分别为0.015、0.017,表明列线图预测模型区分度、校准度、灵敏度及特异度良好(图4~5、表7)。
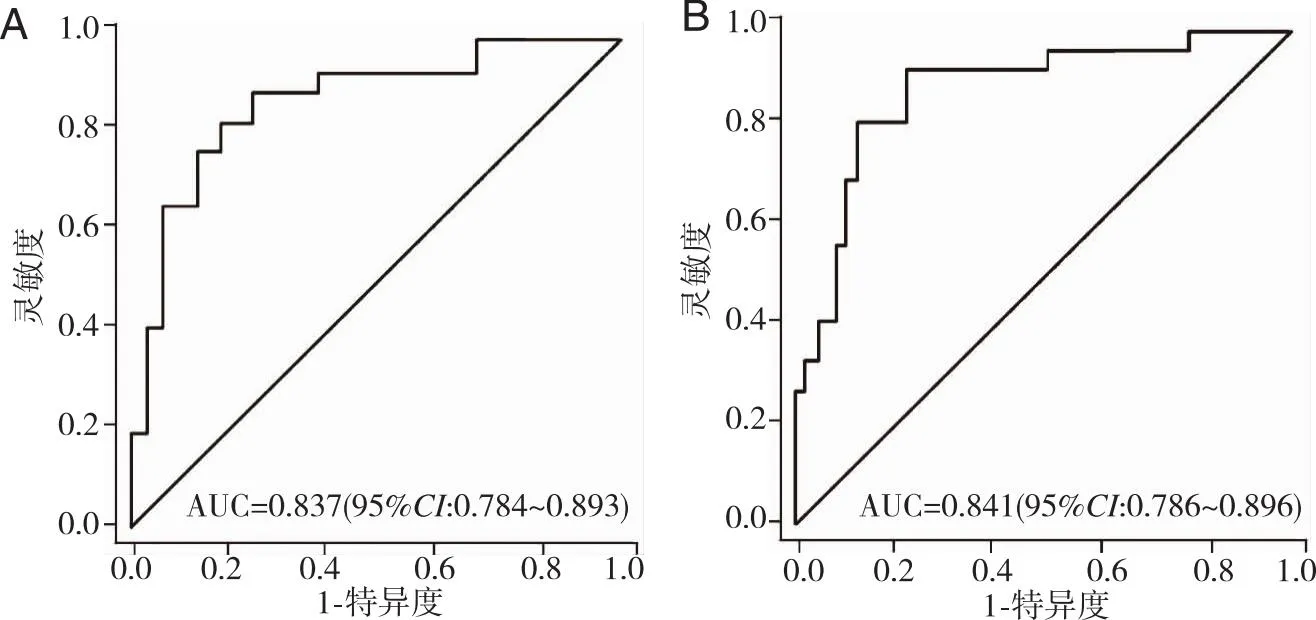
图4 内部验证前后列线图预测模型的ROC曲线

图5 内部验证前后列线图预测模型的校准曲线

表7 Bootstrap内部验证前后模型区分度指标比较
3 讨论
HD是一种先天性高度异质性遗传疾病[10]。目前发现可以在胚胎时期影响肠道发育的基因有10余种[11-12]。其中SOX10基因属于SOX基因家族成员,参与胚胎发育和细胞分化的调控[13]。目前SOX10在HD相关综合征中研究报道较多,而研究对象为HD患者相关报道较少[14]。神经调节蛋白(NRGs)是由一个表皮生长因子信号分子通路组成,他们参与了细胞间通讯,如迁移,増殖,分化及调亡等。NRG1可在整个神经系统发展中表达[15],而NRG3与NRG1有相同的受体,并且基因的协同作用可以对成神经细胞的发育产生影响[16]。但对于散发性HD患者上述基因编码区序列发生突变难以发现。因此不同SNP位点与HD的发病相关研究逐渐增多[17-19]。
HD属于复杂多基因病,多基因病是指一类由多对、十几对或更多的基因控制的、遗传因素与环境因素相互作用的疾病。目前认为一些常见的遗传变异,主要是指SNPs及其特定的组合可能是造成复杂性状疾病易感性的最重要的原因[20]。有研究表明在中国汉族人群中,NRG1基因变异会增加HD的风险[8],本研究中确认了NRG1基因两个SNP位点rs2439302与rs7835688与HD发病相关,rs2439302位点C突变为G,病例组CG和GG基因型人数显著高于对照组;rs7835688位点G突变为C,病例组GC和CC基因型人数显著高于对照组,rs2439302-G与rs7835688-C为HD发病的风险等位基因,分析其原因可能是由于NRG1通路的失调导致HD发病,并且NRG1风险基因型存在的情况下,RET rs2435357风险基因型(TT)增加2.3至19.53倍。NRG1不仅影响神经胶质细胞发育、迁移以及髓鞘和轴突形成,还与RET之间存在相互作用,通过多重机制影响HD的发展[21]。研究中多因素Logistic回归分析结果显示,除rs2435357-G和rs7835688-C外,性别、母孕期主/被动吸烟、母亲接触有毒物质也是影响HD发生的独立危险因素,基于这5项因素构建预测HD发病风险的列线图模型并验证模型,内部验证前后AUC值分别为0.837(95%CI:0.837~0.893)、0.841(95%CI:0.841~0.896),灵敏度分别为87.8%和89.2%,特异度分别为77.1%、78.3%,该模型具有良好的预测价值。但研究中未发现SNP位点rs16879552、rs139884、rs10748842、rs10883866及rs6584400与HD的发病风险相关,SOX10和NRG3基因可能不是HD发病的易感基因。本研究存在一定的局限性,纳入的样本数据来自同一医疗中心,结果难免存在一定偏倚;研究对象均为中国汉族,对于我国以外的其他种族人群,尚未进行本研究结果的合理性和有效性探讨,未来还需要扩大样本量进一步对研究结果进行确认。
综上所述,NRG1是先天性巨结肠症的易感基因,rs2439302-G和rs7835688-C为HD发病的风险等位基因,而rs16879552、rs139884、rs10748842、rs10883866和rs6584400与HD发病无明显相关性;基于性别、母孕期主/被动吸烟、母亲接触有毒物质、rs2439302-G和rs7835688-C构建的列线图模型对HD发病风险有较好的预测效果。
