初级纤毛在常见皮肤肿瘤中的研究进展
2019-06-24杨京润郑力强黄敏巴伟李承新
杨京润 郑力强 黄敏 巴伟 李承新
解放军总医院皮肤科,北京 100853
初级纤毛(primary cilia)是一种高度保守非摆动型的特殊细胞器,它存在于大多数哺乳动物的细胞中,并长期被认为是退化的器官[1]。但后来发现初级纤毛可影响细胞中心体形成纺锤体的过程,从而阻滞细胞周期,抑制细胞增殖[2]。近来研究又发现,初级纤毛不仅是多个细胞信号传导通路相关的重要的结构部位,而且还能直接与肿瘤细胞自噬共同影响肿瘤的侵袭转移[3]。初级纤毛对正常胚胎发育起着重要作用,维持各器官的正常生理功能,其异常表达或功能障碍与肿瘤细胞的发生与发展关系密切。
一、初级纤毛的组成与结构
1.基本组成:初级纤毛是一种突出于细胞表面、主要由微管组成的非运动型“天线样”亚细胞结构,进化上高度保守[4-5]。主要由基于微管结构来源的轴丝、基体和外包纤毛膜构成。轴丝为由9 个平行的微管双联体组成的“9+0”环形结构,有别于运动型纤毛中央微管对所形成的“9+2”结构。微管蛋白翻译后可经过多种修饰,包括乙酰化、谷氨酰化和甘氨酰化,这些修饰有助于调节和维持纤毛结构。因此,针对这些修饰微管蛋白的抗体与识别中心体蛋白的抗体联合使用,可以高度特异性鉴定初级纤毛数量和功能[6]。
2.基础结构:由于初级纤毛来源于细胞胞体,缺乏蛋白质合成细胞器,其形成和维持所需的相关蛋白分子必须由胞质转运而来。纤毛内转运蛋白(IFT)复合体在该双向运输过程中发挥着重要作用,该复合体由IFT-A和IFT-B两种结构和功能不同的复合体构成,其中IFT-B蛋白主要参与从胞质到初级纤毛顶端的顺向运输,而IFT-A 主要负责从初级纤毛顶端向胞质的逆向运输[7-8]。IFT复合体的双向运输分别由驱动蛋白(kinesin)和动力蛋白(dynein)驱动,使其能够沿着微管运动[2](图1)。
IFT 复合体与驱动蛋白和动力蛋白不仅为初级纤毛内部蛋白运输提供驱动力,而且还是维持初级纤毛结构和功能必不可少的分子。在低等生物和小鼠中敲除或者基因突变动力蛋白2 的组分,可导致初级纤毛变短或者功能不全,由于逆向运输障碍导致IFT 分子积累而使初级纤毛肿胀[7]。增强IFT-B 的表达能够延长初级纤毛长度,而敲除IFT-B 复合体的某些成分可使初级纤毛长度变短或缺失[9]。
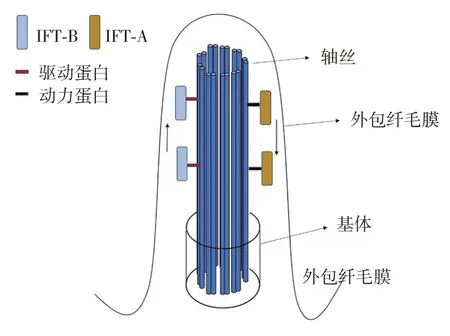
图1 初级纤毛的基本结构:主要由轴丝、基体和外包纤毛膜构成,纤毛内转运蛋白(IFT)-B主要参与从胞质到初级纤毛顶端的顺向运输,而IFT-A 主要负责从初级纤毛顶端向胞质的逆向运输。IFT复合体的双向运输分别由驱动蛋白和动力蛋白驱动
3.初级纤毛是多个细胞信号转导通路的重要结构:大量研究证实,初级纤毛不仅是机械感觉器和化学传感器,还是一个整合多种细胞生长和发育信号的传导通路,参与和调控多个信号通路的转导,包括 Hedgehog(Hh)、Wnt、PDGFR、Notch和转化生长因子β(TGF-β)等相关信号通路,与肿瘤的的发生发展、增殖和侵袭等过程密切相关[10]。例如,Hedgehog 信号通路的活化很大程度上取决于纤毛功能。在缺乏Hh 配体时,patched1 受体定位于纤毛基底部,阻止smoothened(SMO)分子进入纤毛,位于纤毛基底部的动力蛋白Kif7 与Gli 转录因子及Hh 通路中其他成分,如信号通路的抑制因子suppressor of fused 形成复合体,与转录因子Gli1、Gli2 和Gli3 在纤毛内相互作用,产生抑制型的转录因子GliR,抑制核内基因转录。当Hh 结合配体patched1后,释放smoothened 并使其转位至纤毛,解除suppressor of fused(Sufu)蛋白对信号通路的抑制,促进Gli在纤毛顶端积聚,产生活化型转录因子GliA(Gli activator),随后GliA通过动力蛋白和IFT 从纤毛进入胞质,再入核激活Hedgehog 信号通路[10]。在Hh依赖的基底细胞癌小鼠模型中,选择性敲除小鼠中KIF3a 或IFT88 这两个促进纤毛生成所必需的蛋白,可明显抑制肿瘤的生成[11]。
二、初级纤毛可调控肿瘤细胞的增殖和侵袭
1.初级纤毛与肿瘤细胞增殖:研究发现,初级纤毛能够阻滞细胞周期,抑制细胞增殖。众多研究发现,初级纤毛的形成始于基体,成熟中心体转化为基体,然后自基体组装轴丝。这一组装过程与细胞周期密切相关。在大多数细胞中初级纤毛的组装开始于细胞周期的静止期(G0期),解聚则始于S 或M 期[12]。在初级纤毛组装前,中心体可作为S/G2期中的复制模板,并在有丝分裂时形成纺锤体的两极。由于中心体相对固定在纤毛膜顶端的下方,在细胞有丝分裂前初级纤毛必须解聚以释放捕获的中心体,促进纺锤体的形成,以使细胞进入S或M期。因此,纤毛的存在可延长G0期细胞进入S 期的时间,阻滞细胞于G0/G1 期,从而抑制细胞增殖[12]。
在乳腺癌[13]、黑素瘤[14]、卵巢癌[15]、肾癌[16]、前列腺癌[17]等多种肿瘤细胞表面发现初级纤毛形成减少,特别是在胆管癌中[18],HDAC6(histone deacetylase 6)过度表达可使纤毛生成减少,促进细胞增殖。相反,强制性促进初级纤毛的生成则导致细胞周期阻滞[19],抑制细胞增殖[20]。shRNA 敲低或药物抑制HDAC6 表达能促进纤毛表达,抑制细胞增殖[18]。
2.初级纤毛可通过调控信号转导促进部分肿瘤细胞侵袭:初级纤毛在不同肿瘤中所发挥的作用是不同的,在有的肿瘤中初级纤毛的数量与肿瘤的恶性程度呈负相关(如黑素瘤)。但在另一些肿瘤中,初级纤毛可显著促进部分肿瘤的侵袭、转移。如,在胰腺、肺、结肠的肿瘤和淋巴瘤中,与正常组织相比,初级纤毛阳性表达率增加,而且存在结构异常,表现为轴丝的伸长,出现多个基体和轴丝的分支[6]。在宫颈癌HeLa 细胞、人MG63 骨肉瘤细胞、小鼠NIH3T3 成纤维细胞和MC3T3-E1 前成骨细胞系中,经饥饿处理后初级纤毛形成明显增加[21]。在胶质母细胞瘤中,初级纤毛与肿瘤侵袭相关的转录因子ZEB1 表达均升高[22]。另外,Hh 通路抑制剂-4可通过干扰人软骨肉瘤中Hh通路调控初级纤毛生成,抑制初级纤毛转运蛋白IFT88的表达,显著降低人软骨肉瘤细胞的侵袭和迁移能力[23]。不仅如此,Gencer等[24]研究表明,TGF-β 与其受体结合后,在初级纤毛内聚集,促进肿瘤迁移相关蛋白的表达,而神经酰胺通过与TGF-β 受体的抑制因子 Smad7 结合,阻止 TGF-β 受体在初级纤毛聚集,阻止细胞迁移。在转移性头颈鳞状细胞癌和肾细胞癌等肿瘤组织中神经酰胺水平显著下降,容易发生远处转移,可见初级纤毛是神经酰胺抑制肿瘤细胞增殖和转移的核心。此外,研究还发现,初级纤毛可调控PDGFRa和EG-VEGF信号,分别促进成纤维细胞的迁移[25]及子宫内膜滋养层细胞的侵袭[26]。
与之相反的是,在黑素瘤中,侵袭性的黑素瘤与转移性的黑素瘤中初级纤毛表达几乎消失。且在结构不良痣组织中,恶性结构不良痣与良性结构不良痣相比,初级纤毛的表达量显著降低,也就是说初级纤毛与结构不良痣的恶性程度负相关。
3.自噬在初级纤毛促进肿瘤细胞侵袭中的作用:自噬作为细胞内降解的途径,通过与溶酶体的融合,清除异常的蛋白质及衰老受损的细胞器,维持机体内环境的稳定。已有大量研究证实,自噬在肿瘤的发生发展和侵袭转移中发挥重要作用,而初级纤毛又与自噬有着密切的联系[27]。
不同条件的自噬对初级纤毛的影响不同。营养充足情况下发生的基础自噬可降解IFT20,阻止初级纤毛持续生长[9]。而饥饿诱导的自噬则选择性降解纤毛生成抑制因子OFD1,从而明显促进初级纤毛生长[27-28]。上调自噬通路负调控因子mTOR 的活性抑制自噬,可明显降低初级纤毛的长度[3]。同时,饥饿诱导自噬小体的形成也依赖于初级纤毛的存在。Pampliega 等[27]发现,饥饿条件下,敲除或下调IFT88或IFT20的表达不仅使初级纤毛形成障碍,同时也抑制了饥饿诱导的自噬。
三、在皮肤肿瘤中的研究进展
1.初级纤毛与黑素瘤:Kim等[14]于2014年提出,初级纤毛可以作为黑素瘤的组织生物标记物,他们发现,在恶性黑素瘤细胞中初级纤毛的表达量较良性痣细胞明显下降。Lang 等[29]近期研究发现,在侵袭性黑素瘤与转移性黑素瘤中初级纤毛表达几乎消失,更重要的是,在19 例结构不良痣(dysplastic nevi)组织中,恶性结构不良痣与良性结构不良痣相比,初级纤毛的表达量显著降低,表明初级纤毛与结构不良痣恶性程度呈负相关,初级纤毛的结构与功能改变在黑素瘤发生和发展的过程起重要作用。
2.初级纤毛与基底细胞癌(BCC):BCC 的发生与表皮角质形成细胞中Hedgehog(Hh)途径的失调密切相关[30]。突变初级纤毛形成必须基因Kif3A 或Ift88 后会明显抑制Smoothened 通路所转录的 BCC,促进 Gli2 通路的激活[11]。Inturned(INTU)是一种纤毛和平面极性效应器(CPLANE),在皮肤组织纤毛形态与功能形成过程中发挥重要功能。Yang 等[31]发现,INTU 基因的表达在人类BCC 中异常升高,这与初级纤毛的增加和Hedgehog(Hh)信号通路的活化是一致的。在致癌突变Smo(SmoM2)驱动的BCC 小鼠模型中,敲低INTU 可以通过抑制初级纤毛形成和Hh 信号传导来阻止 BCC 的形成,表明 INTU 对 BCC 形成有促进作用[31]。进一步研究发现,INTU 是纤毛运输蛋白复合体IFT-A 的必备组合因子之一,并且INTU可以直接激活Gil2上游从而促进BCC发展。但过表达INTU并不促进初级纤毛与Hh信号通路传导[31]。以上结果提示,INTU可能通过调控初级纤毛的形成从而影响BCC的进展。
3.初级纤毛与鳞状细胞癌(鳞癌):以往研究显示,皮肤鳞癌与 Rab 家族成员小 GTP 酶之一的 Rab23 关系密切[32]。有报道显示,Rab23 能够引起鳞癌细胞Sa3细胞G1期阻滞,显著抑制Sa3细胞的增殖[33]。不仅如此,Rab23还可以通过调控Rac1 促进鳞癌侵袭[34]。众所周知,Rab23 主要功能是参与调控细胞膜及重要生物活性物质的囊泡转运,近期研究发现,Rab23-GTP形式的表达可增加细胞初级纤毛长度,而Rab23-GDP形式则抑制初级纤毛生成和长度[35-36]。进一步研究发现,Rab23 调控初级纤毛形成与转运动力蛋白KIF17密切相关。免疫共沉淀表明,Rab23与KIF17、核转运蛋白β2(importinβ2,一种 KIF17 纤毛转运载体)以复合体形式存在,敲除Rab23 后初级纤毛中则无KIF17,表明KIF17 需要与Rab23 等结合共同促进初级纤毛的生成[36]。这些结果高度提示,初级纤毛极有可能在Rab23 调控鳞癌细胞的增殖与侵袭中扮演重要角色。
四、结语
皮肤肿瘤的发生是一种极复杂的生物学现象,这种现象与很多因素有关,包括多条信号通路的共同作用以及细胞内外环境的改变。皮肤信号转导发生平台的异常可造成细胞异常增殖。现如今,初级纤毛结构功能的异常与多种皮肤肿瘤之间的关联得到广泛认同。随着人们对初级纤毛的深入了解,科学家们对于初级纤毛的结构及其功能,与信号转导途径及肿瘤发育发展的关系又有了新的认识。这些新的认识和发现对推动初级纤毛与皮肤肿瘤关系的进一步研究具有积极意义,并将为皮肤肿瘤的干预和治疗提供新的思路。
利益冲突所有作者均声明不存在利益冲突
