生物除草剂thaxtomin的生物合成研究进展
2023-12-26李岩鹏王兵沈峥徐冬梅王振杰
李岩鹏?王兵?沈峥?徐冬梅?王振杰
摘要:Thaxtomin是由疮痂链霉菌(Streptomyces scabies)、酸性疮痂链霉菌(Streptomyces acidiscabies)等植物病原菌产生的天然产物,具有新颖的化学结构和良好的除草活性,是美国环境保护局批准用作农田除草剂的主要活性物质,是一类非常有潜力的新一代生物除草剂。本文主要从thaxtomin结构特点、生物合成及调控机制、衍生物合成等方面,对其研究进展进行了综述,总结讨论了thaxtomin产量提高及衍生物合成的策略,并对thaxtomin的后续研究进行了探讨。
关键词:生物除草剂;thaxtomin;基因簇;生物合成;高产;thaxtomin衍生物
中图分类号:R9文献标志码:A
Research progresses on biosynthesis of the bioherbicide thaxtomin
Li Yanpeng, Wang Bing, Shen Zheng, Xu Dongmei, and Wang Zhenjie
(Hebei Vocational University of Industry Technology, Shijiazhuang 050091)
Abstract Thaxtomins are natural products produced by plant-pathogenic Streptomyces strains such as S. scabies and S. acidiscabies, which have novel chemical structures and excellent herbicidal activity, and have been developed as the main active component of a bioherbicide approved by the United States Environmental Protection Agency. Therefore, thaxtomins are the next-generation bioherbicide with great potential. In the paper, the research progresses of thaxtomins were reviewed from several aspects, including structure characteristics, biosynthesis, and regulatory mechanism. The strategies to increase thaxtomin yield and synthesize thaxtomin derivatives were summarized and discussed, and the subsequent researches on thaxtomins were also discussed.
Key words Bioherbicide; Thaxtomin; Gene cluster; Biosynthesis; High yield; Thaxtomin derivatives
雜草是农业生产的最主要威胁之一,据Phillips McDougall发布,中商产业研究院统计预测,2020年全球主要农药产品市场中除草剂、杀菌剂、杀虫剂占据了绝大部分份额,其中除草剂份额约为44.18%[1]。目前杂草防治主要依赖化学除草剂,然而随着草甘膦等化学除草剂的广泛使用,导致耐药性杂草产生,并且生态环境正受到威胁[2]。因此,开发高效环保的新型除草剂刻不容缓,而天然产物来源的除草剂由于其靶点的多样性及环境友好性越来越受到重视,是重要的开发方向。Thaxtomin是由酸性疮痂链霉菌等植物病原菌产生的哌嗪二酮类化合物,具有新颖的化学结构和作为除草剂的新型活性模式[3]。因为高效、低毒、低残留的优良特征,商品名为MBI-005的灭活酸性疮痂病链霉菌菌株被美国环境保护局(EPA)批准用于控制多种农作物杂草的生长,其主要成分是thaxtomin A, 具有很大的应用价值和市场潜力[4-5]。本文概述了thaxtomin类化合物的结构特点、作用机制、生物合成调控、高产策略及衍生物合成等方面的研究进展。同时,也对未来thaxtomin高产菌株的分子育种和新型类似物的开发和应用进行了探讨。
1 Thaxtomin化合物的结构与作用机制
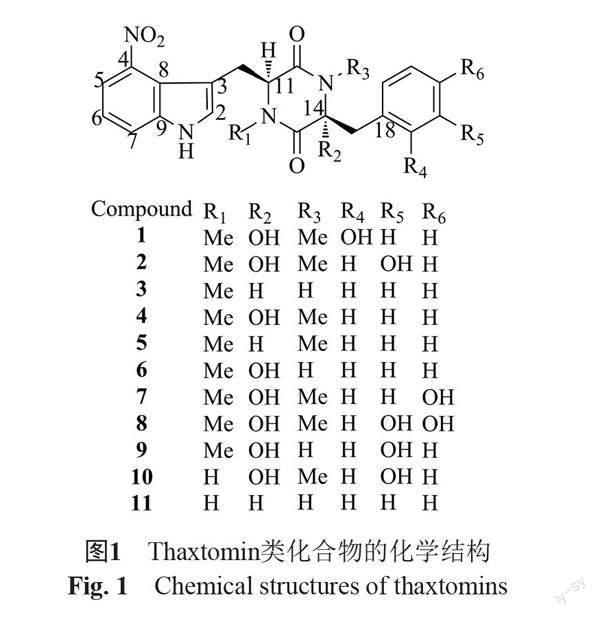
1989年,加拿大农业部马铃薯研究中心King等[6]研究人员首次从感染疮痂病的马铃薯块茎中分离并鉴定到thaxtomin A(1)和thaxtomin B(4)两种植物毒素(图1)。为了纪念美国著名植物病理学家Roland Thaxter (首次确定了马铃薯疮痂病的致病菌),研究者将该类化合物命名为“thaxtomin”。随后,该团队又陆续分离鉴定了thaxtomin C(3)等9种类似物[7-9]。Thaxtomin类化合物是由4-硝基色氨酸的α-羧基(α-氨基)和苯丙氨酸的α-氨基(α-羧基)相互脱水缩合,形成的含有2,5-二酮哌嗪结构的二肽。不同的thaxtomin类似物,其结构差异在于两个氨基酸的α-氨基氢是否被甲基取代,苯丙氨酸中C2氢及苯环上的3个氢是否被羟基取代[10](图1)。
其中,thaxtomin A是马铃薯疮痂病原菌产生的thaxtomin类似物中最主要的植物毒素,活性最高[10]。后续研究表明,thaxtomin化合物不仅会在马铃薯、胡萝卜等块根上引发疮痂病,还具有广泛的引起单/双子叶植物幼苗发病的能力[11]。当thaxtomin A浓度较低时(10~20 μmol/L),会引起植物细胞膨大,根和芽发育迟缓;而当thaxtomin A产量浓度较高时(50~
100 μmol/L),会抑制植物幼苗生长,造成组织坏死和幼苗死亡。2001年,King等[3]首次报道了thaxtomin作为除草剂的活性。通过植物生长抑制活性实验,研究者发现8种thaxtomin类化合物均表现出了一定的杂草生长抑制活性。其中,thaxtomin A对浮萍属和剪股颖属植物的GR50值有效剂量分别在12和5 ppb,抑制活性最为显著,强于包括乙酰乳酸酶在内的大多数已经商品化的除草剂;此外,thaxtomin A对拟南芥属和糠穗草也有抑制活性,ID50分别为10和25 ppb,也强于多数市售除草剂。同时,thaxtomin引起的症状与已知纤维素生物合成抑制剂,如双氯苯尼和异沙苯非常相似,皆为发育不良和根尖膨大等。2009年,Bischoff等[12]发现用thaxtomin A处理拟南芥幼苗后,植物细胞壁中的结晶纤维素减少,果胶和半纤维素含量增加。同时,细胞壁合成相关基因的表达情况也发生了改变。以上研究证明thaxtomin A能够影响植物纤维素合成,作用靶点为植物细胞壁,但是其具体作用机制仍不清楚。2013年,美国Marrone Bio Innovations (MBI)公司申请专利,证实thaxtomin可在有机水稻种植体系中有效的防治苋菜、芒稗和莎草等杂草[13]。此外,研究发现当一种或多种thaxtomin和一种或多种其他化学除草剂组合使用时,可提高杂草的控制效果,还能降低其他除草剂的用量[14]。2008年诺维信生物股份有限公司公布专利,公开书中表明使用thaxtomin还可以减少/消除水体中的藻类[15]。2015年,天津大学Zhang等[16]全化学合成了thaxtomin A及3种衍生物,并对其作为除草剂的生物活性进行了评价,结果显示thaxtomin A等4种类似物均对油菜、反枝苋和苘麻具有较好的抑制活性。其中,在低剂量下(187.5 g/ha),thaxtomin A活性与除草剂二氯硝基苯相当,甚至更强。此外,这4种化合物对不同作物均表现出良好的选择性,证明了其具有良好的安全性。
2 Thaxtomin 生物合成机制
2.1 Thaxtomin生物合成途径
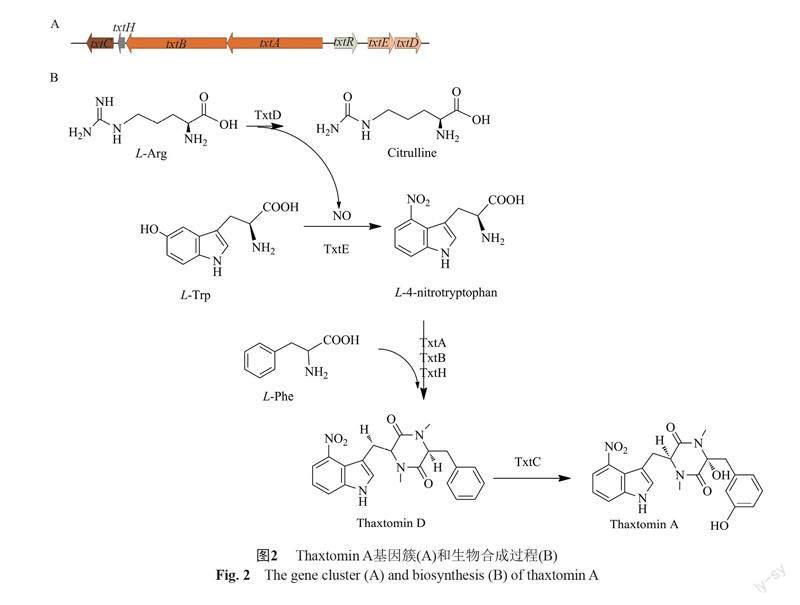
Thaxtomin 基因簇一般位于疮痂链霉菌(S. scabies)、肿痂链霉菌(S. turgidiscabies)等植物疮痂病病原菌基因组中的保守的“毒力岛” (pathogenicity island, PAI)[17]。以最主要且研究最完善的代谢产物thaxtomin A为例,其基因簇长约18 kb,包含7个基因(txtR、txtA、txtB、txtE、txtD、txtC和txtH) (图2A)。其中txtR编码thaxtomin A生物合成途径中的正调控因子[18],txtA和txtB编码NRPS合成酶[19],txtE 和txtC 编码细胞色素P450蛋白[20-21],研究发现txtC属于一个双功能细胞色素P450蛋白,能够在两个不同的位置对双酮丙哌嗪底物thaxtomin D进行连续的脂肪族和芳香羟基化,生成thaxtomin A[22]。研究表明,txtH编码蛋白属于MbtH-like protein(MLP)家族,该类蛋白通常与NRPS酶行使正常功能相关,可促进NRPS合成酶的溶解和腺苷化,而缺失txtH基因会显著降低thaxtomin A的产生[23]。最近的研究发现来自不同细菌的非同源MbtH蛋白作为分子伴侣促进NRPS合成酶TxtA和TxtB的可溶性和腺苷化,这种活性依赖于蛋白结构中保守的氨基酸而非相似性。同时,不同来源的MLP蛋白能够互补内源性TxtH编码基因缺失菌株中thaxtomin A的生物合成[24]。
Thaxtomin A的生物合成包括多个步骤(图2B):首先是L-4-硝基色氨酸底物的合成,其中TxtD催化精氨酸发生氧化反应生成一氧化氮(NO)和瓜氨酸[25]。其次,TxtE再催化生成的NO和色氨酸反应生成L-4-硝基色氨酸[21]。再次,NRPS合成酶TxtA和TxtB以苯丙氨酸和4-硝基色氨酸为前体,合成2,5-二酮哌嗪化合物thaxtomin D[19]。最后,细胞色素P450酶TxtC催化thaxtomin D完成后修饰,获得终产物thaxtomin A [26-27]。
2.2 Thaxtomin生物合成调控
与其他链霉菌来源抗生素一样,thaxtomin的生物合成受到了包括途径特异性调控和多效调控等多层次复杂而严谨的调控。Thaxtomin A基因簇中含有一个途径特异性调控基因txtR,位于txtE和txtA基因之間。TxtR调控蛋白属于AraC/XylS家族成员,其C端是具有AraC/XylS信号特征的DNA结合结构域,N端是配体结合结构域。该蛋白通过作用于txtA和txtE的启动子区调控thaxtomin的生物合成。当失活txtR基因后,txtA、txtB以及txtC基因的转录水平显著降低,thaxtomin A不再合成,而过表达txtR则大幅度提高了thaxtomin A的产量,结果表明TxtR在thaxtomin 生物合成过程中发挥着正调控作用。同时,研究发现纤维二糖可以通过和TxtR结合提高txtR和其他thaxtomin合成相关基因的转录水平,从而激活thaxtomin的生物合成[18]。另外,S. scabiei中还存在一个thaxtomin生物合成的负调控基因cebR,其编码蛋白可与thaxtomin基因簇中两个位点结合,从而抑制基因的转录。其中,一个位点位于的txtR的上游,另一个位点位于txtAB基因内。纤维二糖(cellobiose)或者纤维三糖(cellotriose)作为诱导物,可与CebR蛋白结合,使其从基因簇上解离来启动thaxtomin基因簇的转录;cebR基因的敲除失活会解除thaxtomin A的反馈抑制作用,同时导致thaxtomin A的过量产生[28]。除此以外,在S. scabiei中thaxtomin A的生物合成至少还受到5个bld家族全局调控因子的调控。比如,研究发现敲除失活bldA,bldC,bldD,bldG和bldH/adpA 会导致thaxtomin A的合成降低或丧失。其中,4种突变株中txtR的转录表达大幅降低,所有的突变株均表现出已知或预测的thaxtomin表达的降低。以上研究均表明,在S. scabies中thaxtomin的生物合成受到bld 基因编码产物的全局调控[29],而thaxtomin的生物合成是受到了复杂而精密的调控。
3 Thaxtomin衍生物的生物合成
3.1 前体导向的thaxtomin衍生物合成
底物的宽泛性影响了终产物结构的多样性。在thaxtomin的生物合成过程中,底物如L-色氨酸,L-精氨酸,L-苯丙氨酸以及L-4-硝基色氨酸,分别接受TxtD、TxtE、TxtA和TxtB的催化,最终合成thaxtomin产物。因此,可通过寻找宽泛性的酶基因,通过合成生物学手段来达到提高终产物的多样性的目的。
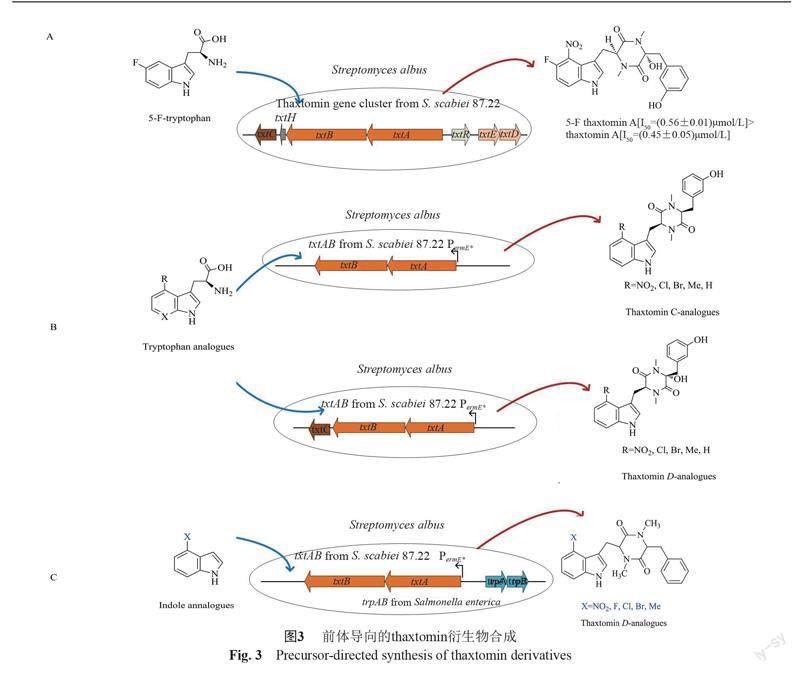
Thaxtomin基因簇中txtE编码蛋白对色氨酸外的底物选择具有高度的灵活性[30-31],NRPS合成酶TxtAB对带有不同取代基的苯丙氨酸和色氨酸类似物具有一定的底物容忍性,Jiang等[32]通过在thaxtomin产生菌的发酵培养基中加入5-氟-L-色氨酸产生了1种新的衍生物5-F-thaxtomin A,除草剂活性显示其半数抑制剂量[I50为(0.56±0.01) ?mol/L],稍差于thaxtomin A [I50=(0.45±0.05) ?mol/L](图3A)。Winn等[38]将一系列在C4位带有F、Cl、Br等集团的色氨酸类似物添加到含有txtAB表达基因的白色链霉菌发酵培养基中,导致菌体产生了多种thaxtomin D 类似物(图3B)。类似地,他们把以上色氨酸类似物添加到含有txtABC表达基因的白色链霉菌发酵培养基中,菌体产生了多种羟基化的thaxtomin A类似物。前期研究表明,在鼠伤寒沙门菌(ATCC37845)中色氨酸合酶能催化一系列的吲哚衍生物为底物与L-丝氨酸缩合,生成各种色氨酸衍生物[33-37]。进一步地,Winn等[38]将来源于沙门氏菌的色氨酸合酶trpS基因与NRPS基因txtA和txtB进行组装,加入强启动子,在白色链霉菌宿主中进行异源表达,最终获得了一系列以吲哚衍生物为前体的thaxtomin D衍生物(图3C)。但遗憾的是,他们并未对以上这些thaxtomin衍生物进行活性测试。
3.2 一锅法体外生物合成thaxtomin衍生物
Jiang等[39]研究了TxtE和TxtC的催化结构,通过添加不同长度的氨基酸接头,重构并验证了不同嵌合体酶的催化效果,確定了带有14个氨基酸接头的嵌合体是芳香族硝化生物最佳催化剂。通过将TxtE和TxtC改造后的最佳的嵌合体酶TB14和TCB14与TxtA、TxtB按照一定的顺序在体外条件下进行生物合成反应,首先获得了中间体thaxtomin D,然后进一步获得thaxtomin A。通过将4种酶体外混合,利用其对底物的宽泛性,加入多种简单的氨基酸底物,合成了124个thaxtomin类似物(图4)。选取其中5个类似物(21Me-Thx A、21Me-Thx D、desnitro-4-Me-Thx D、6F-20F-Thx D和 21N3-Thx D)以及thaxtomin A进行除草剂活性测试,结果发现仅有21Me-Thx A活性与thaxtomin A相当[(0.41±0.01) ?mol/L vs (0.39±0.03) ?mol/L],其他几个活性均弱于thaxtomin A。
3.3 基于NRPS合成酶及后修饰酶改造的衍生物合成
通过改造生物合成过程中的关键性修饰酶和合成酶基因,可有目的性的获得特定的thaxtomin衍生物。山东大学周甜甜等[40]通过敲除thaxtomin基因簇中的TxtC编码基因,接着定点失活TxtA或/和TxtB酶编码基因中与甲基转移酶结构域相关活性位点,获得了高活性代谢产物thaxtomin C、des-N-methythaxtomin C和des-N-methythaxtomin D衍生物。其中,点突变txtA的重组菌,相较于未修饰的异源表达菌,thaxtomin C的产量提高了30%。点突变txtB基因获得了des-N-methylthaxtomin C和des-N-methythaxtomin D(图5A),而同时点突变txtA和txtB 获得了des-N-methylthaxtomin C(图5B)。
总结来看,尽管通过多种生物合成方法产生了结构多样的thaxtomin衍生物,但大部分新结构的除草剂活性未经测试。测试的几个活性衍生物中,还未发现比天然thaxtomin活性更优的化合物。后续研究不仅需要加大新结构的活性测试工作外,还需拓展合成生物学改造尺度,以获得活性更好的衍生物。
4 Thaxtomin 高产优化策略
目前,已知thaxtomin的产生菌主要有4种,分别是疮痂链霉菌(S. scabies)、酸性疮痂链霉菌(S. acidiscabies)、番薯链霉菌(S. ipomoea)以及肿痂链霉菌(S. turgidiscabies)。尽管美国EPA已经批准MBI公司生物除草剂MBI-005(灭活的酸性疮痂链霉菌RL110菌)的使用,但较低的发酵单位极大的限制了该品种的产业化。基于合成生物学技术的快速发展及thaxtomin生物合成和调控机制研究的深入,科学家通过对产生菌及thaxtomin生物合成基因簇进行遗传操作来提高thaxtomin的发酵产量。
4.1 基于途径特异性调控机制的原产菌中产量提高策略
Francis等[28]研究者以S. scabies 97.22为出发菌,通过敲除thaxtomin合成的负调控基因cebR,获得了比野生菌产量高6倍左右的thaxtomin A突变株。
4.2 基于简单的异源表达的产量提高策略
将天然产物生物合成基因簇在遗传背景清晰的模式宿主中进行异源表达成为提高产物产量的一种有效手段。Jiang等[32]将来源于两种疮痂病原菌的“毒力岛” PAI(大小分别为177和674 kb)转移到天蓝色链霉菌、变铅青链霉菌和阿维链霉菌等常用的5种链霉菌异源宿主中,通过发酵培养及分离纯化,成功获得了thaxtomin类化合物。其中,在白色链霉菌中异源表达的thaxtomin类化合物产量最高。但“毒力岛”PAI异源表达可能在宿主中存在遗传不稳定性,从而导致改造的菌株不稳定[5]。因此,Jiang等[32]进一步应用TAR(transformation-associated recombination)的方法克隆了疮痂链链霉菌thaxtomin A的生物合成基因簇,并将它转化至白色链霉菌J1074中异源表达,通过发酵培养优化将菌株中thaxtomin A的发酵产量提高到原产菌的20倍以上,约~170 mg/L。
4.3 基于合成生物学和代谢工程的产量提高策略
Li等[41]利用PCR和Gibson连接的方法,将来源于酸疮链霉菌的thaxtomin A基因簇克隆到pSET152载体上,通过接合转移整合至中微白黄链霉菌等宿主基因组。后期通过采用组合代谢工程策略,将敲除负调控基因cebR或者高表达正调控基因txtR等手段组合起来对菌株进行遗传改造。通过对重组菌进行发酵工艺优化,在摇瓶水平上,将thaxtomin类似物的产量提升至728 mg/L,在5 L小型发酵罐水平上,提升至1973 mg/L。其中,thaxtomin A产量约为424 mg/L。
山东大学周甜甜等[40]通过ExoCET技术直接克隆了thaxtomin生物合成基因簇,并在白色链霉菌中成功获得thaxtomin A和thaxtomin C产物。进一步用kasOp*-57p双向组成型强启动子替换掉调控基因txtR,利用kasOp*启动子表达txtDE,57p表达txtABHC。将改造后的基因簇转入宿主后,thaxtomin A产量提升了12%,thaxtomin C提升了40%。
Zhao等[43]利用基因簇直接克隆的方法(CATCH),首先克隆获得thaxtomin A基因簇,然后将其接合转移至3种常用异源宿主(天蓝色链霉菌、白色链霉菌和委内瑞拉链霉菌),也成功实现了thaxtomin A的异源表达。与其他团队研究结果不同,该基因簇在天蓝色链霉菌中获得了最高的产量,其次是白色链霉菌,而在委内瑞拉链霉菌中该基因簇为沉默状态。应用基于CRISPR/Cas9和酿酒酵母的同源重组系统将基因簇中txtE、txtA和txtC启动子替换为kasOp*系列组成型强启动子,thaxtomin A的产量较野生基因簇有了大幅度提高。通过进一步组合使用不同强度的启动子,获得了多株thaxtomin A产量更高产的菌,实验室摇瓶产量最高达到501 mg/L。另外,Zhao等[44]开发了以σECF17因子为基础的链霉菌正交转录系统,通过基因簇重构的方式,获得了ECF17启动子控制的thaxtomin A生物合成基因簇,將重构的基因簇重新在白色链霉菌中表达,产量达到239 mg/L,比野生型提高了10倍以上。
总体来讲,以上的研究不仅涉及到提高次级代谢产物表达的常用策略,比如过表达正调控基因txtR,敲除负调控基因cebR。同时,也应用到了先进的基因簇克隆及编辑技术,比如基因簇的直接克隆(CATCH、TAR、ExoCET),对基因簇多个基因启动子的同时改造等,这使得针对thaxtomin基因簇的改造更加高效。另外,新型ECF17诱导表达系统等高效调控元件的应用也可大幅提高thaxtomin的产量。然而,目前对thaxtomin高产策略主要还是体现在对其基因簇转录层面的调控。但事实上,除了转录层次外,目标产物的高产还应涉及到其他层次的调控,比如翻译水平调控等,后续研究可组合优化多种层次各因素来进一步提高thaxtomin产量。
5 总结与展望
当前,草甘膦等化学除草剂的广泛使用对生态环境造成了严重的破坏,并且导致了耐药性杂草的产生,研发新型、低毒、低残留的绿色农药对于促进我国农药产品结构的优化调整,发展绿色环保农业有着重要的意义。
Thaxtomin来源于微生物,与环境相容性好,易降解,具有很好的安全性,不仅可用于田间作物,还可以应用于有机农业。Thaxtomin的作用机制是抑制杂草细胞壁纤维素的合成,作用靶点独特,是新型安全高效除草剂开发中最有潜力的方向。此外,研究发现thaxtomin与其他化学除草剂联用可降低化学除草剂的用量,间接降低对环境的污染[14]。而Thaxtomin产生菌发酵液经灭活后可直接用做田间除草剂,制备工艺简单易行。但是,自从2012年美国环境保护局批准其用作农田除草剂以来,因为菌株发酵单位低,生产成本大,未能大规模上市。而化学合成thaxtomin除了总产率较低之外,还会产生有毒废物和较多的副产物,也不适合工业化生产。因此,基于thaxtomin生物合成和调控机制的组合代谢工程改造策略,优化工程菌株,提升thaxtomin发酵单位,是当前主要的研究方向。另外,尽管产生了多种thaxtomin衍生物,但是大部分衍生物的活性还未经测定与比较,后续的生物活性验证还需进一步加强。
随着合成生物学、比较基因组学、代谢组学等新技术的应用,对菌株的遗传改造越发有针对性,后续工作可以从几个方面开展来提高thaxtomin及其高活性衍生物的产量:①对底盘菌进行深度改造,提高宿主和基因簇的适配性。比如提高thaxtomin合成前体和辅因子的供应、优化调控网络等;L-色氨酸、L-苯丙氨酸和L-精氨酸是thaxtomin生物合成的前体,通过对链霉菌初级代谢途径进行全面分析,在此基础上增强L-色氨酸、L-苯丙氨酸和L-精氨酸代谢途径中限速酶和关键合成酶表达水平,敲除竞争途径关键酶基因等策略提高前体的供应。S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)作为甲基供体参与thaxtomin的生物合成,S-腺苷甲硫氨酸合成酶基因(MetK)可以合成SAM,后续可以通过过量表达MetK编码基因提高菌体thaxtomin的产量。②链霉菌存在发酵周期过长,遗传改造难,发酵工艺复杂等问题,因此尝试在芽胞杆菌、大肠埃希菌、假单胞菌等链霉菌以外的,能够快速生长,调控元件丰富,易于遗传改造的宿主中优化表达,也可能有利于thaxtomin的高效合成;③理性化改造生物合成途径,调控中间代谢产物的合成水平,避免支路浪费,以提高代谢流向终产物thaxtomin A的合成方向。Jiang等[32]、周甜甜等[40]和Li等[41]研究也都表明除了thaxtomin A外,还产生了thaxtomin C、thaxtomin D、N-乙酰基-4-硝基色氨酸等其他产物。因此,后续可以针对代谢途径各基因表达量进行精确控制,提高终产物thaxtomin A产量。(4) 优化菌株发酵工艺,提高thaxtomin工业生产水平。比如,外源补充L-色氨酸和L-苯丙氨酸等前体物质;通过响应面等方法优化发酵配方,对接种量、补碳、pH等条件进行摸索,采取流加底物等原料补充策略进一步优化发酵工艺。
参 考 文 献
中商产业研究院. 2022年全球农药行业市场现状及发展趋势预测分析(图)[EB/OL]. [2022-08-09 10:17]. https://www.askci. com/news/chanye/20220809/1017001948618. shtml.
周文冠, 孟永杰, 陈锋, 等. 除草剂研发及其复混使用的现状与展望[J]. 草业科学, 2018, 12(1): 93-105.
King R R, Lawrence C H, Gray J A. Herbicidal properties of the thaxtomin group of phytotoxins[J]. J Agr Food Chem, 2001, 49(5): 2298-2301.
Koivunen M, Marrone P. Uses of thaxtomin and thaxtomin compositions as herbicides: USA, US8, 822, 381[P]. 2013-10-31.
Zhang Y C, Jiang G D, Ding Y S, et al. Genetic background affects pathogenicity island function and pathogen emergence in Streptomyces[J]. Mol Plant Pathol, 2018, 19(7): 1733-1741.
King R R, Lawrence C H, Clark M C, et al. Isolation and characterization of phytotoxins associated with Streptomyces scabies[J]. J Chem Soc Chem Comm, 1989, 13: 849-850.
King R R, Lawrence C H, Calhoun L A. Chemistry of phytotoxins associated with Streptomyces scabies, the causal organism of potato common scab[J]. J Agr Food Chem, 1992, 40(5): 834-837.
King R R, Lawrence C H, Calhoun L A, et al. Isolation and characterization of thaxtomin-type phytotoxins associated with Streptomyces ipomoeae[J]. J Agr Food Chem, 1994, 42(8): 1791-1794.
King R R, Lawrence C H, Calhoun L A. Isolation and identification of pigments generated in vitro by Streptomyces acidiscabies[J]. J Agr Food Chem, 1996, 44(9): 2849-2851.
King R R, Calhoun L A. The thaxtomin phytotoxins: sources, synthesis, biosynthesis, biotransformation and biological activity[J]. Phytochemistry, 2009, 70(7): 833-841.
Leiner R H, Fry B A, Carling D E, et al. Probable involvement of thaxtomin A in pathogenicity of Streptomyces scabies on seedlings[J]. Phytopathology, 1996, 86(7): 709-713.
Bischoff V, Cookson S J, Wu S, et al. Thaxtomin A affects CESA-complex density, expression of cell wall genes, cell wall composition, and causes ectopic lignification in arabidopsis thaliana seedlings[J]. J Exp Bot, 2009, 60(3): 955-965.
Daniel C L, Lisa D, Rosa I, et al. Use of thaxtomin for selective control of rice and aquatic based weeds: USA, US.2010/0267560 [P]. 2010-10-15.
S·英曼, S·西蒙斯. 用Thaxtomin和組合有益除草剂的Thaxtomin组合物控制杂草的方法: CN, 201280064642.7 [P]. 2012-10-21.
康耀卫, 肖恩·西蒙斯, 乔纳森·莱德,等. 使用Thaxtomin与Thaxtomin组合物控制藻类的方法: CN, 101677561A [P]. 2008-4-7.
Zhang H, Wang Q, Ning X, et al. Synthesis and biological evaluations of a series of thaxtomin analogues[J]. J Agric Food Chem, 2015, 63(14): 3734-3741.
Kers J A, Cameron K D, Joshi M V, et al. A large, mobile pathogenicity island confers plant pathogenicity on Streptomyces species[J]. Mol Microbiol, 2005, 55(4): 1025-1033.
Joshi M V, Bignell D R D, Johnson E G, et al. The AraC/XylS regulator TxtR modulates thaxtomin biosynthesis and virulence in Streptomyces scabies[J]. Mol Microbiol, 2007, 66(3): 633-642.
Healy F G, Wach M, Krasnoff S B, et al. The txtAB genes of the plant pathogen Streptomyces acidiscabies encode a peptide synthetase required for phytotoxin thaxtomin A production and pathogenicity[J]. Mol Microbiol, 2000, 38(4): 794-804.
Healy F G, Krasnoff S B, Wach M, et al. Involvement of a cytochrome P450 monooxygenase in thaxtomin A biosynthesis by Streptomyces acidiscabies[J]. J Bacteriol, 2002, 184(7): 2019-2029.
Yuan C, Ouyang Q W, Wang X X, et al. Interactive regulation between aliphatic hydroxylation and aromatic hydroxylation of thaxtomin D in TxtC: A theoretical investigation[J]. Inorg Chem, 2021, 60(9): 6433-6445.
Barry S M, Kers J A, Johnson E G, et al. Cytochrome P450-catalyzed L-tryptophan nitration in thaxtomin phytotoxin biosynthesis[J]. Nat Chem Biol, 2012, 8(10): 814-816.
Li Y T, Liu J Y, Adekunle D, et al. TxtH is a key component of the thaxtomin biosynthetic machinery in the potato common scab pathogen Streptomyces scabies[J]. Mol Plant Pathol, 2019, 20(10): 1379-1393.
Li Y T, Tahlan K, Bignell, R D. Functional cross-talk of MbtH-like proteins during thaxtomin biosynthesis in the potato common scab pathogen Streptomyces scabiei[J]. Front Microbiol, 2020, 11: 585456 - 585456.
Kers J A, Wach M J, Krasnoff S B, et al. Nitration of a peptide phytotoxin by bacterial nitric oxide synthase[J]. Nature, 2004, 429(6987): 79-82.
Alkhalaf L M, Barry S M, Rea D, et al. Binding of distinct substrate conformations enables hydroxylation of remote sites in thaxtomin D by cytochrome P450 TxtC[J]. J Am Chem Soc, 2019, 141(1): 216-222.
Jiang G D, Zhang Y, Powell M M, et al. A promiscuous cytochrome P450 hydroxylates aliphatic and aromatic C-H bonds of aromatic 2,5-diketopiperazines[J]. Chembiochem, 2019, 20(8): 1068-1077.
Francis I M, Jourdan S, Fanara S, et al. The cellobiose sensor CebR is the gatekeeper of Streptomyces scabies pathogenicity[J]. Mbio, 2015, 6(2): e02018.
Bignell D R D, Francis I M, Fyans J K, et al. Thaxtomin A production and virulence are controlled by several bld gene global regulators in Streptomyces scabies[J]. Mol Plant Microbe In, 2014, 27(8): 875-885.
Zuo R, Zhang Y, Huguet-Tapia J C, et al. An artificial self-sufficient cytochrome P450 directly nitrates fluorinated tryptophan analogs with a different regio-selectivity[J]. Biotechnol J, 2016, 11(5): 624-632.
Zuo R, Zhang Y, Jiang C, et al. Engineered P450 biocatalysts show improved activity and regio-promiscuity in aromatic nitration[J]. Sci Rep, 2017, 7(1): 842-851.
Jiang G D, Zhang Y C, Powell M M, et al. High-yield production of herbicidal thaxtomins and thaxtomin analogs in a nonpathogenic Streptomyces strain[J]. Appl Environ Microb, 2018a, 84 (11): e00164-18.
Herger M, Roye P V, Romney D K, et al. Synthesis of β-branched tryptophan analogues using an engineered subunit of tryptophan synthase[J]. J Am Chem Soc, 2016, 138(27): 8388-8391.
Romney D K, Murciano-Calles J, Wehrmüller, Jri E, et al. Unlocking reactivity of TrpB: A general biocatalytic platform for synthesis of tryptophan analogs[J]. J Am Chem Soc, 2017, 139(31): 10769-10776.
Buller A R, Brinkmann-Chen S, Romney D K, et al. Directed evolution of the tryptophan synthase β-subunit for stand-alone function recapitulates allosteric activation[J]. P Natl Acad Sci USA, 2015, 112(47): 14599-14604.
Gross R, Newill P. A convenient enzymatic synthesis of L-halotryptophans[J]. Chem Commun, 2006, 38(47): 4924-4925.
Winn M, Roy A D, Grüschow S, et al. A convenient one-step synthesis of 1-aminotryptophans and improved synthesis of 5-fluorotryptophan[J]. Bioorg Med Chem Lett, 2008, 18(16): 4508-4510.
Winn M, Francis D, Micklefield J. De novo biosynthesis of "Non-Natural" thaxtomin phytotoxins[J]. Angew Chem Int Edit, 2018, 57(23): 6830-6833.
Jiang G D, Zuo R, Zhang Y, et al. One-Pot biocombinatorial synthesis of herbicidal thaxtomins[J]. Acs Catal, 2018, 40(8): 10761-10768.
周甜甜. 高活性Thaxtomin衍生物的异源高效合成[D]. 青岛: 山东大学, 2021.
Li Z L, Huang P J, Wang M Y, et al. Stepwise increase of thaxtomins production in Streptomyces albidoflavus J1074 through combinatorial metabolic engineering[J]. Metab Eng, 2021, 68: 187-198.
Jiang W J, Zhao X J, Gabrieli T, et al. Cas9-assisted targeting of chromosome segments CATCH enables one-step targeted cloning of large gene clusters[J]. Nat Commun, 2015, 6: 8101.
Zhao X J, Zong Y Q, Wei W J, et al. Multiplexed promoter engineering for improving thaxtomin A production in heterologous Streptomyces hosts[J]. Lif Basel, 2022, 12(5): 689-701.
Zhao X J, Wei W J, Zong Y Q, et al. Novel switchable ECF sigma factor transcription system for improving thaxtomin A production in Streptomyces[J]. Syn Syst Biotechno, 2022, 7(3): 972-981.
收稿日期:2022-10-01
基金項目:河北工业职业技术大学博士基金资助项目(No. bz202203);河北省教育厅高等学校自然科学研究重点项目(No. ZD2022084)
作者简介:李岩鹏,生于1981年,硕士,讲师,研究方向为药品生产技术,E-mail: 714138074@qq.com
*通信作者,E-mail: wangzhenjie@sina.com
