自噬调控对小鼠精原细胞缺氧/复氧损伤的影响研究*
2023-12-26陈一衍
胡 志,付 桥,张 炜,孙 伟,徐 律,陈一衍,褚 浩
(武汉市第三医院泌尿外科,武汉 430000)
睾丸缺血再灌注损伤(ischemia reperfusion injury,IRI)被认为是睾丸扭转和退扭的潜在机制,睾丸缺血因为有氧代谢受损会导致炎症细胞因子的产生和细胞死亡,睾丸再灌注后由于活性氧(ROS)的产生和局部毛细血管功能障碍,组织进一步损伤,诱导DNA损伤,使精子发生永久性损伤[1-2]。但目前临床上还没有缓解睾丸IRI的有效药物。
研究发现,自噬在多种组织器官的IRI过程中具有保护作用,自噬受损会增加再灌注期间细胞的损伤[3]。自噬是溶酶体分解代谢过程,能消除老化的细胞器和大分子蛋白,为细胞器更新和细胞修复提供原料和营养[4]。自噬受缺氧、渗透性和活性氧等因素影响,在维持细胞稳态中起关键作用[5]。自噬是IRI的关键调节因子,不仅可用于抑制大鼠肾小管凋亡和减轻肾IRI期间的肾功能损害,还具有神经保护作用,能够减轻心肌IRI[6-7]。在适度范围内增强自噬活性也许能补偿线粒体损伤,并有助于IRI中的蛋白平衡,恢复受损的自噬通量可能是缓解IRI的有效途径[8]。因此,为了探究自噬在睾丸组织的IRI过程中扮演的角色,本研究构建小鼠精原细胞缺氧/复氧损伤(hypoxia reoxygenation injury,H/RI)模型,模拟睾丸组织的IRI阶段,从多方面观察自噬对大鼠睾丸组织IRI的调控作用。
1 材料与方法
1.1 材料
小鼠精原细胞GC-1 spg购自赛百慷(上海)生物技术股份有限公司,胰蛋白酶、噻唑蓝(MTT)、dNTP Mix和BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,自噬激动剂RAPA和自噬抑制剂3-MA购自美国MCE公司,活性氧检测试剂盒购自上海碧云天生物技术有限公司,硫氰酸荧光素标记的钙离子依赖磷脂结合蛋白/碘化丙啶(AnnexinⅤ-FITC/PI)凋亡检测试剂盒购自美国BD公司,兔抗LC3-Ⅰ、LC3-Ⅱ、Beclin1、p62、Bcl-2、Bax和GAPDH购自武汉贝茵莱生物科技,兔抗caspase-3购自德国CST公司。
1.2 仪器
311型CO2恒温培养箱购自美国Thermo公司,DMIL LED倒置荧光显微镜购自德国Leica公司,Forma-8000三气培养箱购自美国Thermo Fisher Scientific公司,AMR-100酶标仪、Nano-300超微量分光光度计购自杭州奥盛仪器有限公司,NovoCyte流式细胞仪购自美国Acea公司,Tanon-5200全自动化学发光分析仪购自上海天能生命科学有限公司,GE48527型PCR仪购自杭州柏恒科技有限公司,CFX-Connect 96荧光定量PCR仪购自美国Bio-Rad公司。
1.3 方法
1.3.1细胞培养与传代
将融化后的细胞悬液400×g离心3 min,弃上清液后重悬,在37 ℃、5% CO2的培养箱内培养。倒置显微镜下观察细胞形态。打开T25培养瓶,瓶口过火,丢弃培养瓶内的培养液,用PBS洗去残留。培养瓶加入0.25%胰酶,37 ℃消化,用倒置显微镜进行观察,细胞收回突起变圆时立即翻转培养瓶,倒掉与细胞脱离的胰酶,加入培养基润洗,使细胞脱壁并分散,制成细胞悬液,分装。
1.3.2细胞模型构建
将完成传代的细胞分为4组:对照组、模型组、自噬激动剂干预组和自噬抑制剂干预组。收集细胞,调整细胞悬液浓度为5×105/孔。对照组细胞置于37 ℃、5% CO2培养箱中正常培养24 h。模型组细胞按照文献[9],用预先缺氧的无血清培养基在5% CO2、1% O2和94% N2的三气培养箱培养24 h,构建H/RI模型。自噬激动剂干预组在模型构建成功后,将细胞移至常氧培养箱复氧2 h后,添加50 nmol/L的自噬激动剂RAPA常规孵育12 h。自噬抑制剂干预组在细胞复氧2 h后,添加5 mmol/L的自噬抑制剂3-MA常规孵育12 h。
1.3.3MTT检测各组细胞增殖活力
调整细胞悬液浓度为3×103/孔,在37 ℃、5% CO2培养箱中培养过夜,使细胞贴壁。按照1.3.2不同分组处理细胞,培养24 h后加入10 μL MTT 溶液(5 mg/mL),继续培养4 h。然后弃去上清液,加入二甲基亚砜(DMSO)溶解液充分溶解结晶物。用分光光度计测量各孔的吸光度(A)值。
1.3.4流式细胞术检测各组细胞ROS水平
收集各组细胞悬浮于10 μmol/L的活性氧荧光探针(DCFH-DA)中,浓度为1×106/mL,37 ℃、5% CO2细胞培养箱内孵育20 min。DCFH-DA和细胞充分接触后,用无血清细胞培养液洗涤细胞3次,去除未进入细胞内的DCFH-DA。用PBS重悬细胞,用流式细胞仪检测ROS。
1.3.5流式细胞术检测各组细胞凋亡水平
收集各组细胞,重悬使细胞浓度为1×106/孔,400×g离心5 min,弃上清液,重悬于200 μL PBS。加入10 μL Annexin Ⅴ-FITC和10 μL PI,4 ℃避光孵育30 min;加入300 μL PBS,进行流式检测。
1.3.6实时荧光定量PCR(qPCR)检测细胞中自噬和凋亡相关基因表达水平
取细胞约1×106个,加1 mL TRIzol提取总RNA。逆转录合成cDNA。将合成的cDNA进行PCR扩增。PCR反应条件为:95 ℃预变性3 min;95 ℃变性5 s,56 ℃退火10 s,72 ℃延伸25 s,共40个循环。其中GAPDH作为内参进行样品间的校正,使用2-ΔΔCt法计算各基因mRNA表达水平,各目标基因引物见表1。

表1 引物序列
1.3.7Western blot法检测自噬和凋亡相关蛋白表达水平
取各组细胞加入细胞裂解液,用蛋白提取试剂盒提取总蛋白,并用BCA法检测蛋白浓度。取20 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转移至聚偏氟乙烯(PVDF)膜上。4 ℃封闭过夜,分别加入兔抗Beclin1、Bax、caspase-3、LC3-Ⅱ、LC3-Ⅰ、p62、Bcl-2和GAPDH单克隆抗体(1∶1 000),室温孵育1 h。加入二抗,室温孵育1 h。洗膜后加入化学发光试剂显色,读取条带灰度值。
1.4 统计学处理
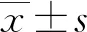
2 结 果
2.1 MTT法检测各组细胞增殖能力
与对照组比较,模型组小鼠精原细胞增殖能力明显下降(P<0.01),自噬激动剂干预组小鼠精原细胞增殖能力较模型组明显提高(P<0.01),自噬抑制剂干预组小鼠精原细胞增殖能力较模型组明显降低(P<0.01),见图1。

1:对照组;2:模型组;3:自噬激动剂干预组;4:自噬抑制剂干预组;a:P<0.01,与对照组比较;b:P<0.01,与模型组比较。
2.2 流式细胞术检测各组细胞ROS水平
与对照组比较,模型组小鼠精原细胞ROS水平明显升高(P<0.01);与模型组比较,自噬激动剂干预组小鼠精原细胞ROS水平明显降低(P<0.01),自噬抑制剂干预组小鼠精原细胞ROS水平明显升高(P<0.01),见图2。

A:流式细胞图;B:定量分析图;1:对照组;2:模型组;3:自噬激动剂干预组;4:自噬抑制剂干预组;a:P<0.01,与对照组比较;b:P<0.01,与模型组比较。
2.3 流式细胞术检测各组细胞凋亡率
与对照组比较,H/RI模型组细胞凋亡率明显增加(P<0.01);与模型组比较,自噬激动剂干预组的细胞凋亡率明显降低(P<0.01),而自噬抑制剂干预组细胞凋亡率则明显升高(P<0.01),见图3。

A:流式细胞图;B:定量分析图;1:对照组;2:模型组;3:自噬激动剂干预组;4:自噬抑制剂干预组;a:P<0.01,与对照组比较;b:P<0.01,与模型组比较。
2.4 qPCR检测各组细胞中Beclin1、Bax、Bcl-2的mRNA表达水平
与对照组比较,模型组小鼠精原细胞中Beclin1和Bcl-2 mRNA表达水平明显下降,Bax mRNA表达水平明显上升(均P<0.01);与模型组比较,自噬激动剂干预组小鼠精原细胞中Beclin1和Bcl-2 mRNA表达水平明显上升(P<0.01),Bax mRNA表达水平明显下降(P<0.01);与模型组比较,自噬抑制剂干预组小鼠精原细胞中Beclin1和Bcl-2 mRNA表达水平明显下降(P<0.01),Bax mRNA表达水平明显升高(P<0.01),见图4。

a:P<0.01,与对照组比较;b:P<0.01,与模型组比较。
2.5 Western blot检测各组细胞自噬相关蛋白和凋亡相关蛋白的表达水平
与对照组比较,模型组小鼠精原细胞Beclin1、Bax、caspase-3表达水平和LC3-Ⅱ/LC3-Ⅰ蛋白比值水平明显上升(P<0.01),p62和Bcl-2蛋白表达水平明显下降(P<0.01);与模型组比较,自噬激动剂干预组小鼠精原细胞Beclin1、Bcl-2蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ蛋白比值均明显上升(P<0.01),p62、Bax和caspase-3蛋白表达水平明显下降(P<0.01);与模型组比较,自噬抑制剂干预组Beclin1、Bcl-2蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ蛋白比值均明显下降(P<0.01),p62、Bax、caspase-3蛋白表达水平明显上升(均P<0.01),见图5。
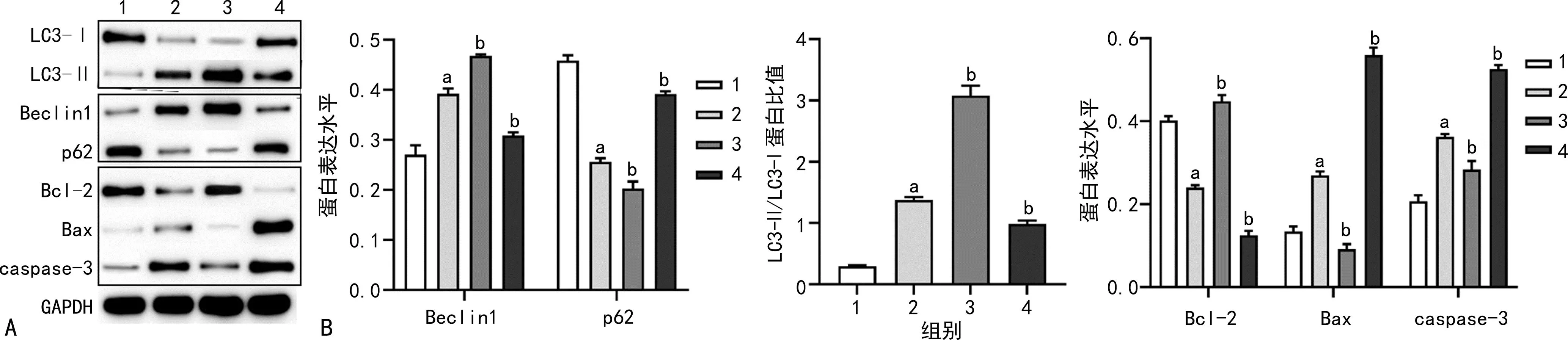
A:Western blot图;B:定量分析图;1:对照组;2:模型组;3:自噬激动剂干预组;4:自噬抑制剂干预组;a:P<0.01,与对照组比较;b:P<0.01,与模型组比较。
3 讨 论
自噬是细胞存活的重要机制,在细胞分化、发育、稳态、细胞存活和死亡中发挥着重要作用[10]。自噬在哺乳动物组织中发挥着多种生理和病理作用[11]。在生理条件下,自噬维持在基础水平,但当细胞受到营养缺乏、缺氧DNA损伤、细胞毒性剂等刺激时,细胞自噬会上调以减轻应激引起的损伤,帮助细胞生存[8]。而本研究中模型组细胞自噬在一定程度上被激活,进一步为自噬减轻缺氧造成的损伤提供了理论支持。因此,本文利用公认的自噬激动剂RAPA[12]和抑制剂3-MA[13],对自噬与睾丸组织IRI之间的关系进行了深入研究。RAPA能够抑制雷帕霉素靶蛋白的表达,激活自噬[14]。3-MA通过阻断自噬体形成和阻止成核阶段来抑制自噬[15]。本研究中H/RI模型组细胞自噬过程被激活时,细胞增殖能力较模型组明显上升,而自噬被抑制时,增殖能力较模型组下降,说明调节细胞自噬能够影响H/RI模型细胞增殖,这与之前的研究一致[16]。
研究表明,自噬的激活能改善年轻大鼠的肾功能,减少肾小管上皮细胞的凋亡和肾组织的损伤评分,对肾IRI损伤发挥保护作用[17]。本研究中,自噬在RAPA的激活下,细胞内LC3-Ⅱ/LC3-Ⅰ蛋白比值、Beclin1蛋白水平较模型组升高,p62水平较模型组下降。LC3是自噬小体成熟标志蛋白,LC3-Ⅰ向LC3-Ⅱ转变,促进自噬体的形成[18]。Beclin1作为自噬调控基因,其表达水平增加能够诱导自噬的发生。p62作为自噬降解的特异性受体,可作为自噬标志物[19]。而自噬在3-MA的抑制下,Beclin1蛋白水平、LC3-Ⅱ/LC3-Ⅰ蛋白比值较模型组下降,进而抑制自噬体的形成。且当自噬被抑制时,p62会不断累积,与LC3结合形成复合物,负性调节自噬活性[20]。
本研究中,在RAPA干预下,自噬被激活,抗凋亡蛋白Bcl-2表达水平较模型组明显上升,caspase-3和促凋亡蛋白Bax表达水平较模型组下降。这减少了因为缺血导致Bax向线粒体外膜易位,抑制了线粒体外膜通透性增加触发的内源性凋亡途径,从而抑制了caspase-3级联反应,使细胞凋亡率明显下降[21]。该结果证明了增强自噬可以避免因ROS过度释放导致的细胞凋亡[22],修复精原细胞组织H/RI损伤。
此外,激活自噬可清除过量ROS,减轻睾丸组织H/RI[23]。IRI后ROS的大量积累会导致氧化应激,阻碍线粒体功能,破坏细胞稳态环境,损害自噬小体的清除[24-25]。本研究中,RAPA干预时,细胞ROS水平较模型组明显降低,细胞凋亡率较模型组明显下降;而3-MA干预时,ROS在细胞内大量积累,细胞凋亡率较模型组明显上升。
综上所述,本研究验证了增强自噬可以一定程度上修复小鼠精原细胞H/RI,抑制细胞凋亡,为治疗睾丸组织IRI提供理论基础。
