全程热疗治疗鼻咽癌颈部转移淋巴结的疗效及对免疫功能的影响*
2023-12-26李晓宇刘德清王雨晴杨丽娜
罗 焱,谢 悦,李晓宇,闫 瑾,刘德清,王雨晴,杨丽娜,王 颖
(重庆大学附属肿瘤医院放疗科,重庆 400030)
鼻咽癌区域淋巴结转移率高达90%[1],诱导化疗后同步放化疗是局部晚期鼻咽癌的标准治疗手段,放化疗后区域淋巴结总体局部控制率约为90%[2-3]。但体积大、中心液化坏死、淋巴结包膜外受侵的转移淋巴结疗效差,残留率高,是复发与远处转移的根源[4]。同时,放化疗诱导免疫原性细胞死亡增强免疫效应的概率低,而热疗通过影响肿瘤微环境调节免疫系统显示出巨大的潜力[5-6]。本研究旨在探讨放化疗联合热疗在肿瘤杀伤、免疫调节方面的协同作用,现报道如下。
1 资料与方法
1.1 一般资料
选取2021年7月至2022年7月本院收治的60例鼻咽癌患者为研究对象。纳入标准:(1)年龄18~69岁;(2)经病理确诊的鼻咽部非角化性鳞状细胞癌,且为初治患者;(3)鼻咽癌分期采用美国癌症联合委员会(AJCC)第8版TNM分期,淋巴结分期为N1、N2、N3且TNM分期为Ⅲ、Ⅳa期;(4)颈部转移淋巴结直径≥4 cm、直径≥2 cm且伴有中心液化坏死、影像学判断的淋巴结包膜外受侵;(5)治疗前Karnofsky功能状态量表(KPS)评分>70分;(6)治疗前白细胞计数>3.5×109/L、血小板计数>100×109/L、血红蛋白>90 g/L,且心、肺、肝、肾功能正常;(7)诱导化疗选择GP方案(吉西他滨1 000 mg/m2+顺铂80 mg/m2,3周1次),同步化疗选择顺铂,放疗方案参照本院放疗科常规放疗方案;(8)所有患者签署知情同意书。排除标准:(1)妊娠及哺乳期妇女;(2)有心、肝、肾及造血功能等异常及精神病者;(3)颈部热疗区域皮肤有破溃者;(4)颈部合并软组织感染者;(5)高热患者;(6)治疗过程中配合性差者。60例研究对象中男33例,女27例,年龄(44.9±8.3)岁。N1期6例、N2期35例、N3期19例。根据治疗方式的不同,所有研究对象分为观察组(诱导化疗+同步放化疗联合热疗)和对照组(诱导化疗+同步放化疗),每组30例,均按治疗计划完成所有治疗并规律随访。
1.2 方法
(1)热疗实施:GP方案诱导化疗期间完成3次热疗(化疗第1、3、8天),同步放化疗期间至少完成5次热疗(2次/周)。热疗仪器采用BSD2000热疗仪2 450 MHz,于放化疗前1 h热疗,温度41~42 ℃,时间30~60 min;(2)诱导化疗实施:至少完成2个周期GP方案诱导化疗;(3)同步放化疗实施:阳性淋巴结剂量69.96 Gy/33 F(Varian直线加速器,6-MV X线,2.12 Gy/F,每周5 F,共7周),同步化疗采用顺铂(每3周100 mg/m2,总剂量≥200 mg/m2)。
1.3 观察指标
(1)近期疗效。所有患者于治疗前、诱导化疗后、放疗后1个月、放疗后3个月完成鼻咽颈部增强MRI、颈部增强CT及其他必需的全身检查。阳性淋巴结疗效评价采用实体瘤疗效评价标准(RECIST)1.1:完全缓解(CR)定义为所有靶病灶消失1个月以上;部分缓解(PR)定义为靶病灶总径与基线相比缩小≥30%;疾病稳定(SD)定义为介于PR和PD;疾病进展(PD)定义为以靶病灶直径和的最小值为参照,直径和增加≥20%,除此之外,必须满足直径和的绝对值增加≥5 mm,或出现1个或多个新病灶。设置主要研究终点为放疗后3个月颈部阳性淋巴结的客观缓解率(CR率+PR率)。(2)EB病毒(EBV)DNA定量检测。分别于治疗前、诱导化疗后、放疗后1个月、放疗后3个月进行检测,每次抽取外周血3 mL,加入乙二胺四乙酸抗凝管中,2 000 r/min离心5 min,取适量血浆进行定量PCR检测,将血浆EBV DNA>500拷贝/mL判定为阳性。(3)不良反应发生情况。在治疗过程中对患者发生的骨髓抑制、恶心呕吐、口腔黏膜炎、放射性皮炎等不良反应进行监测,采用放射治疗治疗协会(RTOG)标准进行评判。(4)外周血淋巴细胞亚群。治疗前、诱导化疗后、放疗后抽取外周血流式检测免疫功能,检测CD3+、CD4+、CD8+、CD4+/CD8+及自然杀伤(NK)细胞水平。(5)热休克蛋白90α(HSP90α)定量检测。于治疗前、治疗后进行检测,每次抽取外周血3 mL加入乙二胺四乙酸抗凝管中,在2~8 ℃条件下3 000 r/mL离心30 min,取适量上清液进行ELISA检测(试剂盒购自广州奥瑞达生物科技有限公司)。
1.4 统计学处理
2 结 果
2.1 两组近期疗效比较
观察组客观缓解率高于对照组,差异有统计学意义(χ2=10.526,P=0.001),见表1。

表1 两组近期疗效评价[n(%),n=30]
2.2 两组EBV DNA比较
治疗前,观察组EBV DNA拷贝数为0~2.67×106/mL,对照组为0~4.15×105/mL,两组EBV DNA拷贝数平均值及阳性率比较,差异无统计学意义(P>0.05)。诱导化疗后,观察组EBV阳性率低于对照组,差异有统计学意义(P<0.05),见表2。对照组2例患者完成治疗后仍未转阴,其中1例放疗后3个月EBV DNA升高,完善检查后确定远处转移。
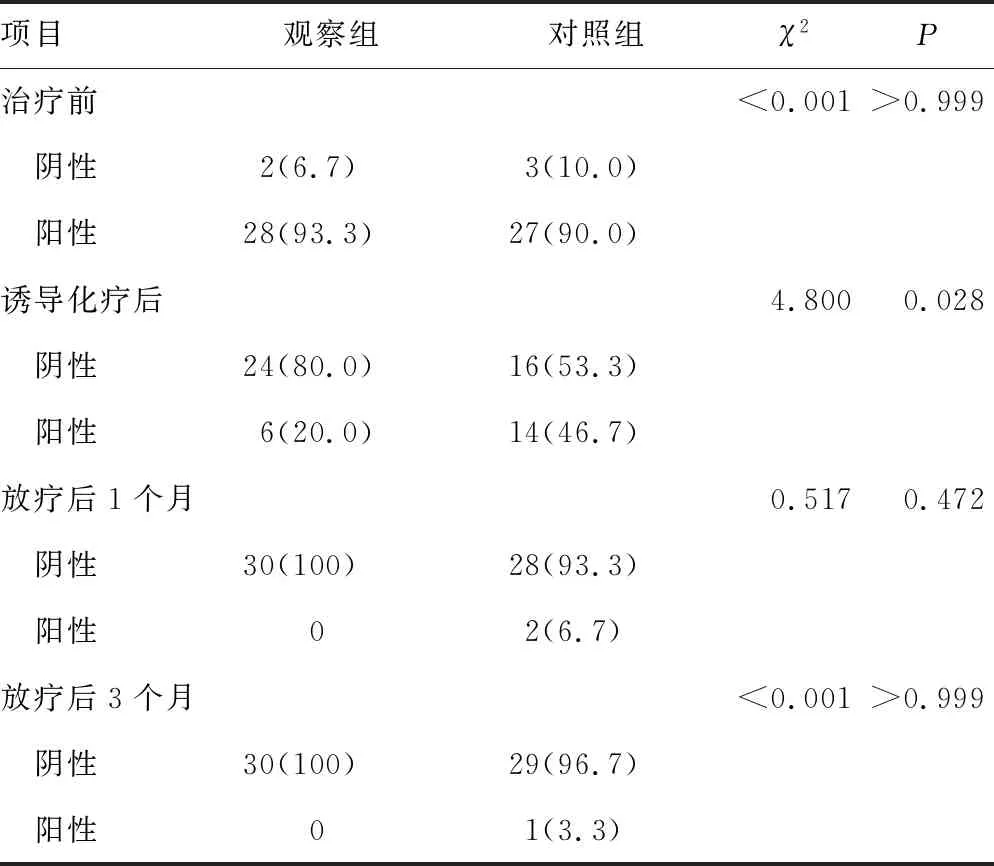
表2 两组EBV DNA比较[n(%),n=30]
2.3 两组不良反应发生情况比较
观察组≥3级的放射性皮炎发生率高于对照组(P<0.05),发生部位与热疗部位一致,见表3。
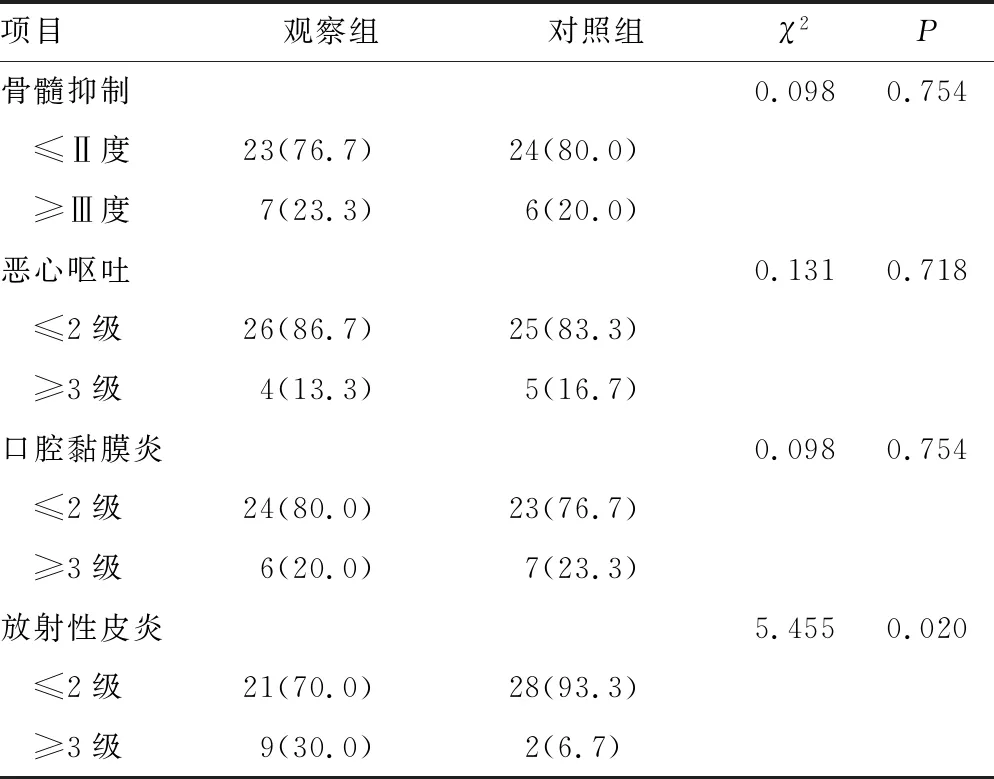
表3 两组不良反应发生情况比较[n(%),n=30]
2.4 两组外周血淋巴细胞亚群计数比较
治疗前两组外周血各淋巴细胞亚群计数比较,差异无统计学意义(P>0.05)。与治疗前比较,放疗后观察组CD3+、CD4+、CD8+、CD4+/CD8+水平下降,对照组CD3+、CD4+、CD4+/CD8+水平下降(P<0.05)。放疗后观察组NK细胞水平较治疗前升高,且高于对照组(P<0.05),见表4。
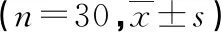
表4 两组外周血淋巴细胞亚群计数比较
2.5 两组HSP90α水平比较
治疗前两组HSP90α水平比较,差异无统计学意义(P>0.05)。治疗后观察组HSP90α水平较治疗前升高,且高于对照组(P<0.05),见表5。
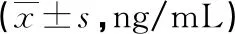
表5 两组HSP90α水平比较
3 讨 论
颈部淋巴结转移是鼻咽癌最常见的首发表现之一。对于局部晚期鼻咽癌,中国临床肿瘤学会鼻咽癌诊治指南、中国放射治疗指南等均提出诱导化疗后同步放化疗是目前的标准治疗手段[7-9],5年总生存率在80%以上,5年局部及区域控制率高达90%~95%[10-11]。但在临床实践中发现,直径较大(≥4 cm)、伴中心液化坏死(直径≥2 cm)或淋巴结包膜外受侵的转移淋巴结经标准治疗后残留率较高,后续往往还需要辅助或挽救治疗,增加患者经济负担且影响疗效,同时还是局部复发和远处转移的根源。有研究报道,颈部转移淋巴结的大小与放疗结束后的残留率具有相关性[12-13]。因此,对部分患者增加局部治疗强度是必要的。
有研究表明,热疗与放化疗具有协同作用[14-15],热疗可改善肿瘤区域乏氧、增加放疗敏感性、增加化疗药物进入肿瘤细胞[15-16];热疗与放疗可作用于不同细胞周期的肿瘤细胞[17],两者互补;热疗增加化疗药物与肿瘤细胞DNA的作用[18],增加杀伤作用,并能促进肿瘤细胞凋亡与抑制耐药基因表达、延缓放疗所致的亚致死性损伤的修复[19-20]。因此,本研究将热疗提前至诱导化疗阶段,在诱导化疗、同步放化疗阶段全程介入。结果显示,与对照组比较,放疗后3个月观察组客观缓解率更高(100%vs.90.0%,P<0.05),显示出热疗与放化疗具有协同效应。同时,诱导化疗后EBV阳性率明显低于对照组(20.0%vs.46.7%,P<0.05),表明观察组EBV DNA得到更快速、有效的控制。但热疗联合放疗还是不同程度地增加了颈部皮肤放射性皮炎的发生率,尤其是≥3级的放射性皮炎(30.0%vs.6.7%,P<0.05),值得引起重视,需要进一步优化热疗联合治疗的时机和强度。而本研究中观察组≥3级的放射性皮炎发生率高于既往文献报道,可能与样本量较小有关。两组骨髓抑制、恶心呕吐、口腔黏膜炎发生率比较,差异无统计学意义(P>0.05),考虑这些不良反应主要来自化疗药物及放疗自身带来的副作用。
T细胞亚群是抗肿瘤细胞免疫反应的主要免疫细胞,研究较多的包括现CD3+、CD4+、CD8+T细胞和NK细胞[21]。传统的化疗、放疗等抗肿瘤治疗手段在杀伤肿瘤细胞的同时,也会无差别地杀灭机体的免疫活性细胞[22]。研究显示,热疗可以增加肿瘤部位淋巴细胞的浸润[23-24],增强对肿瘤细胞的杀伤作用。本研究在7例观察组患者和5例对照组患者中检测了血清HSP90α的表达情况,结果显示观察组HSP90α的表达水平较治疗前升高,且高于对照组,表明热疗可促进免疫细胞在体内的快速迁移、渗出血管,增强肿瘤免疫细胞浸润,但本研究中检测HSP90α的样本量较小,临床意义还需要进一步探讨。本研究中,两组诱导化疗后外周血各淋巴细胞亚群稍有下降,表明短周期数的诱导化疗对机体的免疫功能损伤相对较小。而放疗后CD3+、CD4+、CD8+、CD4+/CD8+水平明显下降,表明放疗对机体免疫系统的损伤更大,且主要损伤的是辅助性T细胞。观察组NK细胞比例升高,且高于对照组(P<0.05),表明热疗对放化疗后免疫功能损伤具有一定的正向调节作用,但局部热疗作用范围有限,尚不足以引发全身免疫功能重塑。同样,程序性死亡受体1(PD-1)作为共刺激分子参与T细胞的免疫应答,并在肿瘤免疫逃逸机制中发挥重要作用,研究中CD4+、CD4+/CD8+水平下降可能与PD-1的高表达密切相关。
综上所述,针对本研究筛选入组高危型颈部转移淋巴结的鼻咽癌患者,诱导化疗及同步放化疗阶段全程介入热疗能增加近期疗效,且对免疫功能具有一定的正向调节作用,具有临床应用价值。后续可以设计热疗通过HSP90α的高表达增强免疫应答、放化疗后CD4+T细胞下降与PD-1表达之间的关系进行研究,进一步阐明热疗参与鼻咽癌放化疗过程免疫调节的机制。
